2. 中山大学药学院, 广州 510006
2. School of Pharmaceutical Science, Sun Yat-sen University, Guangzhou 510006, China
心脏毒性是药物研发失败和临床应用撤市的重要原因。在过去的10年里,在所有停用撤市的药物中,由于心脏缺血和心律失常导致的心脏毒性事件占比高达45%[1],因此开发早期有效的心脏毒性筛选模型对降低新药开发的经济风险,提高研发成功率显得尤为迫切。新的心脏毒性评价策略——综合性离体致心律失常风险评估(comprehensive in vitro proarrhythmia assay,CiPA)倡议从人类自身机制出发,研究药物对人类心脏多个离子通道的影响,并应用计算机模拟技术以及人源化细胞系进行综合评估,而不是仅仅依靠hERG通道阻滞和心电图QT间期延长[2]。人源诱导多能干细胞分化的心肌细胞(human induced pluripotent stem cell-derived cardiomyocytes,hiPSC-CMs)的形态结构、基因表达、离子通道表达量及功能、动作电位和收缩特点与人心肌细胞极为相似,被认为是体外检测心脏毒性的极佳细胞模型[3]。实时细胞分析(real time cellular analysis,RTCA)技术是一种基于阻抗的瞬时细胞电感应连续记录系统,能够无标记无侵入地实时监测心肌细胞的搏动、生长及形态学变化等过程。在相对生理条件下通过观察心肌细胞指数(cell index,CI)、搏动频率(beat rate,BR)、搏动振幅(amplitude,AMP)等指标,对先导化合物进行临床前早期评估,判断具有良好的灵敏度和准确性。因此,本实验利用hiPSC-CMs结合RTCA技术,建立实时心脏毒性评价系统,选用CiPA倡议认证的不同致心律失常风险等级的化合物[4],验证了其对hiPSC-CMs的影响,从而为推动该评价系统应用于心脏毒性筛选提供方法学参考和理论依据。
1 材料 1.1 细胞hiPSC-CMs,购自北京赛贝生物技术有限公司,心肌细胞纯度为99%以上。
1.2 受试物及主要试剂CardioEasy心肌细胞维持培养基(北京赛贝生物技术有限公司,批号BG17CX162,货号CA2003500),Matrigel(Sigma,66540030-1VL)、DMSO、西沙必利、特非那定、维拉帕米、阿霉素、美西律、E-4031、苄普地尔、多非利特等阳性化合物均购自Sigma公司。根据课题组前期试验探索结果,将受试物配制成适当浓度,见表 1。
|
|
表 1 阳性化合物和浓度 Tab.1 Positive compounds and concentrations |
5%CO2恒温培养箱(Thermo Scientific公司),CKX31型倒置显微镜(Olympus公司),xCELLigence实时无标记细胞功能分析仪(艾森生物杭州有限公司),0.22 μm微孔滤膜(Millipore公司),E-plate96(艾森生物杭州有限公司),H500FRS型高速离心机(Kokusan公司),聚丙烯离心管(Corning公司),电热恒温水浴锅(上海冠森生物科技有限公司)。
2 方法 2.1 hiPSC-CMs复苏及生长情况监测预先使用磷酸盐缓冲溶液(phosphate buffer saline,PBS)1:100稀释的Matrigel工作液完全覆盖E-plate 96孔板,以促使心肌细胞贴壁,37 ℃ 5% CO2恒温培养箱包被4 h。移除包被液后每孔加入100 μL心肌维持培养基,Cardio检测工作台获取背景值。hiPSC-CMs在包被过Matrigel的培养板中至少培养1周。37 ℃水浴锅内复苏商业来源的心肌细胞,转移1 mL细胞悬液至15 mL离心管内,以每秒1滴的速率,逐滴加入心肌维持培养基4 mL,不断轻摇混匀。常温下200 g离心5 min,加入适量心肌维持培养基重悬细胞,轻揉吹打混匀,并调整心肌细胞密度为25×104个·mL-1,将100 μL细胞悬液接种于E-plate 96孔板内,于生物安全柜中静置30 min后转移至37℃ 5% CO2恒温培养箱,每48 h每孔更换150 μL新鲜心肌维持培养基,设置扫描监测间隔为1 h。通过RTCA系统实时监测心肌细胞180 h的生长情况,并获取动态搏动轨迹和细胞指数曲线。
2.2 受试物配制实验用受试物均购自Sigma-Aldrich,以受试物试验最高浓度的1 000倍将受试物溶解于DMSO中配制成母液,存储于-20 ℃中备用。加药前使用培养基将受试物母液稀释至最终浓度的20倍,并使用0.22 μm微孔滤膜过滤,其中DMSO浓度不超过0.1%(v/v)。0.1%DMSO作为本实验的空白对照。
2.3 RTCA监测hiPSC-CMs细胞心肌毒性方法的验证hiPSC-CMs以每孔2.5×104个细胞培养于E-plate 96孔板内(课题组前期摸索得到该细胞铺板密度),细胞贴壁48 h后更换新鲜培养基,持续培养至细胞指数、搏动频率、幅度等指标趋于平稳后方可进行受试物实验(细胞指数>5,搏动频率50~90次·min-1,振幅>0.02),细胞给予受试物前每孔更换为190 μL新鲜培养基,并将细胞置于培养箱平衡4 h后每孔加入10 μL阳性药物,每个受试物浓度设置3个复孔,监测间隔为10 min,连续实时监测48 h。
3 数据处理采用RTCA系统离线模式导出心肌细胞的细胞生长指数、搏动频率及幅度值,并与给药前的初始值进行归一化处理,将给予受试物时刻作为基点,初始值均为1。每个受试物至少单独进行3次独立实验,采用双因素方差分析(Two-way ANOVA)方法处理实验数据,数据表示为Mean±SEM,*P < 0.05,**P < 0.01,#P < 0.001。
4 结果 4.1 实时监测hiPSC-CMs的生长情况如图 1所示,hiPSC-CMs铺板后RTCA系统实时监测培养180 h,可见随着时间的延长,心肌细胞的细胞指数逐渐增大,心肌细胞在90 h内生长活跃,呈对数增长趋势。更换培养基后细胞指数出现小幅波动,并在短期内恢复正常。当培养时间达到100 h后,细胞指数增幅降低,表明细胞生长达到平台期,直至140 h达到峰值。心肌细胞培养48 h后开始自发性搏动,但搏动幅度较小。hiPSC-CMs是人源化心肌细胞,因此其搏动频率接近正常成人的心率值(60~100次·min-1)。图 1-E、F表现了心肌细胞的频率、振幅随时间的变化过程。心肌细胞每48 h更换培养基培养1周后,细胞生长曲线达到平台期,不同孔间的心肌细胞搏动轨迹更加规则一致,表明形成了致密的细胞单层,因而选择此时给予受试物。

|
A. 96孔电极细胞培养板(96-well impedance sensor array)B.检测设备(detection instrument)C. hiPSC-CMs培养180 h的生长曲线(raw growth curve of hiPSC-CMs for 180 h)D~G. hiPSC-CMs培养180 h内的细胞指数(D)、频率(E)、振幅(F)、搏动图谱(G)[development of cell index(D),beat rate(E),amplitude(F),beating trace(G)of hiPSC-CMs over 180 h] 图 1 xCELLigence RTCA Cardio装置 Fig.1 xCELLigence RTCA Cardio setup |
阿霉素作为蒽环类抗肿瘤药物之一,用于急、慢性淋巴细胞白血病及实体瘤的治疗。然而阿霉素导致的骨髓抑制、心脏毒性严重影响了阿霉素在临床中的应用,其心脏毒性表现为扩张性心肌病、心衰等[5]。3 μmol·L-1阿霉素短期作用12 h内心肌细胞搏动频率增加了41.3%,而浓度低于1 μmol·L-1却无显著性差异。阿霉素量效依赖性地增强心肌细胞搏动频率,缩短增幅(图 2-A、B),同时1 μmol·L-1阿霉素即降低细胞活力,3 μmol·L-1阿霉素持续影响细胞活力,作用24 h后细胞指数显著降低(图 2-C),表明心肌细胞活力急剧下降,进而造成搏动停止并难以检测搏动信号(图 2-D)。与对照组相比,24 h内各剂量组搏动幅度分别下降了21.8%、28.5%、100%。以上结果吻合了阿霉素对心肌细胞抑制作用的时效和量效依赖性特点[6]。细胞指数随剂量升高而降低,显示出明显的剂量依赖性的细胞毒效应。
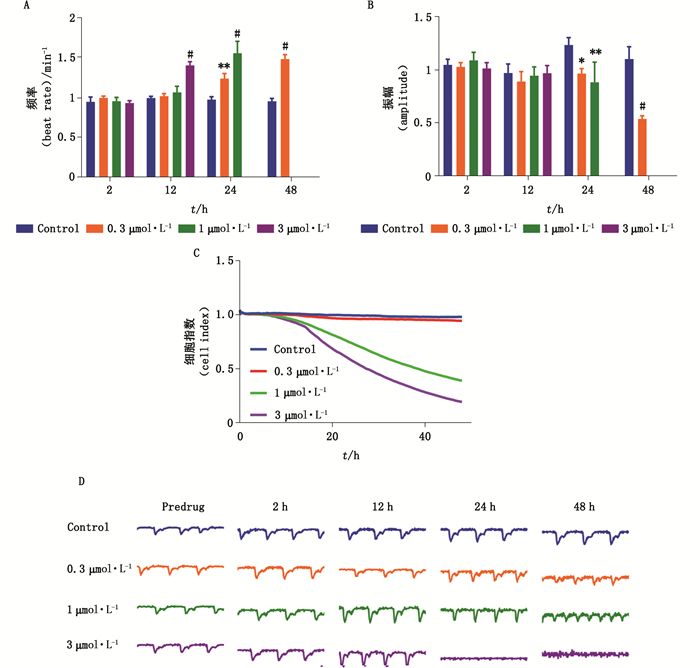
|
图 2 阿霉素对hiPSC-CMs搏动频率(A)、振幅(B)、细胞指数(C)、搏动图谱(D)的影响(数据表示为mean±SEM,n=9,*P < 0.05,**P < 0.01,#P < 0.001) Fig.2 The effects of doxorubicin on beating rate(A), contraction amplitude(B), cell index(C), and beating trace(D)in hiPSC-CMs(data represent for mean±SEM, n=9, *P < 0.05, **P < 0.01, #P < 0.001) |
hiPSC-CMs给予系列浓度E-4031处理后,1 μmol·L-1 E- 4031显著降低心肌细胞搏动频率,缩短振幅,随着作用时间延长,与空白对照组相比,E-4031对心肌细胞影响未见具有统计学意义的改变(图 3-B)。选择性hERG通道阻滞剂多非利特显著降低心肌细胞搏动幅度及频率(图 4-A、B)。0.1 μmol·L-1以上的多非利特短期作用后即抑制心肌细胞搏动,造成搏动骤停(图 4-D),10 h后心肌细胞恢复搏动。尽管如此,0.3 μmol·L-1多非利特仍持续抑制心肌细胞搏动,作用24 h后引起心肌搏动骤停,且不再恢复搏动。
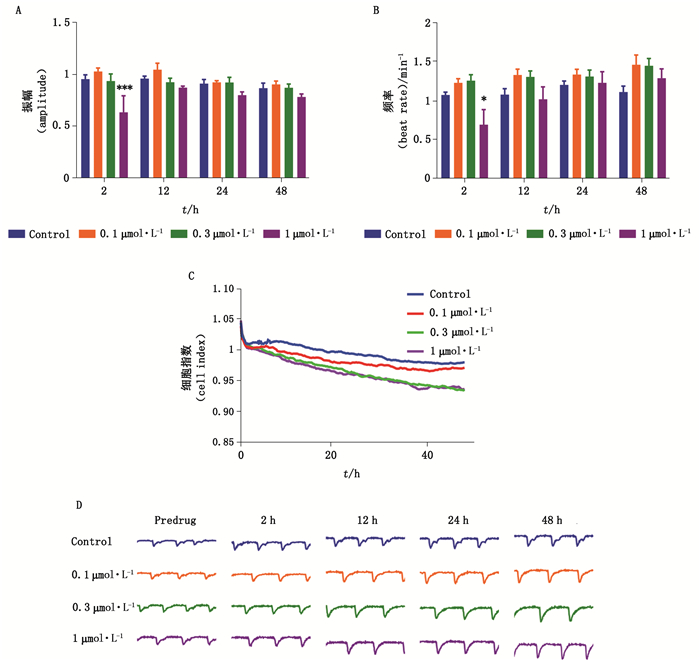
|
图 3 E-4031对hiPSC-CMs搏动频率(A)、振幅(B)、细胞指数(C)、搏动图谱(D)的影响(数据表示为mean±SEM,n=9,*P < 0.05,**P < 0.01,#P < 0.001) Fig.3 The effects of E-4031 on beating rate(A), contraction amplitude(B), cell index(C), and beating trace(D)in hiPSC-CMs(data represent for mean±SEM, n=9, *P < 0.05, **P < 0.01, #P < 0.001) |
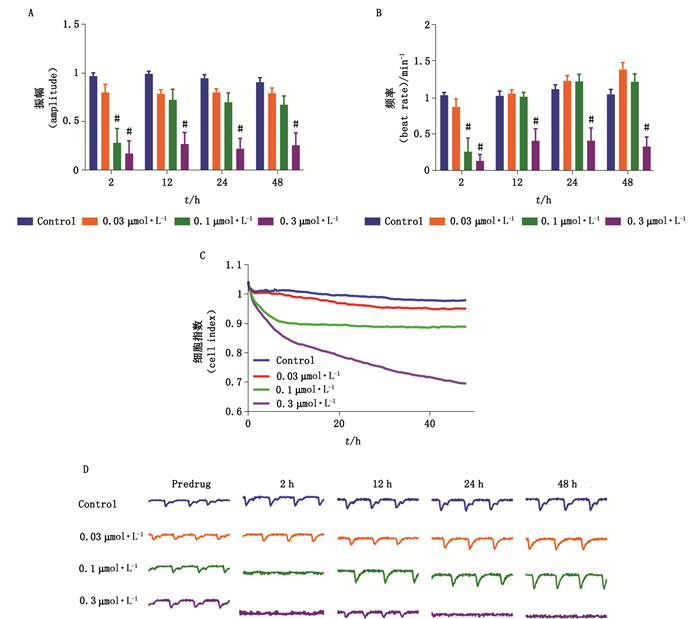
|
图 4 多非利特对hiPSC-CMs搏动频率(A)、振幅(B)、细胞指数(C)、搏动图谱(D)的影响(数据表示为mean±SEM,n=9,*P < 0.05,#P < 0.01,**P < 0.001) Fig.4 The effects of dofetilide on beating rate(A), contraction amplitude(B), cell index(C), and beating trace(D)in hiPSC-CMs(data represent for mean±SEM, n=9, *P < 0.05, **P < 0.01, #P < 0.001) |
美西律为Ⅰb类抗心律失常药,可抑制心肌细胞钠内流,同时不延长心室除极和复极时程,主要用于治疗慢性室性心律失常。美西律几乎不影响心肌细胞活力,30 μmol·L-1美西律作用2 h内心肌细胞搏动频率相对空白对照组降低了66.4%,振幅缩短了60.7%(图 5-A、B),并导致心肌细胞搏动周期延长;30 μmol·L-1美西律作用10 h后心肌细胞出现不规则搏动(图 5-D),这也与美西律临床剂量过大引起的房室传导阻滞及严重心律失常等不良反应一致。
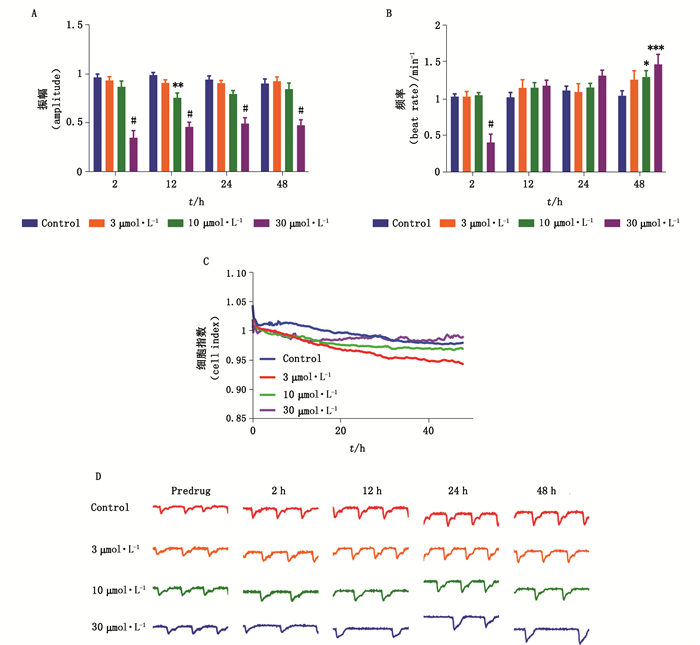
|
图 5 美西律对hiPSC-CMs搏动频率(A)、振幅(B)、细胞指数(C)、搏动图谱(D)的影响(数据表示为mean±SEM,n=9,*P < 0.05,**P < 0.01,#P < 0.001) Fig.5 The effects of Mexiletine on beating rate (A), contraction amplitude (B), cell index(C), and beating trace(D) in hiPSC-CMs(Data represent for mean±SEM, n=9, *P < 0.05, **P < 0.01, #P < 0.001) |
苄普地尔抑制Ca2+慢通道,选择性地扩张冠脉,同时还抑制Na+、K+通道,因而具有Ⅰa、Ⅲ及Ⅳ类抗心律失常药物特性。苄普地尔浓度低于1 μmol·L-1时对心肌细胞无影响(图 6-A、B),3 μmol·L-1苄普地尔作用2 h导致心肌细胞搏动间歇性停搏(图 6-D),并伴随细胞活力轻微下降(图 6-C)。
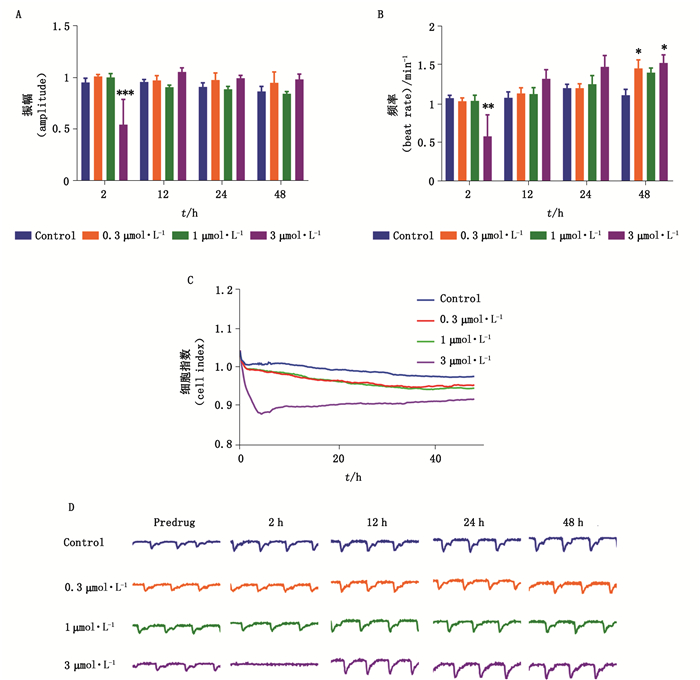
|
图 6 苄普地尔对hiPSC-CMs搏动频率(A)、振幅(B)、细胞指数(C)、搏动图谱(D)的影响(数据表示为mean±SEM,n=9,*P < 0.05,**P < 0.01,#P < 0.001) Fig.6 The effects of bepridil on beating rate(A), contraction amplitude(B), cell index(C), and beating trace(D) in hiPSC-CMs(data represent for mean±SEM, n=9, *P < 0.05, **P < 0.01, #P < 0.001) |
L-Ca2+通道阻滞剂和hERG阻滞剂维拉帕米轻微影响心肌细胞活力,与空白对照组相比,维拉帕米作用2 h内各剂量组心肌细胞搏动频率分别增强了12.2%、13.1%、52.3%,而振幅分别降低了20.0%、61.7%、67.6%(图 7-A、B)。0.3 μmol·L-1以上浓度的维拉帕米持续降低心肌细胞收缩力导致搏动骤停,可能与钙电流(ICa)被强烈抑制有关(图 7-D)。然而0.3 μmol·L-1维拉帕米引起的心肌搏动骤停在10 h内可恢复搏动。

|
图 7 维拉帕米对hiPSC-CMs搏动频率(A)、振幅(B)、细胞指数(C)、搏动图谱(D)的影响(数据表示为mean±SEM,n=9,*P < 0.05,**P < 0.01,#P < 0.001) Fig.7 The effects of verapamil on beating rate (A), contraction amplitude(B), cell index(C), and beating trace(D) in hiPSC-CMs(data represent for mean±SEM, n=9, *P < 0.05, **P < 0.01, #P < 0.001) |
特异外周H1受体拮抗剂特非那定最早用于治疗过敏性疾病,然而特非那定有类似奎尼丁作用,可阻滞心肌细胞K+通道,延长QT间期,继而导致多型性室性心律失常[7]。目前已被撤市或限制使用。2018年我国2种感冒复方胶囊皆因含有特非那定成分而被召回撤市。本实验中,特非那定浓度≥1 μmol·L-1时短时间内即导致心肌细胞间歇性搏动骤停(图 8-D)。与此同时,特非那定轻微抑制心肌细胞活力,随着作用时间延长,心肌细胞逐渐恢复自发性搏动(图 8-D)。3 μmol·L-1组细胞指数在加入特非那定后随时间不断下降,之后有一定程度的回升;而0.3 μ mol·L-1组细胞生长情况与对照组趋势一致,细胞指数基本保持不变(图 8-C)。
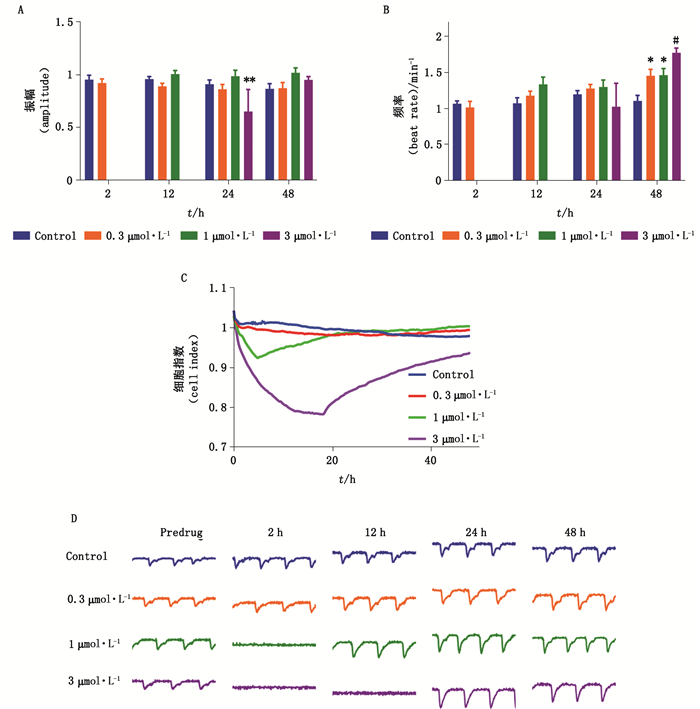
|
图 8 特非那定对hiPSC-CMs搏动频率(A)、振幅(B)、细胞指数(C)、搏动图谱(D)的影响(数据表示为mean±SEM,n=9,*P < 0.05,**P < 0.01,#P < 0.001) Fig.8 The effects of terfenadine on beating rate(A), contraction amplitude(B), cell index(C), and beating trace(D) in hiPSC-CMs(data represent for mean±SEM, n=9, *P < 0.05, **P < 0.01, #P < 0.001) |
西沙必利是一种胃肠促动力药,主要用于功能性消化不良等。动物实验证实豚鼠和兔静脉输注西沙必利10 mg·kg-1·h-1 1 h后QT间期和RR期显著延长,并伴随心率减慢[8]。加入西沙必利后,10 μmol·L-1以上浓度剂量组的心肌细胞频率不断降低,同时细胞指数随时间轻微下降,之后维持在一定水平(图 9-C)。与空白对照组相比,西沙必利短期作用2 h内显著降低心肌细胞搏动频率和幅度(图 9-A、B),10 μmol·L-1以上浓度的西沙必利持续抑制心肌细胞搏动频率,西沙必利30 μmol·L-1导致心肌细胞“间歇性搏动骤停”(图 9-D),然而西沙必利1 μmol·L-1和10 μmol·L-1未见心律失常现象,随后心肌细胞恢复自发性搏动。
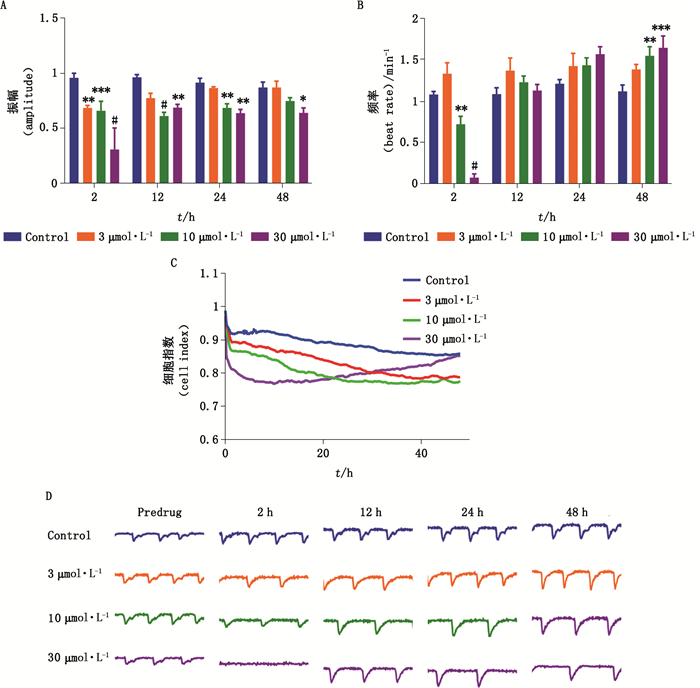
|
图 9 西沙必利对hiPSC-CMs搏动频率(A)、振幅(B)、细胞指数(C)、搏动图谱(D)的影响(数据表示为mean±SEM,n=9,*P < 0.05,**P < 0.01,#P < 0.001) Fig.9 The effects of cisapride on beating rate(A), contraction amplitude(B), cell index(C), and beating trace(D) in hiPSC-CMs(data represent for mean±SEM, n=9, *P < 0.05, **P < 0.01, #P < 0.001) |
实时无标记细胞功能分析仪能实时监测药物对心脏毒性和心脏搏动节律的影响,分析心肌细胞搏动功能,进而实时监测心脏毒性,同时数据记录完整客观,因此该仪器广泛适用于预测候选药物的潜在心脏毒性。与传统的非人源细胞hERG评估和灵长类动物实验相比,hiPSC-CMs克服了种属差异,是心脏毒性最理想的研究模型[9]。因此hiPSC-CMs不仅减少了不必要的动物实验,同时也增加了药物毒性预测的准确性。在hiPSC-CMs联合RTCA系统建立的心肌毒性早期筛选平台上,通过给予hiPSC-CMs不同作用靶点的致心律失常阳性化合物,提供了心肌细胞染毒后连续时间点的搏动轨迹,清晰地展现了毒性效应过程。试验结果表明,该试验系统均能精确检测出它们对hiPSC-CMs的影响,阿霉素此类心肌结构损伤化合物诱导心肌细胞活力下降,导致心肌细胞凋亡,并降低心肌搏动幅度,与其所致左心室射血分数下降临床指征一致。而致心律失常类化合物则主要引起心肌除极化、复极化异常,心肌细胞染毒后表现出不同程度的心动过缓、室速等心律失常不良反应。这些结果与目前已发表的文献结果及临床报道[10]吻合,表明hiPSC-CMs联合RTCA技术可以作为心肌毒性早期筛选模型。
5.2 验证化合物致心律失常风险hERG通道在心脏安全性评价中扮演着重要的角色,药物阻滞hERG通道引起K+浓度降低,快激活整流钾电流(IKr)减小,动作电位时程(APD)异常延长,引起早期后除极(EAD),并可能诱发严重的室性心律失常-尖端扭转室性室速(torsade de pointes,TdP),是该病引起心脏猝死(sudden cardiac death)的主要原因[11]。心脏心律失常60%~80%与hERG通道阻滞有关,因此该实验系统验证了典型hERG阻滞剂多非利特、E-4031的致心律失常作用。本次试验中选择性hERG阻滞剂多非利特等造成不同程度的心动过缓、心律不齐等不良反应,验证了该事实。值得注意的是,高剂量的多离子通道阻滞剂如维拉帕米、特非那定等在短时间给药后易引起hiSPC-CMs搏动骤停,表明染毒浓度过高,进而出现急性毒性。而在低浓度下对hERG通道的抑制作用表现突出,表现为心律失常不良反应。原因在于多离子通道阻滞剂高浓度时表现出ICa和INa的抑制效应,最大除极速率降低,伴随着QRS间期延长[12],同时抑制ICa和INa逆转了抑制IK易致的心律失常[13]。E-4031和多非利特由于抑制hERG基因编码的心脏延迟整流钾电流的α亚单位,导致心电图上表现为QT间期延长,容易产生室性心律失常,尤其是尖端扭转型室性心动过速。然而与文献现有的研究结果[14]相比,本实验中心肌细胞对E-4031的敏感度较低,仅当浓度为1 μmol·L-1时表现为轻微抑制作用,而非文献中的30 nmol·L-1[14]。试验过程也未见类似EAD的异常复极化波形和触发活动(trigger activity),两者均为心律失常的监测标志物。猜测可能与心肌细胞组分有关,hiPSC-CMs是许多亚型心肌细胞的混合物(心室样、心房样和窦房节样)[15],同时hiPSC-CMs培养后期成纤维细胞数目激增,可能影响心肌细胞药理学应答。不同商业来源的心肌细胞离子通道基因的表达情况也可能不同,通过不同的干细胞分化方法得到的心肌细胞可能也导致灵敏度差异产生。
5.3 不足与展望虽然hiPSC-CMs显示了许多正常人心肌细胞的功能特征,然而利用重编程技术分化的心肌细胞为“幼稚型”心肌细胞,仍不完全成熟。并且缺乏成熟心肌细胞的相关特征,如全功能的浆肌层网状结构或横管系统[16],同时二维培养的心肌细胞缺乏心脏的三维结构,Correia等[17]发现hiPSC-CMs三维培养显示糖酵解和脂质生物合成相关基因下调,同时心肌细胞的纯度和成熟度也显著改善。因此,后期研究将使用更成熟,纯度更高的心室样心肌细胞,并开发三维培养方法。同时还应开展多地能力验证试验,以促进该早期评价体系的广泛应用。
综上所述,RTCA技术作为一种新的心脏安全检测方法,联合hiPSC-CMs具备预测药物诱发的心脏毒性风险的潜力。
| [1] |
VARGA ZV, FERDINANDY P, LIAUDET L, et al. Drug-induced mitochondrial dysfunction and cardiotoxicity[J]. Am J Physiol Heart Circ Physiol, 2015, 309(9): H1453. DOI:10.1152/ajpheart.00554.2015 |
| [2] |
胡晓敏, 张子腾, 宗英, 等. 心脏安全药理学评价新策略-CiPA[J]. 中国新药杂志, 2016, 25(17): 1939. HU XM, ZHANG ZT, ZONG Y, et al. A new strategy for pharmacological evaluation of cardiac safety CiPA[J]. Chin J New Drugs, 2016, 25(17): 1939. |
| [3] |
YAMAMOTO W, ASAKURA K, ANDO H, et al. Electrophysiological characteristics of human iPSC-derived cardiomyocytes for the assessment of drug-induced proarrhythmic potential[J]. PLoS One, 2016, 11(12): e0167348. DOI:10.1371/journal.pone.0167348 |
| [4] |
KANDA Y, YAMAZAKI D, OSADA T, et al. Development of torsadogenic risk assessment using human induced pluripotent stem cell-derived cardiomyocytes:Japan iPS Cardiac Safety Assessment (JiCSA) update[J]. J Pharmacol Sci, 2018, 138(4): 233. DOI:10.1016/j.jphs.2018.10.010 |
| [5] |
SHAFEI A, EL-BAKLY W, SOBHY A, et al. A review on the efficacy and toxicity of different doxorubicin nanoparticles for targeted therapy in metastatic breast cancer[J]. Biomed Pharmacother, 2017, 95: 1209. DOI:10.1016/j.biopha.2017.09.059 |
| [6] |
崔宁, 柯兵兵, 吴福建, 等. 阿霉素致人诱导性多潜能干细胞来源的心肌细胞损伤模型的建立[J]. 解剖学报, 2018, 49(3): 309. CUI N, KE BB, WU FJ, et al. Establishment of doxorubicin induced cardiomyocyte injury model by human induced pluripotent stem cell-derived cardiomyocytes[J]. Acta Anat Sin, 2018, 49(3): 309. |
| [7] |
PAAKKARI I. Cardiotoxicity of new antihistamines and cisapride[J]. Toxicol Lett, 2002, 127(1-3): 279. DOI:10.1016/S0378-4274(01)00510-0 |
| [8] |
KⅡ Y, NAKATSUJI K, NOSE I, et al. Effects of 5-HT(4) receptor agonists, cisapride and mosapride citrate on electrocardiogram in anaesthetized rats and guinea-pigs and conscious cats[J]. Pharmacol Toxicol, 2001, 89(2): 96. DOI:10.1034/j.1600-0773.2001.d01-142.x |
| [9] |
KITAGUCHI T, MORIYAMA Y, TANIGUCHI T, et al. CSAHi study:detection of drug-induced ion channel/receptor responses, QT prolongation, and arrhythmia using multi-electrode arrays in combination with human induced pluripotent stem cell-derived cardiomyocytes[J]. J Pharmacol Toxicol Methods, 2017, 85: 73. DOI:10.1016/j.vascn.2017.02.001 |
| [10] |
DOERR L, THOMAS U, GUINOT DR, et al. New easy-to-use hybrid system for extracellular potential and impedance recordings[J]. J Lab Autom, 2015, 20(2): 175. DOI:10.1177/2211068214562832 |
| [11] |
OBERGRUSSBERGER A, JUHASZ K, THOMAS U, et al. Safety pharmacology studies using EFP and impedance[J]. J Pharmacol Toxicol Methods, 2016, 81: 223. DOI:10.1016/j.vascn.2016.04.006 |
| [12] |
罗卓卡, 李雪华, 刘磊, 等. 安全性评价对照药E-4031、特非那丁、西沙必利和维拉帕米的心脏电生理特征[J]. 中国新药杂志, 2014, 23(2): 196. LUO ZK, LI XH, LIU L, et al. Characteristics of the effects of E-4031, terfenadine, cisapride and verapamil on cardiac electrophysiology[J]. Chin J New Drugs, 2014, 23(2): 196. |
| [13] |
BLINOVA K, STOHLMAN J, VICENTE J, et al. Comprehensive translational assessment of human-induced pluripotent stem cell derived cardiomyocytes for evaluating drug-induced arrhythmias[J]. Toxicol Sci, 2017, 155(1): 234. DOI:10.1093/toxsci/kfw200 |
| [14] |
HARRIS K, AYLOTT M, CUI Y, et al. Comparison of electrophysiological data from human-induced pluripotent stem cell-derived cardiomyocytes to functional preclinical safety assays[J]. Toxicol Sci, 2013, 134(2): 412. DOI:10.1093/toxsci/kft113 |
| [15] |
ASAKURA K, HAYASHI S, OJIMA A, et al. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes[J]. J Pharmacol Toxicol Methods, 2015, 75: 17. DOI:10.1016/j.vascn.2015.04.002 |
| [16] |
BRECKWOLDT K, LETUFFE-BRENIERE D, MANNHARDT I, et al. Differentiation of cardiomyocytes and generation of human engineered heart tissue[J]. Nat Protoc, 2017, 12(6): 1177. DOI:10.1038/nprot.2017.033 |
| [17] |
LABARGE W, MATTAPPALLY S, KANNAPPAN R, et al. Maturation of three-dimensional, hiPSC-derived cardiomyocyte spheroids utilizing cyclic, uniaxial stretch and electrical stimulation[J]. PLoS One, 2019, 14(7): e0219442. DOI:10.1371/journal.pone.0219442 |
 2020, Vol. 40
2020, Vol. 40 
