腺相关病毒(AAV)是一种小的无被膜单链DNA病毒,基因组长度约为4.7 kb,基因组的两端为反向末端重复序列(ITR),ITR是病毒包装和传代所必须的最少自身序列,也是各种重组腺相关病毒(rAAV)载体所共有的AAV源序列[1]。基因组的中间为2个开放阅读框Rep和Cap[2],基因治疗的rAAV载体将Rep和Cap基因替换为外源基因及其调控元件[3]。rAAV基因治疗载体近年来得到了迅速的发展[4],其对人类无致病性,具有高转导效率,低炎症反应和广泛的宿主靶向性等优点,是基因治疗领域最具前景的载体之一。截止2018年11月13日,145例rAAV相关的临床试验已经在clinical trails.gov注册[4]。
rAAV基因治疗药物的质量控制是产品研发和生产的一个重要环节[5],其中准确的滴度测定是一项关键性指标。AAV基因治疗药物的临床剂量通常基于rAAV载体的基因组滴度,准确地定量载体是药物获得最大疗效和最小毒性的前提条件[6],也是不同工艺和不同厂家产品横向比较的依据[7]。rAAV基因组滴度目前常用实时荧光定量PCR(quantitative real-time PCR,Q-PCR)方法测定,采用已知拷贝数的质粒DNA作对照品,将系列稀释的质粒DNA与病毒DNA一起进行Q-PCR,根据标准曲线计算待测样品的拷贝数[8]。但是实验结果表明传统方法测定结果的重复性差,相同样品在同一人不同次实验,以及不同实验室之间测定结果均存在显著的差异。
基于以上研究背景,本文对测定rAAV-9基因组滴度的传统Q-PCR法进行改进,用病毒对照品代替质粒对照品,统计方法由平行线法代替传统单点法,以提高测定结果的重复性。
1 实验材料 1.1 实验仪器7 500 Fast实时荧光定量PCR仪(ABI);M- CENTRIFUGE离心机(AndyBio);DU 800核酸蛋白分析仪(BECMAN);96孔PCR板(ABI,货号4346906)。
1.2 样品及试剂2×Taqman universal Master MixⅡ,with UNG(ABI,货号4440038);SDS(国药集团化学试剂有限公司,30166428);EDTA(Thermo Fisher,AM9912);DnaseⅠ(TAKARA,2270A);引物和探针(fwd-ITR-primer:GGAACCCCTAGTGATGGAGTT;rev-ITR-primer:CGGCCTCAGTGAGCGA;AAV2-ITR-probe:CACTCCCTCTCTGCGCGCTCG)[8],由Thermo Fisher合成;本实验所用的rAAV-9病毒样品(批号2019022801)、rAAV-9病毒对照品(批号2014102611,基因组滴度2.2×1013 copies·mL-1)及质粒对照品(pAAV2neo-egfp,基因组滴度1.1×1011 copies·mL-1)均为中国食品药品检定研究院重组药物室留样。
2 方法与结果 2.1 检测方法 2.1.1 对照品和样品的预稀释将质粒对照品用超纯水预稀释30倍,然后2倍系列稀释7个稀释度,各稀释度下质粒对照品溶液分别用于“2.1.4”项下Q-PCR的试验。病毒对照品、病毒样品分别用超纯水预稀释200倍,然后2倍系列稀释7个稀释度,各稀释度下病毒对照品溶液和病毒样品溶液分别用于“2.1.2”“2.1.3”“2.1.4”项下的试验。
2.1.2 外源DNA的去除分别取各稀释度的病毒对照品溶液、病毒样品溶液5 μL,按照如下体系配制反应混合液:5 μL rAAV-9病毒样品溶液或病毒对照品溶液,5 μL 10×DnaseⅠ缓冲液,2 μL DnaseⅠ,38 μL超纯水。37 ℃孵育30 min,去除外源DNA,80 ℃孵育10 min,灭活Dnase Ⅰ,即得消化液。
2.1.3 病毒的裂解分别采用SDS或EDTA裂解病毒。在SDS裂解法中,将上述消化液加入0.2% SDS 50 μL,95 ℃ 30 min裂解病毒,即得裂解液。EDTA裂解法中,将上述消化液加入20 mmol·L-1 EDTA 50 μL,95 ℃ 30 min裂解病毒,即得裂解液。
2.1.4 Q-PCR用超纯水将上述裂解液稀释100倍,以去除裂解试剂对Q-PCR的抑制作用,然后分别以各稀释度病毒对照品、病毒样品的裂解液及各稀释度质粒对照品溶液为模板,配制如下反应体系:5 μL DNA模板,0.5 μL fwd-ITR-primer,0.5 μL rev- ITR-primer,0.5 μL AAV2-ITR-probe,10 μL 2× Taqman universal Master MixⅡ,3.5 μL超纯水。根据以下反应程序进行Q-PCR:50 ℃ 2 min;95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火延伸30 s,40个循环;37 ℃ 2 s。
2.1.5 结果的计算平行线法:采用平行线法分析结果时需要预试验,寻找平行范围。本研究首先将相近浓度的样品和对照品以较大的稀释倍数(如4倍)倍比稀释,寻找到大概的平行范围,然后缩小稀释倍数(如2倍),寻找最佳平行范围。选择质粒对照品、病毒对照品、病毒样品任意二者之间平行性均好的5个稀释度范围进行计算。以质粒为对照品时,选取质粒对照品和病毒样品分别对应的的Ct值,根据平行线法[9]进行计算,同时乘以样品预稀释及处理过程中的稀释倍数,得出rAAV-9基因组滴度;以病毒为对照品时,选取病毒对照品和病毒样品分别对应的Ct值,根据平行线法进行计算,同时乘以样品预稀释及处理过程中的稀释倍数,得出rAAV-9基因组滴度。单点法:以病毒为对照品,根据标准曲线用外标法进行计算,同时乘以样品预稀释及处理过程中的稀释倍数,得到rAAV-9的基因组滴度。
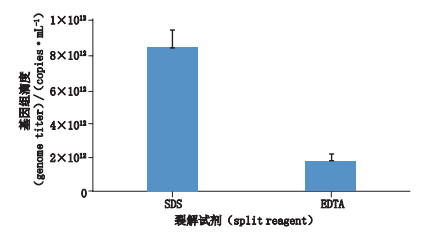
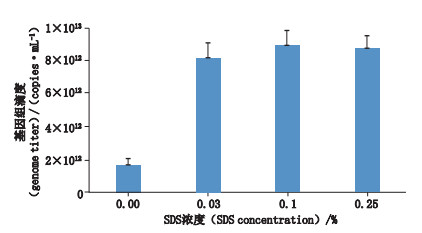
2.2 方法改进结果 2.2.1 病毒裂解方法的选择根据“2.1.3”项方法,比较SDS和EDTA的裂解效果,结果如图 1所示,SDS裂解后测定结果显著高于EDTA,表明SDS裂解效率高于EDTA,所以SDS裂解法是较优的方法。对SDS裂解浓度进行优化,比较不同浓度SDS裂解效果,结果如图 2所示,终浓度为0.1%的SDS裂解后测定结果值最高,裂解效果最佳,故选择在此SDS终浓度下裂解病毒。
|
图 1 SDS和EDTA对rAAV-9裂解效果的比较 Fig.1 Comparison of dissociation effects on rAAV-9 between SDS and EDTA |
|
图 2 不同浓度SDS对rAAV-9裂解效果的比较 Fig.2 Comparison of dissociation effect on rAAV-9 with SDS at different concentrations |
质粒和病毒分别做对照品,根据平行线法计算rAAV-9的拷贝数,病毒对照品由质粒对照品根据平行线法标化,计算结果见表 1,质粒做对照品的测定结果精密度差,RSD为35.9%,病毒做对照品的测定结果精密度较高,RSD为13.7%,所以选择用病毒对照品替代质粒对照品。
|
|
表 1 不同统计方法及对照品分析结果的比较 Tab.1 Comparison of different statistical methods and reference standards |
用病毒做对照品,分别根据单点法和平行线法计算病毒样品拷贝数,结果见表 1。单点法测定结果精密度较差,RSD为23.1%;平行线法计算结果精密度较好,RSD为13.7%。所以选择用平行线法代替传统单点法分析结果。
2.3 方法学的初步验证 2.3.1 准确度用超纯水将病毒对照品稀释1.5倍后按照改进后方法测稀释后对照品拷贝数,比较实测值和理论值的关系,3次实验结果表明,回收率在90%~120%之间,准确度较好。
2.3.2 精密度根据改进后方法测rAAV-9样品拷贝数,每天做1次试验,连续做3 d,结果显示,3次实验均值为1.54×1013 copies·mL-1,RSD为11.4%,精密度较好。
3 讨论在rAAV基因治疗药物的质量控制研究中,滴度的测定扮演着重要的角色,由于传统方法的测定结果重复性差,本研究中对传统方法进行了裂解试剂的选择、对照品的比较和统计方法的选择等方面的改进。
目前测定rAAV基因组滴度报道最多的是Q-PCR方法,用Q-PCR方法测rAAV基因组滴度主要有2种思路,一是SDS或EDTA裂解病毒后进行Q-PCR,二是试剂盒提取DNA后进行Q-PCR[10]。本研究对裂解方法进行了选择优化,选出了较优的裂解试剂SDS及裂解浓度0.1%。至于试剂盒提取DNA的方法,实验过程发现用试剂盒提取后测定结果重复性差,考虑到不同试剂盒的提取效率不同,且提取过程中所添加的试剂可能会对Q-PCR产生影响,本研究中舍弃了试剂盒提取的方法,选择了裂解法。
传统裂解法中质粒为对照品,并未参与病毒的前处理过程,不能对其进行控制,为非同质对照品。本研究用病毒对照品代替了质粒对照品,为同质对照品,提高了测定结果的精密度。此外,质粒对照品结构与病毒基因组结构差异较大(质粒中的ITR序列处于非游离状态,而病毒基因组中的ITR序列是游离状态),这种结构差异会导致二者的扩增效率不一致,与D′Costa等[11]的研究结果相一致。
与此同时,本研究也对统计方法进行了选择,将传统的单点计算法替换为平行线法,进一步提高了实验的精密度。传统方法中结果的计算只参考了病毒样品1个点的数据,数据不充分,无法对结果的可靠性进行准确判断,而平行线法结果的计算参考了多个点的数据,结果的重复性高。而且平行线法在计算结果的同时进行了线性、平行性的判断,可检验对照品、样品的扩增是否呈线性及对照品和样品扩增是否同步等,结果更可靠。
总之,本文完善了rAAV-9基因组滴度测定方法,提高了对重组腺相关病毒基因治疗药物的质控水平。
| [1] |
肖桂清, 杨会勇, 刁勇. 重组腺相关病毒质量控制的qPCR技术研究进展[J]. 华侨大学学报(自然科学版), 2014, 35(2): 191. XIAO GQ, YANG HY, DIAO Y. Advances in real-time quantitative PCR technology for quality control of recombinant adeno-associated virus[J]. J Huaqiao Univ(Nat Sci), 2014, 35(2): 191. |
| [2] |
杜梦潭, 刘兴健, 胡小元, 等. 腺相关病毒的生产方式及其在基因治疗中的应用[J]. 生物技术进展, 2019, 9(4): 326. DU MT, LIU XJ, HU XY, et al. The production method of adeno-associated virus and its application in gene therapy[J]. Curr Biotechnol, 2019, 9(4): 326. |
| [3] |
刁勇, 王启钊, 吕颖慧, 等. 重组腺相关病毒基因药物的病毒滴度定量测定[J]. 中国新药与临床杂志, 2010, 29(10): 728. DIAO Yo, WANG QZ, LÜ YH, et al. Biological assay of recombinant adeno-associated virus gene medicine[J]. Chin J New Drugs Clin Rem, 2010, 29(10): 728. |
| [4] |
WANG D, TAI PWL, GAO G. Adeno-associated virus vector as a platform for gene therapy delivery[J]. Nat Rev Drug Discov, 2019, 18(5): 358. DOI:10.1038/s41573-019-0012-9 |
| [5] |
蒙青林, 张彬彬, 张春. 测定重组腺相关病毒基因组滴度的qPCR新方法[J]. 生物工程学报, 2013, 29(2): 235. MENG QL, ZHANG BB, ZHANG C. Novel qPCR strategy for quantification of recombinant adeno-associated virus serotype 2 vector genome-titer[J]. Chin J Biotechnol, 2013, 29(2): 235. |
| [6] |
WAGNER A, RÖHRS V, KEDZIERSKI R, et al. A novel method for the quantification of adeno-associated virus vectors for RNA interference applications using quantitative polymerase chain reaction and purified genomic adeno-associated virus DNA as a standard[J]. Hum Gene Ther Methods, 2013, 24(6): 355. DOI:10.1089/hgtb.2013.095 |
| [7] |
石亮, 刘云波. 腺相关病毒的特性及应用进展[J]. 医学综述, 2016, 22(11): 2088. SHI L, LIU YB. The characteristics and applications of adeno-associated virus[J]. Med Recapit, 2016, 22(11): 2088. DOI:10.3969/j.issn.1006-2084.2016.11.003 |
| [8] |
AURNHAMMER C, HAASE M, MUETHER N, et al. Universal real-timePCR for the detection and quantification of adeno-associated virus sero-type 2-derived inverted terminal repeat sequences[J]. Hum Gene Ther Methods, 2012, 23(1): 18. DOI:10.1089/hgtb.2011.034 |
| [9] |
BP 8.0[S].2013: 609
|
| [10] |
于雷, 李永红, 秦玺, 等. Q-PCR法检测腺病毒基因治疗产品中的复制型腺病毒[J]. 生物技术通讯, 2017, 28(3): 352. YU L, LI YH, QIN X, et al. Detection of replication-competent adenoviruses in adenoviral gene therapy products by Q-PCR[J]. Lett Biotechnol, 2017, 28(3): 352. DOI:10.3969/j.issn.1009-0002.2017.03.022 |
| [11] |
D'COSTA S, BLOUIN V, BROUCQUE F, et al. Practical utilization of recombinant AAV vector reference standards:focus on vector genomes titrationby free ITR qPCR[J]. Mol Ther Methods Clin Dev, 2016, 5: 16019. |
 2020, Vol. 40
2020, Vol. 40 
