溶瘤病毒治疗肿瘤是目前肿瘤生物治疗中的热点,有望成为继手术、放化疗之外的第4种肿瘤治疗方法[1-2]。牛痘病毒在人们对抗天花的过程中发挥了重要的作用,虽然天花已在20世纪80年代宣布全球根除,但是基于牛痘病毒能特异感染并裂解肿瘤细胞的特性而用作“溶瘤病毒”的方案是新颖的肿瘤生物治疗策略;其不仅可以通过裂解肿瘤细胞达到抑制肿瘤生长、增殖的效果,同时还通过介导肿瘤细胞的凋亡,启动细胞内相关信号通路,激活细胞的免疫应答等方式,多途径、多层次地发挥抗肿瘤效果[3-5]。
牛痘病毒粒细胞巨噬细胞集落刺激因子(vaccinia virus/GM-CSF)注射液是一种新型的复制型重组牛痘病毒,载体来自Wythe牛痘病毒株,携带失活的病毒胸苷激酶(TK)基因,表达人粒细胞巨噬细胞集落刺激因子(GM-CSF)蛋白质和大肠杆菌β-半乳糖苷酶蛋白质的编码序列,有望开发成为一种用于瘤内注射或静脉注射治疗肝细胞癌的基因治疗制剂。
生物学活性一直是药物质量控制的重点,因基因治疗产品活病毒的特殊性和结构的复杂性,其生物学活性测定更是其质量控制的难点,本研究根据《人基因治疗研究和制剂质量控制技术指导原则》、《中华人民共和国药典》2015年版三部的要求及该产品自身的特点,对牛痘病毒粒细胞巨噬细胞集落刺激因子注射液的病毒感染滴度、GM-CSF的表达量、GM-CSF的生物学活性、溶瘤活性及β-半乳糖苷酶活性进行了分析,所建立的方法稳定、可靠,适用性强,能够用于该产品的质量控制,同时对同类产品的质量控制具有借鉴意义。
1 材料 1.1 仪器Ⅱ型微生物安全柜(Telstar公司),Spectra MAX 250型酶标仪及分析软件(Molecular Devices公司),PLA(2.1)分析软件(Stegmann Systems,Germany),7500 Fast实时荧光定量PCR仪(ABI公司),Nikon TE2000-U倒置显微镜(Nikon公司),Forma SeriesⅡ恒温培养箱(Thermo公司)。
1.2 细胞及试剂U-2 OS细胞(ATCC-HTB-96)、Hela细胞(ATCC CCL-2)、UACC-257细胞(美国DTP)、GM00038细胞(美国全科医学研究会人类遗传学细胞库)、TF-1细胞(ATCC CRL-2003);DMEM培养基(GIBCO,货号041-94445M)、FCS(SIGMA,货号115-152)、胰酶(GIBCO,货号27250018)、PBS(SIGMA,货号D-8537)、1640培养基(GIBCO,货号21875-034)、CellTiter 96® Aqueous(PROMEGA,货号G5421)、Kit β-galactosidase Enzyme Assay System with Reporter Lysis试剂盒(PROMEGA,货号E2000)、AcroPrep TM Advance 96 Filter Plate 0.2 μm Supor(PALL公司)、正向序列检测引物(5’-CATTACCAGTTGGTCTGGTGTCA-3’)、反向序列检测引物(5’-CCATCGAGTGCGGCTACTATAACTAT-3’)、序列检测探针(5’NED-ATCCAATTCTGTGAGCGTAT-3’NFQ)及牛痘病毒DNA标准品由申报单位提供。PCR Master混合液(QIAGen:QuanHTect multiplex pcr,货号204543)、甲醇、结晶紫等化学试剂均为国产分析纯。
1.3 样品牛痘病毒粒细胞巨噬细胞刺激因子样品(批号091101)及标准品(批号Y768)由申报单位提供,中国食品药品检定研究院重组药物室留样,规格均为每支2.0 mL,1×109 PFU·mL-1。
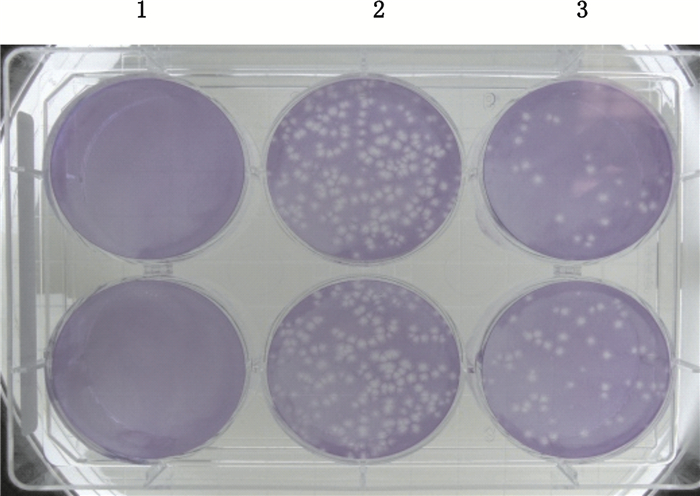
2 方法与结果 2.1 感染滴度检测将培养于DMEM+1.5%FCS中的单层U-2 OS细胞用胰酶消化后,用原培养基调整细胞浓度为3.5×105~4.5×105 mL-1,以每孔1 mL移入到6孔板中,在37 ℃、5%CO2条件下培养1 d,移除培养基,以每孔1 mL加入以不含FCS的DMEM培养液制备的、稀释度分别为5×106和25×106的样品稀释液,每个稀释度做2个复孔。同时用不含病毒的无FCS的DMEM培养液作为阴性对照。轻轻摇动使接种物平均分布于孔内,将6孔板置于37 ℃、5%CO2恒温箱中孵育2 h,之后每孔加入DMEM+1.5%FCS+1.5%CMC溶液2 mL,将6孔板置于37 ℃、5%CO2恒温箱中孵育3 d。培养结束后,从6孔板中移除溶剂,每孔加入1 mL PBS洗细胞,移除PBS,每孔加入含0.1%结晶紫的80%甲醇溶液,室温下放置15 min。移除结晶紫溶液,每孔用2 mL纯水洗细胞,移除6孔板中的纯水。将6孔板在室温下放置30 min自然干燥。计数最接近每孔100个噬斑的稀释液噬斑数,计算2孔的噬斑平均值,按平均病毒噬斑数×稀释倍数求得感染滴度(PFU·mL-1)。
用Q-PCR方法[6-7]检测该产品的基因组滴度。首先,用不含RNAse的水将DNA标准品配制成每10 μL分别含有106、105、104、103、102拷贝数的溶液;然后处理样品:包括先用核酸酶,37 ℃条件下处理30 min,0.1 mol·L-1 EDTA灭活,再用蛋白酶K在65 ℃条件下处理30 min,再在95 ℃条件下处理15 min,得到样品备用。之后是配反应体系:不含RNAse的水1 μL+PCR Master混合液12.5 μL+正向序列检测引物(100 μmol·L-1)0.5 μL+反向序列检测引物(100 μmol·L-1)0.5 μL+序列检测探针(100 μmol·L-1)0.5 μL+5 μL上述处理后的样品,同时设置以不含RNAse的水为模板的阴性对照;最后在95 ℃ 15 min(1个循环)及95 ℃ 15 s,60 ℃ 1 min(40个循环)的条件下进行扩增。以标准DNA检测值按直线方程求出样品中的基因组浓度,用该浓度(VG·mL-1)除以感染滴度(PFU·mL-1),即得到牛痘病毒粒细胞巨噬细胞集落刺激因子注射液基因组滴度与感染滴度的比值,表示含有重组牛痘病毒基因组的病毒颗粒中有感染活性的病毒的比例。
结果阴性对照无噬斑形成,2个稀释浓度的牛痘病毒粒细胞巨噬细胞集落刺激因子注射液在细胞培养板中均形成噬斑,但5×106稀释倍数下病毒形成的噬班数更接近100。以此稀释倍数,对牛痘病毒粒细胞巨噬细胞集落刺激因子注射液样品(批号091101)分别进行3次试验,计算该批重组牛痘病毒的感染滴度分别为6.7×108、6.7×108和6.0×108 PFU·mL-1,结果见表 1,则该批重组牛痘病毒的感染滴度的平均值为(6.5±0.4)×108 PFU·mL-1,RSD为6.2%。2个病毒稀释度及阴性对照的噬斑形成情况见图 1。Q-PCR方法测得病毒的基因组为1.76×1010 VG·mL-1,病毒基因组滴度/感染滴度为27。表明含有病毒基因组的重组牛痘病毒是具有感染活性的病毒的27倍。
|
|
表 1 牛痘病毒粒细胞巨噬细胞集落刺激因子注射液感染滴度测定结果(噬斑法) Tab.1 Test results of infectious titer of vaccinia virus/GM-CSF injection(plaque method) |
|
1.阴性对照(negative control)2.样品稀释5×106倍(sample diluted by a factor of 5×106)3.样品稀释25×106倍(sample diluted by a factor of 25×106) 图 1 牛痘病毒粒细胞巨噬细胞集落刺激因子注射液噬斑形成情况 Fig.1 Plaque formation of vaccinia virus/GM-CSF injection |
用含2.4% FCS的DMEM作为稀释剂制备标准品和样品的30倍稀释液和8 000倍稀释液,分别用于感染正常细胞(GM 00038)和肿瘤细胞(UACC-257)的起始液。用2块96孔板分别用作2种细胞的感染,选择96孔板的第2到11列用于样品稀释,其中A行分别加入上述制备的30倍稀释液和8 000倍稀释液各150 μL,B到H行则加入100 μL的稀释液,然后从A行移取50 μL至下一行中直至到达H行,弃去H行的最后50 μL溶液,得到样品的8个稀释梯度溶液,每个待测样品制备3个复孔。第1和第12列的各孔中加入100 μL的稀释液用作对照。取GM00038细胞和UACC-257细胞,将其用稀释液分别制备成浓度为5.0×105 mL-1和2.5×105 mL-1的细胞悬液,在2块96孔板上分别加入100 μL上述制备的细胞悬液,96孔板在37 ℃、5%CO2条件下培养(72±2)h。之后加入细胞活性检测试剂CellTiter 96® Aqueous,在酶标仪上读取各病毒浓度梯度下的化学发光值,利用PLA 2.0软件对其进行分析,选择曲线上线性及平行部分的4份连续稀释液用于平行线测定法(PLA)计算。牛痘病毒粒细胞巨噬细胞集落刺激因子注射液在GM 00038和UACC-257细胞之间的EC50之差应大于1.3 log。本试验测定得到的是相对效力值,即以样品的溶瘤活性与同时检测的标准品的溶瘤活性相比较来表示。标准品的值为130 rOnU(溶瘤单位),计算时主要用肿瘤细胞UACC-257的数据计算样品的溶瘤活性,而正常细胞GM00038的数据只是用来计算EC50的值,其与UACC-257细胞所得的EC50比较,以此来反映样品在2种细胞之间的选择性溶瘤活性。
利用PLA2.0软件,首先对2种细胞所得数据进行线性、平行性及回归性分析,结果表明所得数据均符合要求。然后利用该软件计算牛痘病毒粒细胞巨噬细胞刺激因子注射液对肿瘤细胞UACC-257的溶瘤活性,3次试验测得的结果分别为109、154、169 rOnU,平均值为(144±31)rOnU,RSD为21.5%。样品对UACC-257细胞的EC50(PFU·mL-1)的平均值为1.6 log,对正常细胞GM 00038的EC50(PFU·mL-1)的平均值为3.7 log,两者之间的差值为2.1 log,符合该制品的溶瘤活性及在肿瘤细胞和正常细胞间的选择性溶瘤活性要求。
2.3 GM-CSF表达量及生物学活性检测用DMEM+10%FCS培养液分别制备牛痘病毒粒细胞巨噬细胞集落刺激因子注射液样品、标准品的5 000倍稀释液,大约为2×105 PFU·mL-1,混匀。以该5 000倍稀释液为起始浓度,以DMEM+10%FCS培养液为稀释液,在96孔板中制备1.5倍浓度梯度稀释液,共8个稀释度,并使稀释后各孔的体积为30 μL。将培养于DMEM+10% FCS培养液中的Hela细胞,用其培养液调整细胞浓度为5.0×105 mL-1后向上述制备的96孔板中每孔加入200 μL细胞悬液。将该96孔板在37 ℃,5% CO2条件下培养24 h。转移培养后的96孔板中的培养液至安装在新的96孔板上的离心微孔板(Acroprep 0.2 μm)中,然后以3 000 r·min-1,离心5 min。离心收集的上清液可分于不同的96孔板中保存,以备进行各项活性检测,并保存于-70 ℃或以下冷冻最多7 d直至使用[8]。
室温下溶解上清液并利用新的96孔板制备上清液的100倍稀释液,再准备1块96孔板作为GM-CSF生物学活性检测板,向该活性检测板中每孔中加入1640培养基+10%的FCS培养液50 μL,再加入50 μL上清液的100倍稀释液;用1640培养基+10%的FCS制备浓度为1.5×105 mL-1的TF-1细胞悬液,活性检测板每孔中加入细胞悬液100 μL;37 ℃,5% CO2培养该板72 h后加入CellTiter 96® Aqueous试剂进行检测。利用SOFTMAX软件,选择四参数方程为回归模型进行数据分析,绘制牛痘病毒粒细胞巨噬细胞刺激因子标准品和样品的剂量反应曲线,进行GM-CSF生物学活性分析。牛痘病毒粒细胞巨噬细胞集落刺激因子标准品的GM-CSF生物学活性为100 GCU,样品的GM-CSF活性质量标准为50~200 GCU。
GM-CSF含量检测试剂盒在室温下平衡30 min;用DMEM+10%FCS制备GM-CSF的标准品(试剂盒中提供)的8个梯度稀释液,分别为500、333、222、148、99、66、44、29 pg·mL-1;将上述制备的上清液进行500倍稀释;按照GM-CSF含量检测试剂盒说明书进行检测。利用SOFTMAX软件,以GM-CSF标准品的浓度为横坐标,吸收度值为纵坐标,选择二次方程对样品的各个稀释浓度下所表达的GM-CSF含量进行分析。
GM-CSF的表达量随牛痘病毒粒细胞巨噬细胞集落刺激因子浓度的降低而降低,根据试剂盒的标准品计算出重组牛痘病毒8个浓度梯度下表达量均大于10 pg·孔-1,具体表达量数值见表 2。
|
|
表 2 牛痘病毒粒细胞巨噬细胞集落刺激因子注射液样品与标准品GM-CSF表达量(pg·孔-1) Tab.2 Test results of expression level of GM-CSF(pg per well) |
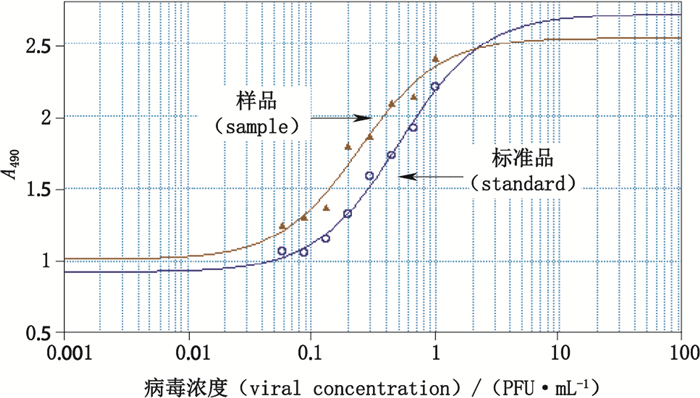
牛痘病毒粒细胞巨噬细胞集落刺激因子的GM-CSF的生物学活性经过3次测定,结果分别为192、188、162 rGCU,平均值为(181±16)rGCU,RSD为8.8%,并且每个稀释度下的粒细胞巨噬细胞刺激因子(GM-CSF)活性随牛痘病毒粒细胞巨噬细胞集落刺激因子浓度的降低而降低,牛痘病毒粒细胞巨噬细胞集落刺激因子样品和标准品的浓度与GM-CSF活性的四参数曲线如图 2所示。
|
图 2 牛痘病毒粒细胞巨噬细胞集落刺激因子注射液样品与标准品对TF-1细胞增殖的剂量反应曲线 Fig.2 Dose-response curves of vaccinia virus/GM-CSF sample and standard to TF-1 cell proliferation |
牛痘病毒粒细胞巨噬细胞集落刺激因子样品及标准品感染细胞及感染上清液的制备同“2.3”项;在室温下解冻Kit β-galactosidase Enzyme Assay System with Reporter Lysis试剂盒,涡旋混匀。将感染上清液全部转移到96孔板中,先用纯化水制备适量的1×报告基因裂解缓冲液,将上清液转移至96孔板中,使用200 μL PBS小心清洗微孔,每孔加入150 μL 1×报告基因裂解缓冲液,室温培养微孔板(30±15)min。用多通道移液器进行3次抽吸以混合细胞裂解液。离心分离(4 000 r·min-1,5 min)使细胞裂解液澄清。从各孔移取各澄清液50 μL,置新的96孔板中。同时设置DMEM+10%FCS作为空白,按照试剂盒的操作说明书,在420 nm下检测样品及标准品的吸收度值。使用平行线测定法计算各样品的β-半乳糖苷酶相对活性,选定曲线的线性和平行部分的4个连续稀释液进行计算。以rBU表示β-半乳糖苷酶活性,其中,牛痘病毒粒细胞巨噬细胞集落刺激因子标准品的β-半乳糖苷酶活性为100 rBU,牛痘病毒粒细胞巨噬细胞集落刺激因子样品的β-半乳糖苷酶活性质量标准为50~200 rBU。
β-半乳糖苷酶活性随牛痘病毒粒细胞巨噬细胞集落刺激因子浓度的降低而降低,对样品进行3次实验得到其β-半乳糖苷酶活性分别为164、73、135 rBU,平均值为(124±46)rBU,RSD为37.1%,符合其50~200 rBU的质量标准。
2.5 牛痘病毒粒细胞巨噬细胞集落刺激因子注射液生物学活性结果汇总将上述各项试验得到的结果进行汇总,如表 3所示。牛痘病毒粒细胞巨噬细胞集落刺激因子注射液生物学活性各项测定项目均符合其质量标准。
|
|
表 3 牛痘病毒粒细胞巨噬细胞集落刺激因子注射液生物学活性结果汇总 Tab.3 Summary of the bioactivity results of vaccinia virus/GM-CSF |
生物学活性测定是基因治疗产品最为重要的质量控制指标,同时因为基因治疗产品的复杂性,其也是质量控制的难点所在。本研究对牛痘病毒粒细胞巨噬细胞集落刺激因子注射液的生物学活性进行了相对全面的检测,包括表征基因转移效率的感染滴度检测、对治疗序列GM-CSF表达的水平、表达产物的功能检测及整个制品的直接活性—溶瘤及选择性溶瘤活性的测定。并且在测定中通过引入标准品,实现了定量测定,这是对基因治疗制品质量标准的进一步提高[9-10]。
本研究选用噬斑法检测牛痘病毒粒细胞巨噬细胞刺激因子的感染滴度,表征的是有感染能力的活病毒的数量。噬斑法是测定病毒感染滴度最为经典的方法,该方法是基于病毒感染细胞后导致细胞裂解形成空斑,继而通过观察统计病变斑点的数量来分析病毒的感染滴度,虽然操作上复杂,耗时,但是是对病毒真实感染活性的测定,并且对于多数病毒样品具有较好的适用性。本研究进行了牛痘病毒粒细胞巨噬细胞刺激因子的溶瘤活性检测并考察其选择性溶瘤活性,是因为牛痘病毒粒细胞巨噬细胞刺激因子可以选择性地在肿瘤细胞中进行感染和复制,最终裂解肿瘤细胞并释放,以感染更多的肿瘤细胞而不伤及其他正常细胞,因此检测重组病毒对肿瘤细胞的杀伤作用及在肿瘤细胞与正常细胞的杀伤活性的差异,即溶瘤活性和选择性溶瘤活性是该溶瘤病毒最重要的质量属性,以进一步证实病毒的有效性及安全性。本研究对GM-CSF表达量及生物学活性检测和β-半乳糖苷酶活性的试验中,采用重组牛痘病毒的系列稀释液而不是固定浓度的稀释液感染细胞,得到的是不同病毒浓度下GM-CSF的表达量、生物学活性及β-半乳糖苷酶活性,不仅回答了这些改构的效应因子有没有表达及有没有活性的问题,而且回答了这种表达量及活性与病毒感染量的正比关系,从而证明了牛痘病毒GM-CSF的感染效率及表达的稳定性。这种方法比单点测定的方法有更大的优越性。
基因治疗制品本身具有复杂性和不成熟性,加之本研究中所进行的生物学活性测定试验比较复杂,不仅与改构的重组病毒、细胞各自的特性及培养状态有关,还与病毒和细胞的相互作用有关,更与操作及诸多的试验条件、试验环节有关,所以后续还需对各个试验进行改进和优化。总之,本文对牛痘病毒粒细胞巨噬细胞刺激因子注射液所进行的生物学活性测定方法的研究能够满足对该产品的常规质量控制,也为同类及相关产品的质量控制提供借鉴。
| [1] |
RUSSELL L, PENG KW. The emerging role of oncolytic virus therapy against cancer[J]. Chin Clin Oncol, 2018, 7(2): 16. DOI:10.21037/cco.2018.04.04 |
| [2] |
KAUFMAN HL, KOHLHAPP FJ, ZLOZA A. Oncolytic viruses:a new class of immunotherapy drugs[J]. Nat Rev Drug Discov, 2015, 14(9): 642. DOI:10.1038/nrd4663 |
| [3] |
NEIDEL S, REN H, TORRES AA, et al. NF-κB activation is a turn on for vaccinia virus phosphoprotein A49 to turn off NF-κB activation[J]. Proc Natl Acad Sci USA, 2019, 116(12): 5699. DOI:10.1073/pnas.1813504116 |
| [4] |
DENG L, FAN J, DING Y, et al. Oncolytic cancer therapy with a vaccinia virus strain[J]. Oncol Rep, 2019, 41(1): 686. |
| [5] |
BENDJAMA K, QUEMENEUR E. Modified Vaccinia virus Ankara-based vaccines in the era of personalized immunotherapy of cancer[J]. Hum Vaccin Immunother, 2017, 13(9): 1997. DOI:10.1080/21645515.2017.1334746 |
| [6] |
于雷, 李永红, 秦玺, 等. Q-PCR法检测腺病毒基因治疗产品中的复制性腺病毒[J]. 生物技术通讯, 2017, 28(3): 352. YU L, LI YH, QIN X, et al. Detection of replication-competent adenoviruses in adenoviral gene therapy products by Q-PCR[J]. Lett Biotechnol, 2017, 28(3): 352. DOI:10.3969/j.issn.1009-0002.2017.03.022 |
| [7] |
秦玺, 李永红, 杨琦, 等. 实时荧光定量PCR法用于重组SIV-hPEDF注射液病毒颗粒数的检测[J]. 现代生物医学进展, 2015, 15(8): 1401. QIN X, LI YH, YANG Q, et al. Quantitation of virus particles in recombinant SIV-hPEGF injection by real-time PCR[J]. Prog Mod Biomed, 2015, 15(8): 1401. |
| [8] |
毕华, 李永红, 韩春梅, 等. 牛痘病毒GM-CSF注射液中GM-CSF活性及表达量的检测[J]. 中国生物制品学杂志, 2018, 31(9): 1015. BI H, LI YH, HAN CM, et al. Determination of activity and expression level of GM-CSF in vaccinia virus/GM-CSF injection[J]. Chin J Biol, 2018, 31(9): 1015. |
| [9] |
李永红, 毕华, 史新昌, 等. 人用基因治疗制品生产和质量控制的通用性技术要求[J]. 中国新药杂志, 2018, 27(21): 2482. LI YH, BI H, SHI XC, et al. General technical requirements for production and quality control of human gene therapy products[J]. Chin J New Drugs, 2018, 27(21): 2482. |
| [10] |
李春辉, 胡泊, 翁郁华, 等. 基因治疗的现状与临床研究进展[J]. 生命科学仪器, 2019, 17(8): 3. LI CH, HU B, WENG YH, et al. Current situation and clinical research progresses of gene therapy[J]. Life Sci Instrum, 2019, 17(8): 3. |
 2020, Vol. 40
2020, Vol. 40 
