2. 中国药科大学天然药物活性组分与药效国家重点实验室, 南京 210009
2. State Key Laboratory of Natural Medicines, China Pharmaceutical University, Nanjing 210009, China
胡黄连药材为玄参科植物胡黄连Picrorhiza scrophulariiflora Pennell的干燥根茎,具有退虚热,除疳热,清湿热之功效[1],最早在印度、印度尼西亚一带发现。20世纪70年代,在我国发现其近缘植物野生胡黄连,并成为其替代品,主要分布于四川、云南西北部和西藏南部的3 600~4 400 m的高寒山区,被收录到1977年版《中华人民共和国药典》[2-3](以下简称《中国药典》)。国内外研究结果表明,胡黄连的化学成分主要有环烯醚萜类、苯乙醇糖苷类、酚苷类[4],其中环烯醚萜类成分为胡黄连的主要活性成分,现代药理学研究表明其具有保肝[5-6]、抗炎[7]、神经保护[8-9]、抗肿瘤[10-11]等作用。目前,除《中国药典》中采用HPLC法测定胡黄连苷Ⅰ和Ⅱ的总量来控制其质量外,关于其质量控制文献报道仅有采用HPLC法和CE-ED法测定胡黄连中阿魏酸、香草酸、肉桂酸的含量[12-13],未见其他活性成分的含量测定报道。随着中药现代化的思路和现代中成药工业的进步,中药质量标准的含量测定越来越倾向于“多组分”或“总组分”量的控制,以体现中药质量标准的整体性和系统性[14]。
本课题组前期对胡黄连药材进行的市场调研发现,由于近年来胡黄连需求量增加,资源紧缺,安国和亳州南、北两大药材市场均见伪品出售。本实验在前期对其指纹图谱研究的基础上[15],采用双波长-UPLC法同时测定胡黄连中胡黄连苷Ⅰ、Ⅱ、Ⅲ和Ⅳ4个活性成分的含量,以期帮助对胡黄连药材进行质量控制。
1 材料 1.1 仪器超高效液相色谱系统(Waters公司ACQUITY UPLC,包括真空脱气机、二元梯度泵、自动进样器、柱温箱、PDA检测器,Empower 3工作站);电子天平(XS205,METTLER TOLEDO公司);台式高速冷冻离心机(ST16R,Thermo公司);Milli-Q超纯水系统(Millipore公司)。
1.2 药品与试剂胡黄连样品由安国和亳州药材市场收集,经天津中医药大学李天祥教授鉴定其中1、3、18号为胡黄连伪品,其余22号样品均为玄参科胡黄连属植物胡黄连Picrorhiza scrophulariiflora Pennell的干燥根茎;对照品胡黄连苷Ⅰ(批号111727-200501,质量分数95.6%)、胡黄连苷Ⅱ(批号111596-201103,质量分数96.2%)均购于中国食品药品检定研究院,胡黄连苷Ⅲ对照品(批号17041901,质量分数98.8%),购自北京北纳创联生物技术研究院,胡黄连苷Ⅳ对照品(批号PS010209,质量分数99.1%),购自成都曼思特生物科技有限公司;乙腈(色谱纯,Merck公司);超纯水(Milli-Q制备);冰乙酸(色谱级,天津康科德科技有限公司)。
2 方法与结果 2.1 色谱条件色谱柱Waters ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm);流动相:0.5%乙酸水(A)-乙腈(B)。梯度洗脱:0~3 min,92%A→90%A;3~13 min,90%A→89%A;13~20 min,89%A→88.5%A;20~21 min,88.5%A→85.5%A;21~32 min,85.5%A→80%A;32~34 min,80%A→5%A;34~35 min,5%→92%流速:0.4 mL·min-1。分段变波长测定:0~8 min,275 nm;8~14.5 min,295 nm;14.5~35 min,275 nm。进样量:2 μL。柱温:28 ℃。
2.2 混合对照品溶液制备取胡黄连苷Ⅰ、Ⅱ、Ⅲ、Ⅳ的对照品适量,精密称定,加50%甲醇水制成每1 mL含胡黄连苷Ⅰ88.72 μg、胡黄连苷Ⅱ344.61 μg、胡黄连苷Ⅲ39.35 μg、胡黄连苷Ⅳ39.51 μg的混合溶液,即得。
2.3 供试品溶液制备取本品粉末0.1 g,精密称定,置50 mL锥形瓶中,精密加入50%甲醇25 mL,密封,称量,超声处理(功率250 W,频率33 kHz)30 min,取出,放冷,称量,50%甲醇水补足减失的量,摇匀,4 900 r·min离心10 min,精密量取续滤液2 mL,置5 mL量瓶,加50%甲醇水至刻度,0.22 μm滤过双膜,取续滤液,即得。
2.4 专属性考察取混合对照品溶液(胡黄连苷Ⅰ、Ⅱ、Ⅲ、Ⅳ浓度分别为44.36、172.31、19.68、19.76 μg·mL-1)及供试品溶液,按“2.1”项色谱条件下,记录色谱图,结果见图 1。胡黄连苷Ⅰ、Ⅱ、Ⅲ、Ⅳ的理论塔板数均大于100 000;各色谱峰与相邻峰的分离度均大于1.5。
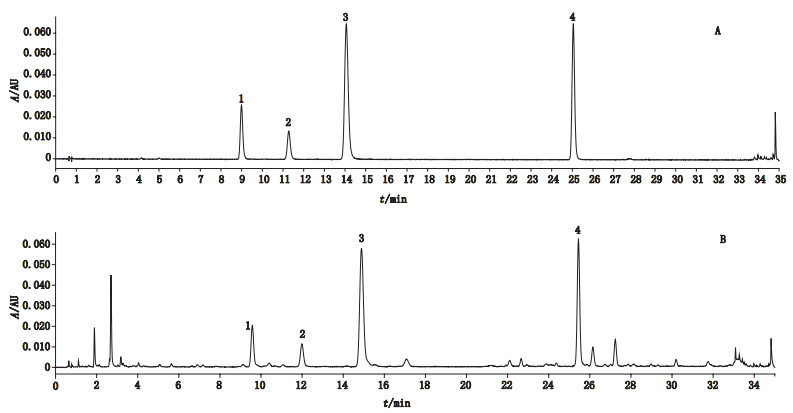
|
1.胡黄连苷Ⅳ(picroside Ⅳ)2.胡黄连苷Ⅲ(picroside Ⅲ)3.胡黄连苷Ⅱ(picroside Ⅱ)4.胡黄连苷Ⅰ(picroside Ⅰ) 图 1 混合对照品溶液(A)和供试品溶液(B)色谱图 Fig.1 UPLC chromatograms of solution of mixed reference substances(A)and sample solution(B) |
精密量取混合对照品溶液适量,逐级稀释成不同质量浓度系列混合对照品溶液(胡黄连苷Ⅰ88.72、70.97、53.23、44.36、35.49、26.62、13.31、8.87、4.44 μg·mL-1,胡黄连苷Ⅱ344.61,275.69、206.77、172.30、137.84、103.38、51.69、34.46、17.23 μg·mL-1,胡黄连苷Ⅲ39.35、31.48、23.61、19.68、15.74、11.81、5.90、3.94、1.97 μg·mL-1,胡黄连苷Ⅳ39.51、31.61、23.71、19.76、15.81、11.85、5.93、3.95、1.98 μg·mL-1),分别按“2.1”项下色谱条件进样测定,记录峰面积。以峰面积Y为纵坐标,对照品质量浓度X(μg·mL-1)为横坐标,进行线性回归,得到各成分的回归方程及相关系数。同时,通过稀释制备不同浓度的对照品得到4个成分的检测下限(S/N为3)和定量下限(S/N为10),结果见表 1。
|
|
表 1 线性关系考察 Tab.1 Linear relationship between peak area and concentration |
取混合对照品溶液2 µL,连续进样6次,记录4个有效成分的峰面积。胡黄连苷Ⅰ、Ⅱ、Ⅲ、Ⅳ峰的平均面积(n=6)分别为578 359、817 142、137 624、225 066,峰面积的RSD分别为0.56%、0.49%、0.59%、0.66%,表明仪器精密度良好。
2.7 重复性试验取同一批样品(批号S12),按“2.3”项下的方法平行制备6份供试品溶液,按“2.1”项下条件进行测定,测得胡黄连苷Ⅰ、Ⅱ、Ⅲ、Ⅳ的平均含量(n=6)分别为33.936、96.106、10.988、11.863 mg·g-1,RSD分别为0.59%、0.86%、0.87%、0.55%,表明本法重复性良好。
2.8 稳定性试验取同一份供试品溶液(批号S12),分别于室温下放置0、2、4、8、12、24 h,进样1针分析,记录4个化合物的色谱峰面积,计算峰面积RSD(n=6),胡黄连苷Ⅰ、Ⅱ、Ⅲ、Ⅳ峰面积的RSD分别为0.19%、0.50%、1.5%、0.33%,表明供试品溶液中4个有效成分在24 h内稳定。
2.9 加样回收率试验精密称取已知含量(批号S12)的胡黄连药材粉末约0.05 g,共9份,分别按已测定的50%、100%、150% 3个水平加入胡黄连苷Ⅰ、Ⅱ、Ⅲ、Ⅳ对照品,按“2.3”项下方法平行制备9份供试溶液,进样测定峰面积,代入回归方程计算回收率,结果如表 2。4个化合物的平均回收率(n=9)分别为102.4%(RSD=1.0%),98.8%(RSD=2.3%),96.5%(RSD=1.1%),101.9%(RSD=2.0%),表明方法的准确度良好。加样回收率96%~103%之间,符合药典要求92%~105%。
|
|
表 2 加样回收率试验结果 Tab.2 Results of recovery |
分别精密吸取22批样品的供试品溶液2 µL,进样测定。采用外标法分别计算4个有效成分的含量,结果见表 3。
|
|
表 3 样品含量测定结果(mg·g-1) Tab.3 The determination results of samples |
药材市场流通的胡黄连有统货和选货2种等级,选货即指从货物里挑出的粗细,长短,质量较一致的货物,已知亳州药材市场13批胡黄连样品中S12、S13、S15、S16、S17、S21、S22、S25为选货,S14、S19、S20、S23、S24为统货。现利用GraphPad Prism软件分别计算4个指标性成分在选货和统货之间的分布情况,结果见图 2。
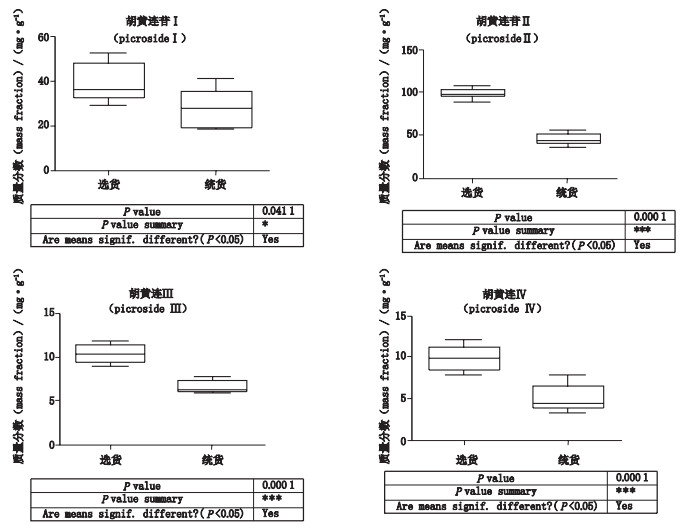
|
图 2 不同等级胡黄连药材样品中4个指标性成分含量的量箱图 Fig.2 Box plot contents of four indicative compounds in Picrorhizae Rhizoma at different grades |
测定成分为环烯醚萜苷类,因此考虑用甲醇为提取溶剂。尝试用3种体积分数甲醇(10%、50%、100%)和水,提取溶剂体积(15、25、50 mL)来制备供试品溶液。实验结果表明甲醇体积分数为50%时所提取的环烯醚萜类化合物含量最高,溶剂体积对4个成分的提取量无明显影响,故选择25 mL。
3.2 检测波长及流动相的选择s由于所测定的4个成分的紫外吸收情况有差异,采用PDA检测器在210~400 nm波长范围内扫描4个成分吸收峰的紫外吸收图谱,结合4个成分的光谱图,发现胡黄连苷Ⅰ和胡黄连苷Ⅱ在275 nm处有较大的吸收,胡黄连苷Ⅲ和Ⅳ在295 nm处有较大的吸收且基线平稳。因此,本实验采用波长切换法,将波长设为8~14.5 min,295 nm(胡黄连苷Ⅲ和胡黄连苷Ⅳ),14.5~35 min时275 nm(胡黄连苷Ⅰ和胡黄连苷Ⅱ)。本实验考察了乙腈-水、乙腈-0.5%乙酸水体系,胡黄连中环烯醚萜苷类成分较多,其多具有酚羟基显弱酸性,因此加入酸可有效改善峰形,提高分离效果,且在乙腈-0.5%乙酸水体系下所测成分的灵敏度均增高,因此选用乙腈-0.5%乙酸水溶液作为流动相。
3.3 样品测定结果分析表 3结果显示各成分RSD集中在30%左右,表明,不同批次4个成分的含量波动较大,可能对药材质量的影响较大。其中样品S7、S14、S19、S20、S23、S24含量总和相对较低,且胡黄连苷Ⅰ和Ⅱ的总量低于9.0%,不符合《中国药典》的规定。图 2结果显示化合物胡黄连苷Ⅰ、Ⅱ、Ⅲ和Ⅳ4个成分在选货中的含量明显高于统货,用GraphPad Prism分别对4个指标性成分的含量在选货和统货中进行t检验,发现化合物胡黄连苷Ⅰ在选货和统货间的含量具有显著性差异(P < 0.05),化合物胡黄连苷Ⅱ、胡黄连苷Ⅲ、胡黄连苷Ⅳ具有极显著性差异(P < 0.000 1),说明选货胡黄连药材样品的整体质量优于统货胡黄连药材样品。
3.4 小结本文建立了胡黄连中4个成分含量的UPLC同时测定方法,操作简便快速,重复性好。通过此方法对市售的22批胡黄连药材的胡黄连苷Ⅰ、胡黄连苷Ⅱ、胡黄连苷Ⅲ和胡黄连苷Ⅳ进行含量测定,发现市售胡黄连药材的质量存在差异,通过不同等级胡黄连药材样品间的化合物含量差异分析,发现根茎粗的选货胡黄连药材样品的质量明显优于根茎细的统货药材,说明胡黄连的生长年限越久,质量越优。该发现为胡黄连药材的临床精准用药提供一定的科学依据,也为野生胡黄连驯化栽培技术提供参考。
| [1] |
中华人民共和国药典2015年版.一部[S]. 2015: 242 ChP 2015. Vol Ⅰ[S]. 2015: 242 |
| [2] |
陈炜伟, 李鹏, 姚仲青, 等. 胡黄连苷-Ⅰ和胡黄连苷-Ⅱ研究进展[J]. 中药材, 2015, 38(8): 1756. CHEN WW, LI P, YAO ZQ, et al. Progress of study on picrosideⅠ and picrosideⅡ[J]. J Chin Med Mater, 2015, 38(8): 1756. |
| [3] |
朱仝飞, 陈日荣, 孙庆文, 等. 西藏胡黄连化学成分研究[J]. 中草药, 2017, 48(2): 263. ZHU TF, CHEN RR, SUN QW, et al. Chemical constituents from Picrorhiza scrophulariiflora[J]. Chin Tradit Herb Drugs, 2017, 48(2): 263. |
| [4] |
LI C, LIU Y, ABDULLA R, et al. Characterization and identification of chemical components in Neopicrorhiza scrphulariiflora roots by liquid chromatography-electrospray ionization quadrupole time-of-flight tandem mass spectrometry[J]. Anal Methods, 2014, 6(11): 3634. DOI:10.1039/C4AY00157E |
| [5] |
GIRISH C, KONER BC, JAYANTHY S, et al. Hepatoprotective activity of picroliv, curcumin and ellagic acid compared to silymarin on paracetamol induced liver toxicity in mice[J]. Fundam Clin Pharmacol, 2009, 23(6): 735. DOI:10.1111/j.1472-8206.2009.00722.x |
| [6] |
KAWOOSA T, SINGH H, KUMAR A, et al. Light and temperature regulated terpene biosynthesis: hepatoprotective monoterpene picroside accumulation in Picrorhiza kurrooa[J]. Funct Integr Genomics, 2010, 10(3): 393. DOI:10.1007/s10142-009-0152-9 |
| [7] |
GUO Y, XU X, LI Q, et al. Anti-inflammation effects of picroside 2 in cerebral ischemic injury rats[J]. Behav & Brain Func, 2010, 6(1): 43. DOI:10.1186/1744-9081-6-43 |
| [8] |
CAO Y, LIU JW, YU YJ, et al. Synergistic protective effect of picroside Ⅱ and NGF on PC12 cells against oxidative stress induced by H2O2[J]. Chin J Clin Pharmaco Ther, 2007, 59(5): 573. |
| [9] |
周广正.胡黄连苷对大鼠脑缺血再灌注损伤后JNK信号通路的调节作用机制[D].青岛: 青岛大学, 2016. ZHOU GZ. PicrosideⅡ regulates JNK signal transduction to protect the cerebral ischemic injury in rats[D]. Qingdao: Qingdao University, 2016 |
| [10] |
JOY KL, RAJESHKUMAR NV, KUTTAN G. Effect of Picrorrhiza kurroa extract on transplanted tumours and chemical carcinogenesis in mice[J]. J Ethnopharmacol, 2000, 71(1): 261. |
| [11] |
NAJARI A, SACHIN BS, SHARMN SC, et al. Modulation of P-glycoprotein ATPase activity by some phytoconstituents[J]. Phytotherapy Res, 2010, 24(3): 454. DOI:10.1002/ptr.2951 |
| [12] |
黄劲梅, 郑清瑗, 梁惠珍. 胡黄连中香草酸、阿魏酸和肉桂酸的含量测定[J]. 中药材, 2002, 25(12): 881. HUANG JM, ZHENG QY, LIANG HZ. Determination of vanillic acid, ferulic acid and cinnamic acid in Picrorhiza scrophulariiflora[J]. J Chin Med Mater, 2002, 25(12): 881. DOI:10.3321/j.issn:1001-4454.2002.12.013 |
| [13] |
曹玉华, 汪云. 毛细管电泳电化学检测法测定胡黄连中香草酸和阿魏酸的含量[J]. 分析测试学报, 2003, 22(6): 95. CAO YH, WANG Y. Determination of vanillic acid and ferulic acid content by CE-ED[J]. J Instrum Anal, 2003, 22(6): 95. DOI:10.3969/j.issn.1004-4957.2003.06.029 |
| [14] |
张永文. 试谈中药新药质量标准制定的整体思路[J]. 中国新药杂志, 2017, 26(18): 2185. ZHANG YW. Strategic discussion on the overall thinking of developing quality standards of new Chinese medicinal prescriptions[J]. Chin J New Drugs, 2017, 26(18): 2185. |
| [15] |
张可佳, 孙宁宁, 杨雪, 等. UPLC结合化学计量学方法的胡黄连指纹图谱研究[J]. 中草药, 2018, 49(3): 685. ZHANG KJ, SUN NN, YANG X, et al. Fingerprint study of Picrorhiza scrophulariiflora by UPLC coupled with chemometrics method[J]. Chin Tradit Herb Drugs, 2018, 49(3): 685. |
 2019, Vol. 39
2019, Vol. 39 
