坎地沙坦酯(candesartan cilexetil),化学名(±)-1-[[(环己氧代)羰基]氧代]乙基-2-乙氧基-1-[[2’-(1H-四氮唑基-5)-[1,1’-联苯基]-4-基]甲基]-1H-苯并咪唑-7-羧酸酯,以3-硝基邻苯二甲酸为起始原料,经酯化、重排、取代、水解、成酯后制得[1-2]。坎地沙坦酯在体内迅速被水解成活性代谢物坎地沙坦,后者为选择性血管紧张素Ⅱ受体(ATl)拮抗剂,通过与血管平滑肌ATl受体结合而拮抗血管紧张素Ⅱ的血管收缩作用,从而降低末梢血管阻力[3]。研究[4-5]表明,坎地沙坦酯在给药间隔中可呈剂量依赖性地降低高血压病人的舒张压和收缩压,降压作用持久、平稳,且耐受性良好,不良反应较小,可用于较大范围高血压病的治疗,具有广阔的市场前景和良好的实用性。
叠氮化钠亦称“三氮化钠”,是一种剧毒物质,可经呼吸道、消化道和皮肤迅速吸收,具有黏膜刺激、降压、中枢神经损害及强致突变作用[6-7]。叠氮化钠是坎地沙坦酯合成中的关键物料,且用量较大,必须严格控制其残留量。目前,叠氮化钠的检测方法主要有离子色谱法[6-10]、比色法[11]、气相色谱法[12]和液相色谱法[13]等,但液相色谱法灵敏度较低且对色谱柱损害极大,气相色谱法样品处理方法较为复杂。
四丁基溴化铵是1种离子对试剂,具有一定的毒性,且对皮肤、眼睛和呼吸系统有刺激性作用[14-15],其作为坎地沙坦酯合成过程中的催化剂,可能在原料药中会有一定的残留,需要进行控制。目前,四丁基溴化铵的检测方法主要有离子色谱法[14-15]、选择电极法[16]、液相色谱法[17-19]、气相色谱法[20]、质谱法[21],但选择电极法和液相色谱法灵敏度较低,气相色谱法样品处理方法较为复杂,质谱法检测成本较高,且可能会对仪器有一定的污染。
离子色谱在检测阴阳离子时具有灵敏度高、重复性好、方便快捷等优势,现已在药物领域内广泛应用,但国内却未见采用离子色谱法同时测定药物中叠氮化钠和四丁基溴化胺残留的报道。本文基于离子色谱-直接电导技术,建立了同时测定坎地沙坦酯药物中叠氮化钠和四丁基溴化胺残留的方法,并且采用固相萃取技术配制供试品溶液,该方法简单、快速,回收率好,灵敏度高,能够对低浓度的叠氮化钠和四丁基溴化胺残留进行定性与定量分析,有利于对坎地沙坦酯合成反应过程中叠氮化钠和四丁基溴化胺的残留进行有效监测。
1 仪器与试药ICS-2000离子色谱仪(ThermoFisher公司):配有ASRS-ULTRA 4 mm阴离子抑制器和电导检测器;精密分析天平(赛多利斯,BT25S);Milli-Q超纯水仪(Millipore公司);C18固相萃取柱(200 mg:3 mL,ThermoFisher公司)。
叠氮化钠对照品(Sigma- Aldrich公司,纯度≥99.5%);甲醇、乙腈(色谱级,Merck公司);二氯甲烷(色谱级,阿拉丁公司);溴离子标准溶液、硝酸根标准溶液(1 000 μg·mL-1,国家有色金属及电子材料分析测试中心);实验用水为Milli-Q超纯水(电阻率为18.25 MΩ·cm);坎地沙坦酯(某药业集团)。
2 方法与结果 2.1 溶液的制备 2.1.1 对照品溶液精密称定叠氮化钠对照品适量于10 mL量瓶中,用超纯水定容至刻度,混匀后配制成质量浓度为1.0 g·L-1的叠氮根对照储备液,4 ℃密封保存。取叠氮根对照储备液和溴离子标准溶液适量,用超纯水配制成分别含叠氮根0.47 μg·mL-1、溴离子0.12 μg·mL-1的溶液,作为对照品溶液。
2.1.2 供试品溶液准确称取坎地沙坦酯100 mg,置20 mL具塞玻璃离心管中,加二氯甲烷5 mL溶解,再精密加入超纯水10 mL,震荡后静置,取上清液经C18固相萃取小柱(先加3 mL甲醇活化,再加6 mL水冲洗后使用)过滤,2 mL初始滤液弃掉,取续滤液用0.22 μm滤膜滤过,即得。
2.1.3 系统适用性溶液取叠氮根对照储备液、溴离子标准溶液和硝酸根标准溶液适量,用超纯水配制成分别含叠氮根470 ng·mL-1、溴离子120 ng·mL-1和硝酸根470 ng·mL-1的溶液,作为系统适用性溶液。
2.2 色谱条件色谱柱:Ionpac AS18(4 mm×250 mm)阴离子交换色谱柱及相应的Ionpac AG18(4 mm×50 mm)保护柱;流动相:氢氧化钾溶液(EGⅢ在线生成),梯度洗脱(见表 1),流速:1.0 mL·min-1;检测器:ASRS 500-4 mm阴离子抑制器,抑制电流99 mA;电导检测器;柱温:35 ℃;电导池温度:35 ℃;进样体积:200 μL。
|
|
表 1 梯度洗脱条件 Tab.1 Gradient elution condition |
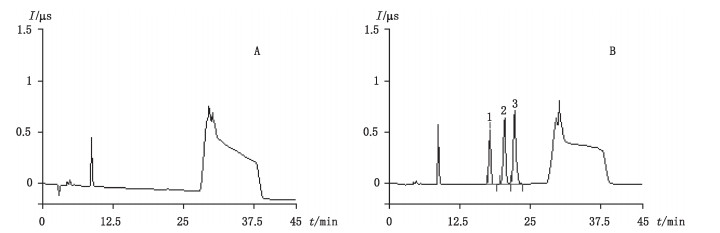
精密量取系统适用性溶液200 μL,按“1.3”项下的色谱条件进样测定,记录色谱图,溴离子、叠氮根、硝酸根依次出峰,叠氮根与溴离子分离度为3.88,叠氮根与硝酸根分离度为2.52,均大于1.5。以超纯水为空白,注入离子色谱仪,记录色谱图,在叠氮根与溴离子出峰处无杂峰干扰。空白及系统适用性色谱图见图 1。
|
1.Br- 2.N3- 3.NO3- 图 1 空白(A)及系统适用性溶液(B)色谱图 Fig.1 Chromatograms of blank(A)and system suitability solution(B) |
取对照品溶液适量,加超纯水逐级稀释,按“1.3”项下色谱条件进样测定,记录色谱图,按信噪比S /N =3计算,叠氮根和溴离子的检测下限分别为0.699 ng·mL-1和1.44 ng·mL-1;按信噪比S /N =10计算,叠氮根和溴离子的定量下限分别为2.33 ng·mL-1和4.8 ng·mL-1。取对照品溶液200 μL,按“1.3”项下色谱条件连续进样6次测定,叠氮根保留时间及峰面积的RSD分别为0.011%和0.49%,溴离子保留时间及峰面积的RSD分别为0.0087%和0.44%。
2.4 线性关系考察在杂质限度200%范围内,分别配制定量下限(叠氮根2.33 ng·mL-1和溴离子4.8 ng·mL-1)、25%限度(叠氮根116 ng·mL-1和溴离子30 ng·mL-1)、50%限度(叠氮根233 ng·mL-1和溴离子60 ng·mL-1)、100%限度(叠氮根466 ng·mL-1和溴离子120 ng·mL-1)、150%限度(叠氮根699 ng·mL-1和溴离子180 ng·mL-1)、200%限度(叠氮根932 ng·mL-1和溴离子240 ng·mL-1)6个浓度的溶液,按“1.3”项下色谱条件进样测定,记录色谱图,以峰面积Y对相关浓度X作曲线,计算回归方程与相关系数。结果表明,叠氮根质量浓度在2.33~932 ng·mL-1,溴离子质量浓度在4.8~240 ng·mL-1范围内线性关系良好,回归方程:
| $ \begin{aligned} &Y=1.300 \times 10^{-3} X+6.900 \times 10^{-3} \quad r=0.9996\\ &Y=8.000 \times 10^{-4} X-2.500 \times 10^{-3} \quad r=0.9995 \end{aligned} $ |
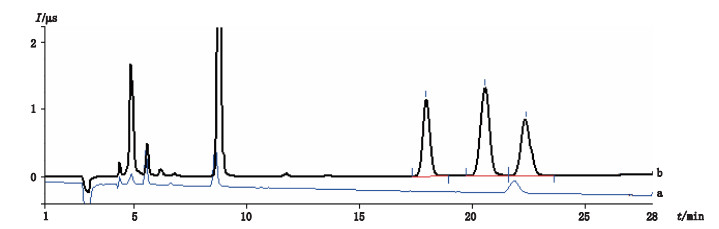
以不含叠氮化钠和四丁基溴化铵的坎地沙坦酯为空白基质,分别添加50%限度、100%限度、150%限度浓度的叠氮根和溴离子对照品进行回收率和精密度试验,每个添加浓度做3个样品,平均回收率为87.3%~104.5%,结果见表 2(坎地沙坦酯空白溶液及添加叠氮根和溴离子的色谱图见图 2)。
|
|
表 2 坎地沙坦酯中添加叠氮根和溴离子回收率结果(n=3) Tab.2 Recoveries of azide ion and bromide ion in candesartan cilexetil |
|
图 2 坎地沙坦酯空白溶液(a)及添加叠氮根和溴离子后(b)的色谱图 Fig.2 Chromatograms of candesartan cilexetil blank(a)and candesartan cilexetil blank spiked with azide ion and bromide ion(b) |
以不含叠氮根和溴离子的坎地沙坦酯药品为空白基质,添加100%限度浓度的叠氮根和溴离子对照品做重复性试验,平行测定6个样品,分别计算叠氮根和溴离子的RSD,考察其重复性。坎地沙坦酯中叠氮根和溴离子含量的重复性RSD(n =6)分别为2.5%和0.66%。
2.5 耐用性考察取系统适用性溶液200 μL,按“1.3”项下色谱条件进样测定,记录色谱图,同时分别改变淋洗液浓度(8.8、9.2 mmol·L-1)、柱温(33、37 ℃)和流速(0.9、1.1 mL·min-1)进行测定,记录色谱图,观察系统适用性的改变情况。结果表明,当色谱条件参数有微小变动时,溴离子、叠氮根和硝酸根的分离度均大于1.5,证明方法耐用性良好。结果见表 3。
|
|
表 3 耐用性试验结果 Tab.3 Results of durability test |
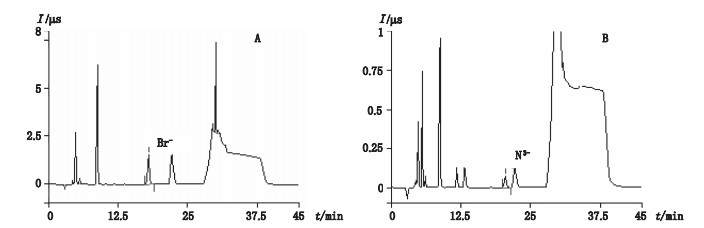
以所建方法检测合成的坎地沙坦酯药物小试、中试及工艺验证各3批共9份样品,共检出2批样品有叠氮化钠残留,分别为0.0012%和0.0016%;2批样品有四丁基溴化铵残留,分别为0.0022%和0.0031%,其他样品均未检出。阳性样品谱图见图 3。
|
图 3 坎地沙坦酯中含四丁基溴化铵(A)和叠氮化钠残留的色谱图(B) Fig.3 Chromatograms of positive samples with tetrabutylammonium bromide(A)and sodium azide(B)residues in candesartan cilexetil |
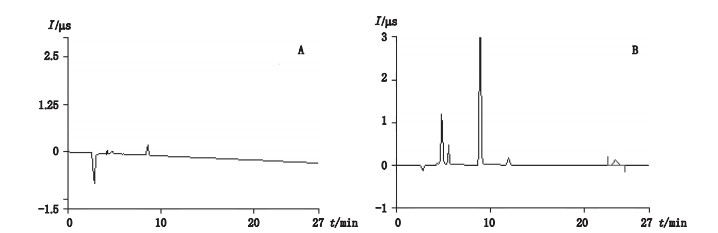
坎地沙坦酯易溶于甲醇、乙腈、二氯甲烷等有机溶剂,几乎不溶于水,但可以溶于碱性溶液。采用甲醇或乙腈配制供试品溶液,虽然坎地沙坦酯能完全溶解,但甲醇或乙腈进入色谱仪后会对色谱柱有一定的损伤。文献[9]采用20 mmol·L-1氢氧化钠溶液配制沙坦类药物,溶液过滤膜后直接上机,虽然效果较好,但大浓度沙坦类药物会进入色谱柱和抑制器,可能会造成堵塞。《中华人民共和国药典》2015年版二部厄贝沙坦品种“叠氮化物”检测项[22]采用90%甲醇溶解样品,利用阀切换在线基体消除法去除厄贝沙坦,将保留叠氮根的水溶液注入色谱柱,可取得较好的效果,但其对仪器本身的配置要求较高。本文借鉴食品中药物残留检测的液液萃取法[23],将坎地沙坦酯溶于二氯甲烷后再用超纯水萃取叠氮根和溴离子,水层过C18固相萃取柱后注入色谱仪,确保去除所有有机物。结果发现,该方法可达到阀切换在线基体消除法的去除效果,样品色谱图背景较为干净,无任何有机物峰干扰。具体谱图见图 4。
|
图 4 空白溶液(A)和样品溶液(B)色谱图 Fig.4 Chromatograms of blank solution(A)and sample solution(B) |
Ionpac AS11-HC和Ionpac AS18阴离子交换柱均为目前较常用的高容量阴离子柱,匹配氢氧化钠或氢氧化钾淋洗液可用于无机阴离子和有机酸的阴离子分析,适合大体积进样测定痕量阴离子。文献[6]采用Ionpac AS11-HC阴离子交换柱进行分离,叠氮根离子虽然出峰较快,峰型较好,与硝酸根的分离度也能满足要求,但却未考察与溴离子的分离度。文献[7-9]均采用Ionpac AS18阴离子交换柱,可以将硝酸根和叠氮根完全分离,但也未考察与溴离子的分离度。本研究分别考察了Ionpac AS11-HC和Ionpac AS18阴离子交换柱对溴离子、叠氮根和硝酸根的分析效果,发现Ionpac AS11-HC阴离子交换柱可以满足叠氮根和硝酸根的分离,但溴离子与叠氮根的分离度仅为1.4左右,不符合要求(≥1.5);而Ionpac AS18阴离子交换柱在9 mmol·L-1淋洗液浓度下可以将溴离子、叠氮根和硝酸根完全分离,分离度分别为3.88和2.42,可以满足要求(≥1.5)。具体谱图见图 5。
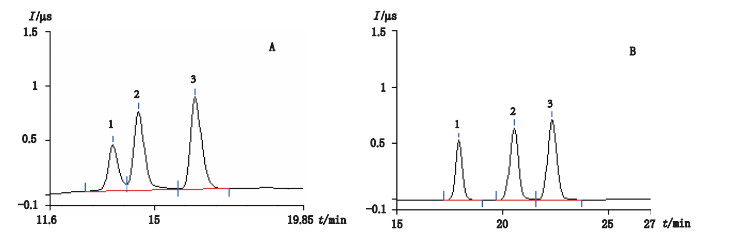
|
1~3.同图 1(same as Fig. 1) 图 5 Ionpac AS11-HC(A)及Ionpac AS18(B)阴离子交换柱分离的系统适用性溶液色谱图 Fig.5 Chromatograms of system suitability solution separated by Ionpac AS11-HC(A)and Ionpac AS18 column(B) |
本文建立了离子色谱-直接电导法同时测定坎地沙坦酯中叠氮化钠和四丁基溴化铵残留,采用固相萃取技术配制供试品溶液,可有效去除有机物,该方法快捷、有效,检测灵敏度高,分离度好,回收率、精密度及定量下限均能满足要求,是检测坎地沙坦酯药物中叠氮化钠和四丁基溴化铵残留的有效方法。将所建方法应用于坎地沙坦酯小试、中试及工艺验证各3批样品的检测,共检出4批样品含有叠氮化钠或四丁基溴化铵残留,可对坎地沙坦酯合成反应进行指导,在项目研发过程起到良好的监督作用。
| [1] |
吴奎伟, 吴成军, 孙铁民. 坎地沙坦酯的合成工艺研究[J]. 中南药学, 2014, 12(8): 785. WU KW, WU CJ, SUN TM. Synthesis of candesartan cilexetil[J]. Cent South Pharm, 2014, 12(8): 785. |
| [2] |
唐显军, 陈明. 坎地沙坦-血管紧张素受体拮抗剂的研究进展[J]. 心血管病学进展, 2004, 25(3): 172. TANG XJ, CHEN M. Advance in research of angiotensin receptor blockades-candesartan[J]. Adv Cardiovasc Dis, 2004, 25(3): 172. DOI:10.3969/j.issn.1004-3934.2004.03.004 |
| [3] |
孙在茂. 坎地沙坦酯联合氢氯噻嗪治疗老年性退行性心瓣膜病心力衰竭的临床观察[J]. 中国药房, 2015, 26(21): 2922. SUN ZM. Clinical observation of candesartan cilexetil combined with hydrochlorothiazide in the treatment of elderly degenerative valvular heart disease heart failure[J]. J China Pharm, 2015, 26(21): 2922. DOI:10.6039/j.issn.1001-0408.2015.21.16 |
| [4] |
谢向阳, 李旸, 林雯, 等. 坎地沙坦酯片的制备及初步稳定性研究[J]. 中国药师, 2015, 18(4): 664. XIE XY, LI Y, LIN W, et al. Preparation and preliminary stability of candesartan cilexetil tablets[J]. China Pharm, 2015, 18(4): 664. DOI:10.3969/j.issn.1008-049X.2015.04.049 |
| [5] |
鲁风云. 阿托伐他汀联合坎地沙坦酯治疗原发性高血压的临床研究[J]. 现代药物与临床, 2013, 5(9): 958. LU FY. Clinical study on atorvastatin combined with candesartan cilexetil in treatment of primary hypertension[J]. Drugs Clin, 2013, 5(9): 958. |
| [6] |
林伟豪, 李东, 吴婵娟. 离子色谱法测定厄贝沙坦胶囊中叠氮化物的残留量[J]. 中国药师, 2015, 24(11): 55. LIN WH, LI D, WU CJ. Determination of azides residual amount in irbesartan capsule by ion chromatography[J]. China Pharm, 2015, 24(11): 55. |
| [7] |
李美君, 姚仙珍, 汪秀林, 等. 离子色谱法测定厄贝沙坦中叠氮化物[J]. 中国医药导报, 2013, 9(32): 118. LI MJ, YAO XZ, WANG XL, et al. Determination of azide in irbesartan by ion chromatography[J]. Chin Med Herald, 2013, 9(32): 118. |
| [8] |
谭颖喆. 离子色谱法测定工业废水中的叠氮化物[J]. 环境科学导刊, 2016, 35(增刊): 94. TAN YZ. Determination of azide in industrial wastewater by ion chromatography[J]. Environ Sci Sur, 2016, 35(Suppl): 94. |
| [9] |
姚超英. 离子色谱法测定沙坦类药物中的叠氮根[J]. 浙江大学学报(理学版), 2008, 35(3): 305. YAO CY. Determination of azide in Sartan by ion chromatography[J]. J Zhejiang Univ(Sci Ed), 2008, 35(3): 305. DOI:10.3785/j.issn.1008-9497.2008.03.015 |
| [10] |
胡晓敏, 宋周虎. 免试剂离子色谱法测定缬沙坦中叠氮化物和无机阴离子[J]. 中国药师, 2007, 10(7): 623. HU XM, SONG ZH. Simutaneous determination of azide and other anions in valsartan by reagent free ion chromatography[J]. China Pharm, 2007, 10(7): 623. DOI:10.3969/j.issn.1008-049X.2007.07.001 |
| [11] |
何春兰, 刘蔼成, 陈志莲, 等. 比色法测定空气中微量叠氮化物[J]. 实用预防医学, 2010, 28(7): 708. HE CL, LIU AC, CHEN ZL, et al. Determination of trace azide in air by colorimetry[J]. Pract Prev Med, 2010, 28(7): 708. |
| [12] |
MARQUET P, CLEMENT S, LOTFI H, et al. Analytical findings in a suicide involving sodium azide[J]. J Anal Toxicol, 1996, 20(2): 134. DOI:10.1093/jat/20.2.134 |
| [13] |
KIKUCHI M, SATO M, ITO T, et al. Application of a new analytical method using gas chromatography and gas chromatography-mass spectrometry for the azide ion to human blood and urine samples of an actual case[J]. J Chromatogr B, 2001, 752(1): 149. |
| [14] |
陈盼盼, 王宏亮. 离子色谱法测定氯沙坦钾原料药中四丁基溴化铵的残留[J]. 中国药事, 2016, 30(7): 670. CHEN PP, WANG HL. Determination of residual tertbutyl ammonium bromide in losartan potassium by ion chromatography[J]. Chin Pharm Aff, 2016, 30(7): 670. |
| [15] |
黄巧巧, 钟乃飞, 洪高云. 离子色谱法测定左乙拉西坦中的痕量四丁基溴化铵[J]. 中国卫生检验杂志, 2014, 24(4): 505. HUANG QQ, ZHONG NF, HONG GY. Determination of residual tetrabutyl ammonium bromide in levetiracetam by ion chromatography[J]. Chin J Health Lab Technol, 2014, 24(4): 505. |
| [16] |
朱智甲, 傅菊荪, 王倩倩. 溴离子选择电极法测定有机化工产品中四丁基溴化铵的残留[J]. 分析测试学报, 2007, 26(5): 428. ZHU ZJ, FU JX, WANG QQ. Detemination of tetrabutyl ammonium bromide residua in organic chemical products by bromide iob selective electrode[J]. J Instrum Anal, 2007, 26(5): 428. |
| [17] |
SUBRAMANIAN NH, MANIGANDAN P, JEEVAN RG, et al. Ion chromatographic determination of residual phase transfer catalyst in active pharmaceutical ingredient[J]. J Chromatogr Sci, 2009, 47(7): 540. DOI:10.1093/chromsci/47.7.540 |
| [18] |
JAGOTA NK, CHETRAM AJ, NAIR JB. Ion chromatography of amylamine and tert.-butylamine in pharmaceuticals[J]. J Chromatogr A, 1996, 739(1-2): 343. DOI:10.1016/0021-9673(96)00046-5 |
| [19] |
MIURA Y, WATANABE M. Ion-pair chromatography of polythionates and thiosulfate with detection based on their catalytic effects on the postcolumn azide-iodine reaction[J]. J Chromatogr A, 2001, 920(1-2): 163. DOI:10.1016/S0021-9673(00)01261-9 |
| [20] |
LOPEZ AF, PERALTA de ARIZE MT, ORIO OA. Rapid method for quantitative determination of tetrabutylammonium bromide in aqueous solution by gas chromatography[J]. J High Resolut Chrom, 1989, 12(7): 503. DOI:10.1002/jhrc.1240120725 |
| [21] |
刘继华, 吴凡, 刘屹, 等. UPLC-MS/MS法测定硫辛酸中催化剂四丁基溴化铵的残留量[J]. 药物分析杂志, 2011, 31(7): 1361. LIU JH, WU F, LIU Y, et al. UPLC-MS/MS determination of tetrabutyl ammonium bromide in lipoic acid[J]. Chin J Pharm Anal, 2011, 31(7): 1361. |
| [22] |
中华人民共和国药典2015年版.二部[S]. 2015: 70 ChP 2015.Vol Ⅱ[S]. 2015: 70 |
| [23] |
GB/T 21311-2007动物源性食品中硝基呋喃类药物代谢物残留量检测方法高效液相色谱/串联质谱法[S]. 2008 GB/T 21311-2007 Determination of Residues of Nitrofuran Metabolites in Foodstuffs of Animal Origin-HPLC-MS/MS[S]. 2008 |
 2019, Vol. 39
2019, Vol. 39 
