雄黄为硫化物类矿物雄黄族雄黄,用于痈肿疔疮,蛇虫咬伤,虫积腹痛,惊痫,疟疾[1]。近年来,雄黄在治疗白血病等血液系统疾病方面有显著疗效,且引起了国内外广泛关注[2]。《中华人民共和国药典》 (以下简称《中国药典》)2015年版(一部)中含雄黄的中成药共37种,占药典成方总数的1.91%(37/1933)[1],其中大部分为内服制剂。雄黄的主要成分是As2S2[3]或As4S4[4],另含有少量的可溶性砷盐,以As2O3为主。研究报道As2O3既是雄黄的药效活性部分,又是毒性成分[5-6]。砷为剧毒元素,国际上对其有严格的限量标准[7-8],故雄黄安全性受到质疑。
砷对人及生态系统的毒性不仅与元素总量有关,还与元素存在的化学形态密切相关,雄黄中的砷在生物体内的存在形式主要包括4类:无机砷[亚砷酸盐(AsO2-)和砷酸盐(AsO3-)]、有机砷小分子[一甲基砷酸(MMA)、二甲基砷酸(DMA)等]、砷的有机化合物[砷甜菜碱(AsB)、砷胆碱(AsC)等]、含砷的生物大分子。雄黄中砷的化学形态不同,其生物活性和毒性也各不相同,其中6种常见的砷形态毒性由大至小的顺序为亚砷酸盐、砷酸盐、MMA、DMA、AsB、AsC,而AsB、AsC通常被认为是无毒的[9]。
本研究应用原子荧光法对雄黄及制剂中总砷及可溶性砷进行测定,应用液相色谱-原子荧光法对雄黄及制剂中的毒性较大的AsO2-、AsO3-、MMA、DMA进行测定,对改进砷元素毒性成分检测方法及制定科学合理的雄黄临床用量标准有参考意义。
1 仪器与试药 1.1 仪器AFS-933原子荧光光度计,配SAP-20形态分析预处理装置(北京吉天公司);Agilent 1260型高效液相色谱仪,配Agilent G4212B紫外检测器和OpenLAB CDS版本色谱工作站(Agilent公司);MARS6微波消解仪(CEM公司);Milli-Q超纯水机(Millipore公司);JRY-D450-D石墨加热板(湖南金蓉园仪器设备有限公司);KQ-300DE型数控超声波仪(昆山市超声仪器有限公司);Secura 225D电子天平(Sartorius公司);ME204TS电子天平(Mettler公司);HY-2A往复恒温振荡器(常州澳华仪器有限公司);ST16R高速冷冻离心机(Thermo公司);EFAA-DC24-RT氮吹仪(上海安谱实验科技股份有限公司)。
1.2 试剂与试药 1.2.1 试剂硫脲、抗坏血酸、氨水、硼氢化钾、磷酸二氢铵、氢氧化钾均为分析纯,盐酸、高氯酸为优级纯,甲醇为色谱纯,均购于德国Merck公司;超纯水:电阻率18.2 MΩ·cm-1;10%硫脲-10%抗坏血酸:称取10g硫脲,加入水80 mL,加热溶解,冷却后加入10 g抗坏血酸,稀释至100 mL,现配现用。15 mmol磷酸二氢铵:称取1.7 g磷酸二氢铵,用水溶解并定容至1 000 mL,用氨水调节pH至6.0。
1.2.2 试药砷标准溶液(浓度100 μg·mL-1、批号15101)、亚砷酸根溶液标准物质[浓度以As计为(75.7±1.2)μg·g-1,批号16071]、砷酸根溶液标准物质[浓度以As计为(17.5±0.4)μg·g-1,批号16071]、一甲基砷溶液标准物质[浓度以As计为(25.1±0.8)μg·g-1,批号1707]、二甲基砷标准溶液[浓度以As计为(52.9±1.8)μg·g-1,批号1704]均购于中国计量科学研究院。
小儿至宝丸(Y1)、牛黄清火丸(Y2)、牛黄解毒片(Y3)均为北京同仁堂股份有限公司同仁堂制药厂生产;儿科七厘散(Y4)、珠黄吹喉散(Y5)为国药集团冯了性(佛山)药业有限公司生产;雄黄粉(Y6)购于药店。
2 方法与结果 2.1 仪器测定条件 2.1.1 原子荧光光度计条件光电倍增管负高压:270 V;原子化器高度:8 mm;砷空心阴极灯电流:60 mA;载气:氩气;载气流量:400 mL·min-1;屏蔽气流量:800 mL·min-1;测量方式:荧光强度;读数方式:峰面积。氢化物发生装置载流:5%盐酸;还原剂:2%硼氢化钾-0.5%氢氧化钾溶液。
2.1.2 原子荧光-液相色谱条件流动相:15 mmol·L-1磷酸二氢铵;色谱柱:NW Sep AX HPLC Column(250 mm×4.0 mm,10 μm),保护柱CNW Sep Ax Guard Cartridge Kit (5.0 mm×4 mm,10 μm);柱温:30 ℃;流速:1 mL·min-1。氢化物发生装置载流:7%盐酸;还原剂:2%硼氢化钾-0.35%氢氧化钾溶液;蠕动泵转速:65 r·min-1。砷空心阴极灯灯电流:100 mA;光电倍增管负高压:295 V;屏蔽气流量:600 mL·min-1;载气流量:300 mL·min-1;读数模式:峰面积读数。
2.2 标准溶液的制备及线性关系考察 2.2.1 总砷线性关系考察精密吸取砷标准溶液适量,加入10%硫脲-10%抗坏血酸溶液1 mL,用5%盐酸溶液稀释至刻度,摇匀,配制成10 μg·L-1砷溶液。按“2.1”项下原子荧光光度计条件测定,仪器自动配制2、4、6、8、10 μg·L-1砷标准溶液,以质量浓度C为横坐标,荧光值A为纵坐标绘制砷总量的标准工作曲线:
| $ A=439.6 C+58.79 \quad r=0.9996 $ |
结果表明待测物质量浓度在0~10 μg·L-1范围内线性关系良好。
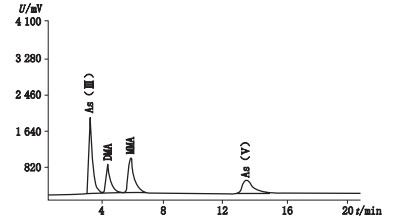
2.2.2 砷价态线性关系考察精密吸取As(Ⅲ)、As(Ⅴ)、MMA、DMA标准物质溶液适量,加水制成每1 L含As (Ⅲ)、As (Ⅴ)、DMA、MMA等不同价态砷0、5、10、20、30、50、100 μg的系列标准溶液,按“2.1”项下原子荧光-液相色谱条件测定。以质量浓度C为横坐标,以各待测峰峰面积A为纵坐标绘制标准曲线。4种价态的砷在本文色谱条件下分离良好(见图 1),在0~100 μg·L-1范围内线性关系良好(见表 1)。
|
图 1 4种砷形态化合物混合标准溶液色谱图 Fig.1 Chromatogram for four speciations of arsenic |
|
|
表 1 4种形态砷的标准曲线方程 Tab.1 Equation of the four speciations of arsenic |
精密称取含雄黄复方制剂0.2 g(精确到0.001 g),或雄黄粉0.05 g(精确到0.001 g)于微波消解罐中,加硝酸9 mL、高氯酸1 mL,放置30 min后放入微波消解仪中进行消解。消解完全后置于加热板上赶酸。将消化液转移至25 mL量瓶中,用少量水洗涤消化罐3次,合并洗涤液,用5%盐酸溶液稀释至刻度,使总砷管浓度为6ug·L-1,按“2.1”项下原子荧光光度计条件测定。同时做2份试剂空白。5种雄黄复方制剂Y1、Y2、Y3、Y4、Y5总砷含量分别为10 311.0、20 715.7、57 821.8、31 326.6、30 408.2 μg·g-1,雄黄粉的总砷含量为634 543.8 μg·g-1。试验结果显示,若以总砷计则均远远超出《中国药典》2015年版一部中规定的中药材允许限量值5 mg·kg-1。
2.3.1 检测下限按“2.1”项下原子荧光光度计条件,分别连续测定空白溶液11次,以空白溶液的3倍标准偏差除以标准曲线斜率计算检测下限。总砷的检测下限为0.024 5 μg·L-1。
2.3.2 精密度按“2.1”项下原子荧光光度计条件,取砷标准储备液(100 μg·L-1)连续进样6次,RSD为1.4%,精密度良好。
2.3.3 回收率试验精密称取小儿至宝丸0.1 g(精确到0.001 g),加入砷标准液(100 μg·mL-1)10 mL,按“2.3”项下的方法操作,每个样品平行制备3份供试溶液,上机测定,回收率为94.0%,RSD为2.2%,见表 2中总砷测定。
|
|
表 2 总砷、可溶性砷回收试验 Tab.2 The recovery of standard addition in arsenic, soluble arsenic |
取YI样品6份,照“2.3”项方法,平行制备供试溶液,测得总砷平均含量为10311.0 μg·L-1,RSD为4.5%。重复性结果符合要求。
2.4 可溶性砷含量测定本实验设计采用模拟人工胃液振荡提取、甲醇超声提取2种方法对可溶性砷含量进行考察。聂黎行等[10]研究表明,牛黄消炎片经人工胃液振荡提取8 h后,可溶性砷含量基本稳定。一般混合性食物由胃排空的时间约4~6 h,故本实验设计考察人工胃液振荡提取时间为6 h,温度模拟人体正常温度37 ℃。
2.4.1 模拟人工胃液振荡提取精密称取含雄黄复方制剂0.2 g,或雄黄粉0.05 g于50 mL具塞塑料离心管中,精密加入人工胃液10 mL,摇匀,置于恒温振荡器上37 ℃振荡4 h,冷却至室温。置于高速离心机中以10 000 r·min-1离心10 min,取上层清液,用水稀释至含砷约6 μg·L-1,即得。
2.4.2 甲醇超声提取分别精密称取含雄黄复方制剂0.2 g,或雄黄粉0.05 g于50 mL具塞塑料离心管中,精密加入甲醇-水溶液(1:1)10 mL,20 ℃超声(1 500 W,40 kHz)30 min后,置于高速离心机中以10 000 r·min-1离心10 min。精密吸取上层清液5 mL,置于氮吹仪中40 ℃浓缩至剩余约2 mL,冷却至室温后用超纯水定容至10 mL,用水稀释,至含砷约6 ug·L-1即得。
2.4.3 样品测定采用“2.4.1”、“2.4.2”项下2种提取方法对5种含雄黄复方制剂和雄黄粉中可溶性砷进行提取,每个样品平行制备3份供试溶液,按“2.1”项下原子荧光光度计条件测定,其结果见表 3。
|
|
表 3 样品中可溶性砷含量测定结果 Tab.3 Results of total soluble arsenic from samples |
取砷标准储备液(100 μg·L-1)按“2.1”项下原子荧光光度计条件连续进样6次,RSD为1.4%,精密度良好。
2.4.5 检测下限按“2.1”项下原子荧光光度计条件,分别连续测定空白溶液11次,以空白溶液的3倍标准偏差除以标准曲线斜率计算检测下限。可溶性砷的检测下限为0.024 5 μg·L-1。
2.4.6 回收率试验分别精密称取小儿至宝丸各0.1 g(精确到0.001 g),加入砷标准储备液(100 μg·mL-1)20 μL,按“2.4.1”、“2.4.2”项下的方法操作,每个样品平行制备3份供试溶液,按“2.1”项下原子荧光光度计条件测定。甲醇超声提取方法回收率为96.4%,RSD为7.7%;人工胃液振荡提取方法回收率为96.5%,RSD为1.9%,见表 2。
2.4.7 重复性试验取Y1样品6份,采用“2.4.1”和“2.4.2”项下2种提取方法制得供试溶液,2种方法可溶性砷平均含量分别为27.33 μg·g-1(RSD=3.5%)和40.61 μg·g-1(RSD=2.4%),结果符合要求。
2.5 可溶性砷形态分析 2.5.1 样品制备将“2.4.1”项和“2.4.2”项下方法制备的供试溶液。
2.5.2 精密度试验按“2.1”项下方法,以砷形态混合标准溶液连续进样6次,计算RSD,分别为As(Ⅲ)3.7%,As(Ⅴ)4.5%,DMA 0.9%,MMA 1.4%,精密度良好。
|
|
表 4 不同价态/形态砷回收率试验 Tab.4 The recovery of standard addition in the speciation of soluble arsenic |
按“2.1”项下方法,以质量浓度为5 μg·L-1的不同价态砷标准溶液进行分析,计算各峰信噪比,并换算至3倍信噪比,作为不同砷价态的检测下限,As(Ⅲ)、As(Ⅴ)、DMA、MMA的检测下限分别为2.1、2.3、2.4、2.6 μg·L-1。
2.5.4 回收率试验精密称取小儿至宝丸各0.1 g(精确到0.001 g),加入亚砷酸根溶液标准物质、砷酸根溶液标准物质、一甲基砷溶液标准物质、二甲基砷标准物质适量,分别按“2.4.1”、“2.4.2”项下的方法操作,每个样品平行制备3份供试溶液,按“2.1”项下原子荧光-液相色谱条件测定,见表 6。结果显示,甲醇超声提取方法各价态砷的回收率在84.9%~101.2%之间,RSD 2.5%~8.2%;人工胃液振荡提取方法各价态砷的回收率在83.2%~93.8%之间,RSD 2.3%~7.2%。
|
|
表 5 可溶性砷形态测定结果(μg·g-1) Tab.5 Results of the speciation of the soluble arsenic |
|
|
表 6 样品中总砷、可溶性砷和无机砷含量对比 Tab.6 Comparison of total arsenic and total soluble arsenic with the speciation of the soluble arsenic |
取Y1样品12份,采用“2.4.1”、“2.4.2”项下2种提取方法制备供试溶液各6份。模拟人工胃液振荡提取As(Ⅲ)、As(Ⅴ)平均含量分别为28.97 μg·g-1(RSD=6.4%),1.66 μg·g-1(RSD=5.8%);甲醇超声提取As(Ⅲ)、As(Ⅴ)平均含量为18.02 μg·g-1(RSD=5.2%)、1.43 ug·g-1(RSD=4.8%)
2.5.6 样品测定按“2.5.1”项下方法制备供试溶液,每个样品平行3份,按“2.1”项下方法测定,考察不同提取方法的可溶性砷的价态,结果见表 5,可溶性砷占总砷百分含量和无机砷占可溶性砷的百分含量见表 6。
3 讨论 3.1 提取方法的选择实验发现,甲醇超声提取法与模拟人工胃液振荡提取法的提取效率相当,说明20 ℃超声30 min的条件下,甲醇超声提取法是一种有效、省时的提取方法。
3.2 雄黄及其制剂所含砷的主要形态雄黄及其制剂中所含砷主要为不溶性砷,可溶性砷含量较低,试验发现约为0.26%~1.05%。可溶性砷以无机砷为主,大部分为三价砷。相同提取条件下,无机砷占可溶性砷含量因配伍、配料不同而差别较大。实验未检出毒性较大的有机砷DMA、MMA。
3.3 对雄黄检查及含量测定的建议2015年版《中国药典》(一部)中雄黄检查及含量测定项下,规定用滴定法测定雄黄总砷百分含量(以As2S2计)不得低于90.0%,对可溶性砷As2O3限量没有规定,仅要求As2O3按砷斑法检测,判定依据为样品砷斑颜色不可深于标准砷斑[1]。砷斑法是一种半定量的方法,仅凭肉眼判断可溶性砷盐含量是否超标,准确度不够高,无法准确测定可溶性砷盐的含量,更不能分析砷的价态。因此,采用更先进的检测方法,对雄黄及其制剂中的砷的形态进行研究,确保用药安全,药品质量可控具有较大的意义。原子荧光光谱法和液相色谱-原子荧光光谱法广泛应用于食品、地质、环境等领域,在药品检测领域尚未见应用的报道。
| [1] |
郝春莉, 赵丽, 庄峙厦. HPLC-ICP/MS联用同时分析中药材中的多种形态砷[J]. 分析实验室, 2011, 30(6): 90. HAO CL, ZHAO L, ZHUANG ZX. Analysis of arsenic speciation in traditional Chinese medicines by hyphenated technique of high performance liquid chromatography-inductively coupled plasma mass spectrometry[J]. Chin J Anal Lab, 2011, 30(6): 90. |
| [2] |
田雨, 蔡璇, 郑锡波, 等. 高效液相色谱-氢化物发生-原子荧光光谱法分析桂皮中砷形态化合物的检测方法[J]. 化学工程师, 2014, 221(2): 19. TIAN Y, CAI Y, ZHEN XB, et al. Arsenic speciation analysis in cinnamon by high performance liquid chromatography-hydride generation-atomic fluorescence spectrometry[J]. Chem Eng, 2014, 221(2): 19. |
| [3] |
陈宪平, 赵武生, 陈进. 雄黄雌黄的电镜-能谱仪分析[J]. 中草药, 1999, 30(6): 435. CHEN XP, ZHAO WS, CHEN J. Analysis of realgar and orpiment by electron microscopy-energy spectrometer[J]. Chin Tradit Herb Drugs, 1999, 30(6): 435. DOI:10.3321/j.issn:0253-2670.1999.06.016 |
| [4] |
梁国刚, 张启伟. 朱砂、雄黄中各成分的溶解度对其药效、毒副作用的影响[J]. 中国中药杂志, 2002, 27(5): 391. LIANG GG, ZHANG QW. Effects of solubility of components in cinnabar and realgar on their pharmacodynamics and toxicity[J]. China J Chin Mater Med, 2002, 27(5): 391. DOI:10.3321/j.issn:1001-5302.2002.05.030 |
| [5] |
张娟, 刘启德, 汤毅珊. 雄黄中砷的毒副作用研究进展[J]. 中国药房, 2007, 18(15): 1178. ZHANG J, LIU QD, TANG YS. Research progress on toxic and side effects of arsenic in realgar[J]. China Pharm, 2007, 18(15): 1178. DOI:10.3969/j.issn.1001-0408.2007.15.027 |
| [6] |
叶祖光, 王智民, 王跃生, 等. 安宫牛黄丸中朱砂和雄黄的药理作用特点与安全性评价研究[J]. 医学研究通报, 2005, 34(9): 35. YE ZG, WANG ZM, WANG YS, et al. Pharmacological characteristics and safety evaluation of cinnabar and realgar in Angong Niuhuang pills[J]. J Med Res, 2005, 34(9): 35. |
| [7] |
李敏, 刘渝, 周睿, 等. 国内外有关中药中重金属和砷盐的限量标准及分析[J]. 时珍国医国药, 2007, 18(11): 2859. LI M, LIU Y, ZHOU R, et al. Analysis on limit standards for heavy metals and arsenic salts in traditional Chinese medicine both at home and abroad[J]. Lishizhen Med Mater Med Res, 2007, 18(11): 2859. DOI:10.3969/j.issn.1008-0805.2007.11.158 |
| [8] |
陈家春, 贾敏如. 中、美、英、日和欧洲药典中植物药重金属和农药残留量的限量规定及分析[J]. 华西药学杂志, 2005, 20(6): 525. CHEN JC, JIA MR. Regulation and analysis on limit contents for heavy metals and pesticide residues in medicinal plants from the pharmacopoeias of China, the United States, Britain, Japan and Europe[J]. West China J Pharm Sci, 2005, 20(6): 525. DOI:10.3969/j.issn.1006-0103.2005.06.022 |
| [9] |
中华人民共和国药典2015年版.四部[S]. 2015: 102 ChP 2015.Vol Ⅳ[S]. 2015: 102 |
| [10] |
CATOR KP, LUBIN JH. Arsenic, internal cancers, and issues in inference from studies of low level exposures in human population[J]. Toxicol Appl Pharmacol, 2007, 222(3): 252. DOI:10.1016/j.taap.2007.01.026 |
 2019, Vol. 39
2019, Vol. 39 