2. 烟台大学, 烟台 264003
2. Yantai University, Yantai 264003, China
药品质量中的不合格项,即OOS(out-of-specification)项,是指任何超出已规定接受标准(acceptance criteria,AC)的质量属性项目;按照美国FDA 2006版的OOS调查指南[1],这些接受标准主要来自官方发布或认可的文件,包括新药申请(NDA)、药物主文件(drug master file,DMF),药典或者企业内部标准。OOS研究是现代药品化学、生产和质量控制(chemistry,manufacture and control,CMC)领域的重要内容。深入系统地研究和分析OOS问题,可发现和评价所测定药品质量控制指标的接受标准是否科学,找出药品生产过程中导致OOS的具体原因,汇总分析CMC各环节中导致OOS的主要因素等,从而对进一步改进生产工艺,完善质量标准,减少生产商损失或降低消费者使用风险等具有重要意义。因此,该内容在国际药品监管领域中受到越来越多的重视,并举办了多次相关的国际研讨会或论坛[2-3],从OOS相关术语的引入和规范,到OOS判定,OOS调查,再到OOS管理等方面进行研究并制定准则。该内容也已成为GMP[4]和实验室认证认可[5]检查等质量管理中不可或缺的一项内容。
目前国内对OOS的研究主要集中在对OOS的调查流程分析[6-8],包括对检测实验室或生产企业的各个操作环节分析(包括实验室初步调查、全面OOS调查、扩大生产调查)及调查流程图(OOS调查决策树)的制定;却很少有人探讨如何科学地制定OOS判定的标准或准则,也少有针对某一实验室或生产企业的OOS进行深入系统论述并制定判断决策的方法介绍。由于基础研究工作的相对薄弱,导致国内在OOS分析和管理中经常出现一些常见困惑现象,如按照目前实验室常规方式分析OOS,对边缘产品应该重复检测多少次问题,还有最终如何下结论的问题,如何科学地给出实验室经常导致OOS主要因素等。
为更好地解决目前国内OOS分析中存在的一些瓶颈问题,推动OOS的统计判定策略在国内药品领域的科学实施,本文将在介绍涉及OOS判定的相关法规基础上,重点结合药品领域的特点,用边缘产品的实例阐述可行的判定规则,并分析讨论国内目前常见问题,以期为国内生产企业和检测实验室OOS判定规则的制定提供理论支撑。关于如何对OOS进行管理,将在另文举例分析。
1 OOS判定的法规及发展概要对检测属性接近其质量限周围的某批产品,称其为边缘产品。在对该批产品的检测中,由于检测方法本身的变异,对其所测结果会产生直接影响:当产品质量实际在质量限内侧时,但因检测失误而给出OOS时,不仅会对企业带来经济损失,还会影响其企业信誉;当产品处于质量限度范围外测时,如果因检测失误而给出合格的判定,将会对消费者造成伤害或经济损失。所以,正确判断产品的(不)合格性也是司法中非常关注的内容。目前所检索到的最早关注该问题并形成相关规范性文件的是美国国家标准研究所(American National Standards Institute,ANSI)在1993年提出的《测量不确定度表达指南》[9];其次是美国机械工程学会(American Society of Mechanical Engineers,ASME)在1999年开展对测量不确定度的全面深入探究,探讨对产品是否合格的判定规则,并在2001年形成对产品符合性的判定规则[10],引入了警戒区间(guard band,g)的概念;2005年,该组织增加了1个技术报告型指导原则[11],专门阐述如何设置测试限并探讨了实施决策规则中的风险平衡问题。随后国际标准组织(ISO)[12-13]和欧洲化学/分析化学跟踪协会(EURACHEM/Cooperation on international traceability in analytical chemistry---EURACHEM/CITAC)[14]和国际计量导则联合委员会[15](Joint Committee for Guides in Metrology,JCGM)相继引入并形成相应的标准或指导原则。其中ASME和JCGM从测量不确定度的角度进行了深入的探讨。近期中国合格评定国家认可委员会(CNAS)也依据JCGM的文件形成《测量不确定度在符合性判定中的应用》(CNAS-TRL-010:2019)[16]等文件。由此可见,国内外对于如何判断1个产品是否合格的规则上,已经进行了长期的基础性研究,并最终提出了现已被普遍接受的判定规则。
在理想情况下质量控制限(specification limit,SL)将产品质量区间划分为质量合格区间(specification zone)和不合格区间(OOS),如图 1的Ⅰ阶段;但是由于检测过程的变异(增加了测量不确定度),特别是检测方法本身的变异,对产品的检测将出现1个不确定区间(uncertainty range),如图 1的Ⅱ阶段。上述法规均对该不确定区间的计算和增加后的状态进行了阐述,具体见图 1[17]所示。
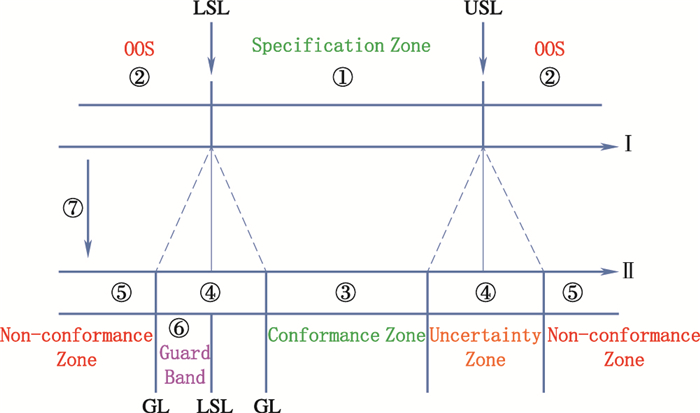
|
①质量限度区间(specification zone)②不合格区间(out-of-specification zone)③合格区间(conformance zone)④不确定区间(uncertainty range)⑤不合格区间(non-conformance zone)⑥警戒区间(guard band,g)⑦增加测量不确定度(increasing measurement uncertainty,U) USL:质量标准上限(upper specification limit)LSL:质量标准下限(lower specification limit)GL:测试限(gauging limit) Ⅰ.设计/质量规范阶段(design/specification phase)Ⅱ.确证阶段(verification phase) 图 1 增加测量不确定度后产品(不)合格性状态的变化(根据文献[17]修改) Fig.1 Zone changes of (non-) conformance of products after adding measurement uncertainty to specification zone (modified according to Ref. [17]) |
在描述该不确定区间时,不同法规和指导原则所用的术语是不同的。如ISO10576[13]使用无结论区间(inconclusive zone)这一术语,未谈及测量不确定度和警戒区间的概念。ASME使用测试限(gauging or test limit,GL)定义出可接受区间(acceptance zone),并引入了警戒区间(guard band,g)的概念。Eurachem/CITAC guide是在参照ASME和ISO的基础上形成的,它借鉴了上述两组织的文件,特别是ASME所起草的文件的优点,并进一步明确了警戒区间由质量限值(SL)到一侧测试限(GL)的区间,在数值上,警戒区间是整个不确定区间的一半大小。事实上,无论使用哪种术语进行描述,其计算原理都一致。这里统一使用警戒区间来对检测的变异区间进行描述。
2 警戒区间的计算关于警戒区间的计算,EURACHEM/CITAC guide阐述的更为详尽。具体计算公式如下:
| $ 警戒区间{\rm g}=h·U=h·k·u_{\rm c} $ |
公式中,U为测量的扩展不确定度(expanded uncertainty),U=k·uc;uc是测量的合成标准不确定度(combined standard uncertainty),是指将影响整个实验过程的所有标准不确定度分量按公式合成在一起的总标准不确定度,这里实际是测量方法的总变异;k为计算扩展不确定度的包含因子(coverage factor),一般取k为2~3,目前许多情况采用k=2(总体包含约95%的样本量)的方式,但当样本量过少(自由度太小)时不宜采用该方式[18];h为警戒区间系数(guard band coefficient),可按符合质量限的概率,即符合性概率(conformance probability,Pc)或根据消费者风险或生产商风险进行风险平衡,根据表 1[11]进行选择。但一般可以选择h=1。
|
|
表 1 不同符合性概率与警戒区间系数关系[11] Tab.1 Relationship between conformance probabilities and guard band coefficients |
通过对上述质量限加入不确定区间后的变化,各法规也对OOS判定的决策规则进行了阐述。总体上有2种决策规则,即三分法决策规则和二分法决策规则。
三分法决策规则是将产品的检测结果划分为3个区域:合格区、不确定区间和不合格区间,具体可参见图 1中的③④⑤区域。其中ISO10576[13]、ILAC-G8:03[19]使用此种决策规则进行结果的判定,且ILAC-G8:03还对这种决策的描述给出了严谨的表达方式:(1)当产品检测结果处于③的区域,使用“毫无疑问,测量结果表明,所测值符合产品规格要求”(The measurements have demonstrated,beyond any reasonable doubt,that the value of the measurand is in conformity with the requirements)的表述;(2)当产品结果处于⑤的区域,采用“毫无疑问,测量结果表明,所测值不符合产品规格要求”(The measurements have demonstrated,beyond any reasonable doubt,that the value of the measurand is not in conformity with the requirements)的表述;(3)若产品结果处于④的区域,则使用所测结果无法确切证明是否符合或不符合产品规格要求(The measurements have not been able to demonstrate,beyond any reasonable doubt,if the value of the measurand is or is not in conformity with the requirements)的表述。
从司法角度来说,在药品(不)合格性评价上不能给出似是而非的结论,提供真实可靠的结论是解决纠纷必不可少的条件,故三分法OOS判断的决策规则则很少在药品领域中采用;目前一般均采用二分法决策规则来避免产品在质量合格性判断过程中出现模棱两可的结论。采用二分法决策规则进行合格性判断的文件有ASME、Eurachem/CITAC guide、JCGM和CNAS-CL01-G003,其中ASME最早提出二分法决策规则,即将不确定区域根据生产商风险和消费者风险平衡融入到合格区间或OOS区间中[10-11],如图 2,当将质量标准限值减去警戒区间时,称为严格的接受伴随宽松的拒绝(stringent acceptance is accompanied by relaxed rejection)简称“严格接受”规则(图 2的A部分);当将质量标准限加上警戒区间时,称为宽松的接受伴随严格的拒绝(relaxed acceptance is accompanied by stringent rejection),简称“宽松接受”规则(图 2的B部分)。
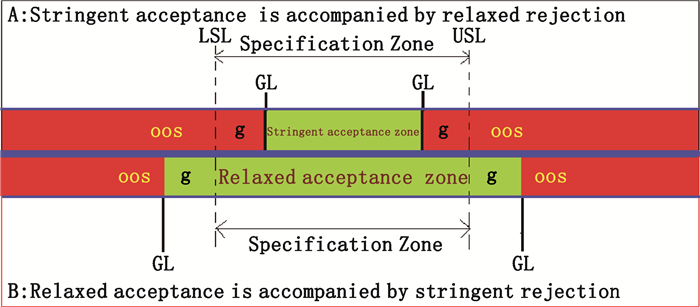
|
图 2 二分法决策规则示意图 Fig.2 Diagram of binary decision rule |
图 2描绘了二分法决策规则的2种情况:以中间(蓝色)粗实线为界,图中A部分是将质量合格区去除警戒区之后所得区间称为“严格接受区间”,除此之外的区域称作“宽松拒绝区(不合格区域)”。宽松拒绝区域在严格接受区域两侧分布。图中B部分是将质量合格区间与警戒区间合并看作一个整体,称作“宽松接受区”,而除此之外的区域称作“严格拒绝区间(不合格区域间)”。严格拒绝区间在宽松接受区间两侧分布。
4 典型实例利用测量不确定度计算警戒区间的方式进行OOS判定,有多种情形,必须结合具体产品进行选择。下面选用与药品检测相关的具有代表性的例子,帮助读者理解OOS判定过程中遇到的决策问题。
假定某新药中规定杂质的高限值USL=60 μg·kg-1,通过前期实验得到其合成标准测量不确定度uc为2.6 μg·kg-1。假定测得该杂质在2批样品中的值分别为55.6 μg·kg-1和62.8 μg·kg-1。试问这2批产品是否为OOS产品。
首先,确定警戒区间:根据g=h·U=h·k·uc,假定按符合质量限的概率为95%,根据表 1其对应的警戒区间校正系数h=0.82,取扩展不确定度的包含因子k=2,则g=0.82×2×2.6=4.264。
其次,确定OOS的判断规则:在研发阶段,应根据药品的毒副作用强弱风险事先制定出OOS的判定规则。若危害性较大,则应该选用严格接受伴随宽松拒绝的方式,即从质量标准限值中扣除警戒区间的“严格接受”方式;若危害性较低(其潜在的毒副作用风险较小),则可选用宽松接受伴随严格拒绝的方式,即从质量标准限值上增加警戒区间的“宽松接受”方式。
第三,确定判定界值并与检测结果进行比较:若药品毒副危害性较强,其判定为OOS的限值为60-4.264=55.736 μg·kg-1,即当检测结果不小于55.736 μg·kg-1时,可判断该产品为不合格产品。由此可判定检测结果为55.6 μg·kg-1的样品批为合格批次,而62.8 μg·kg-1的批次为不合格批次。
若药品危害性较弱或无危害性,则其判定为OOS的限值为60+4.246=64.246 μg·kg-1,即当检测结果不小于64.246 μg·kg-1时,可判断该产品为不合格产品。由此可判定检测结果为55.6 μg·kg-1和62.8 μg·kg-1的2个样品批均为合格批次。如果另有1个样品的测得值67.6 μg·kg-1,则无论在哪种方式下判断,都属不合格产品。
5 目前国内OOS判断中的主要困难从上面的论述中可见,对处于质量限边缘的产品,要科学地判定产品是否为OOS产品,必须事先明确如下3个内容:检测方法的总变异、质量标准限的制定依据和质量符合性的决策规则。然而,在过去一段时间,这些内容一直都是药品行业的瓶颈。
5.1 检测方法的总变异找出方法的总变异对正确判定边缘产品是否为OOS至关重要。这是在方法验证阶段应该给出的参数;但目前ICH Q2(R1)[20]和《中华人民共和国药典》的方法验证指导原则[21]只给出了方法的准确度和精密度,并未进一步说明方法总变异度的计算方式。很多人尚不清楚如何通过方法总变异来确定警戒区间,常使用多次测量结果的均值与质量限进行对比,进行OOS判定(该方式的缺点见“6.1”项下)。随着近年来应用基础研究的深入,这个问题已被解决。建议读者参考美国药典 < 1210 > [22]和《判断定量类理化分析方法满足预期用途的标准探讨》[23]等,明确提出方法变异的计算方法。
5.2 质量标准限的制定依据制定质量标准中各检测属性的限度是一项系统工程,它不仅需要药品专业知识和经验,同时还需要了解工艺和统计等跨学科知识[24]。只有掌握了各种测量不确定度(方法变异、工艺变异和产品稳定性变异)的来源,才能确定出可靠的质量标准控制限。目前国内在制定质量标准时,多凭专家经验,很少依靠实际工艺数据,通过风险分析和统计区间进行确定,这对下一步确定OOS的决策规则带来挑战。
5.3 质量符合性的决策规则判定OOS的第3个困境是没有事先明确给出判定OOS的决策规则是严格型还是宽松型。国内目前OOS的判定方式都直接跟质量限相比较,当遇到边缘产品时,采用多次测量结果的均值与质量限比较,超出该质量限即为OOS。该方式没有充分考虑该检测属性误判导致的全局性生产商风险(global producer’s risk)和全局性消费者风险(global consumer’s risk)[15]。随着国内对产品质量符合性判定规则[16]的引入,相信今后会逐步采用该方式,事先确定OOS的决策规则,从而更好地保证产品质量决策的客观公正性和风险最小化。
6 讨论与结论 6.1 使用加入不确定度方式判定OOS具有明显优势采用测量不确定度的方式对OOS进行判定,相较于过去常采用对边缘产品的重复测量[25]和选择合并计算的方式进行判断,OOS判断可为今后检测结果带来更多便利:(1)它不需要重复多次即可得出准确结论;(2)通过对测量不确定度的研究,可以更全面地了解检测过程,更透彻地理解判定依据等。而使用多次重复测定的判断方式,当遇到边缘产品时,首先未考虑到判定的风险因素,且需要经过多次重复,不仅耗时,而且付出的经济成本也较高。
但采用加入不确定度的方式进行OOS判断,也存在一些困难;其中最关键的是需要首先确定出测量不确定度。这是目前国内在其实施过程中的瓶颈问题。但随着近年来对方法验证研究的深入,相关文献已经有具体的计算方式提供[14, 18, 21, 25-26],相信今后将不会再是OOS判定过程的“拦路虎”。
6.2 建议从法规建立角度尽早制定具有可操作的OOS判定相关决策原则OOS的判断和分析,无论对药品行业中的生产商还是监管部门都非常重要;目前虽然国内外已有相关的理论研究基础和法规[1, 6, 10-11, 13-16, 17-18, 23, 25, 27-29],但国内药品领域,特别是药品生产企业,至今没有很好地应用。建议监管部门能予以重视,尽早组织专家进行研究并确立相关决策原则,并在法规文件中予以体现。
6.3 建议从技术层面上事先确定OOS结果判定的二分法决策规则首先,从法律角度考虑,在药品领域由于司法上不能出现似是而非的结论,故通常都选择二分法原则进行OOS判定。其次,在二分法中选择采用“宽松接受”的方式或“严格拒绝”的方式时,企业应该给出足够的风险分析理由,从错判造成的后果上进行分析来事先给出决策规则,而不是仅从企业自身利益出发,都选择“拒严准宽”的方式。
| [1] |
FDA.Guidance for Industry.Investigating Out-of-Specification(OOS) Test Results for Pharmaceutical Production[S/OL].2006[2019-06-06].http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM070287.pdf
|
| [2] |
HUM-MOLGEN.OOS Investigations in a GMP Environment[EB/OL].2015[2019-06-06].https://hum-molgen.org/meetings/courses/5350.html
|
| [3] |
DOCPLAYER.OOS Forum Invitation.Prague, Czech Republic June 2012 ECA[EB/OL].2012[2019-06-06].https://docplayer.net/34066695-Oos-forum-invitation-prague-czech-republic-june-2012-eca.html
|
| [4] |
药品生产质量管理规范[S/OL].2010[2019-06-06].http://www.gov.cn/gongbao/content/2011/content_1907093.htm Good Manufacturing Practices[S/OL].2010[2019-06-06]. http://www.gov.cn/gongbao/content/2011/content_1907093.htm |
| [5] |
International Standard Organization(ISO)/International Electrotechnical Commission (IEC) 17025: 2005.Accreditation Criteria for the Competence of Testing and Calibration Laboratories[S].2005
|
| [6] |
游赣花, 谭德讲. 药品质量控制过程中OOS分析存在的问题之管见[J]. 中国药事, 2015, 29(10): 58. YOU GH, TAN DJ. Some opinions about OOS investigations in pharmaceutical quality control[J]. Chin Pharm Aff, 2015, 29(10): 58. |
| [7] |
姜伟.药品检验机构OOS调查的关键点分析[C]//中国药学会第二届药物检测质量管理学术研讨会资料汇编.2015 JIANG W.Key points analysis of oos survey of drug testing institutions[C]//Compilation of the 2nd Symposium on Quality Control of Drug Testing in China Pharmaceutical Association.2015 |
| [8] |
周海江, 雷丽娟. 实验室检验与OOS/OOT结果调查分析[J]. 化工管理, 2015(32): 124. ZHOU HJ, LEI LJ. Laboratory testing and analysis of OOS/OOT results[J]. J Chem Prin, 2015(32): 124. DOI:10.3969/j.issn.1008-4800.2015.32.097 |
| [9] |
American National Standards Institute(ANSI).The Expression of Uncertainty in Measurement[S].1993
|
| [10] |
American Society of Mechanical Engineers.ASME B89.7.3.1: 2001 Guidelines for Decision Rules: Considering Measurement Uncertainty, Determining Conformance to Specifications[S].2001
|
| [11] |
American Society of Mechanical Engineers.ASME B89.7.4.1-2005 ASME Measurement Uncertainty and Conformance Testing: Risk Analysis[S].2005
|
| [12] |
International Standard Organization(ISO).Guide to the Expression of Uncertainty in Measurement[S].1995
|
| [13] |
International Standard Organization(ISO).10576_1 Statistical Methods-Guidelines for the Evaluation of Conformity with Specified Requirements[S].2003
|
| [14] |
EURACHEM/CITAC Guide.Use of Uncertainty Information in Compliance Assessment[S/OL].2007[2019-06-06].https://www.eurachem.org/index.php/publications/guides/uncertcompliance
|
| [15] |
Joint Committee for Guides in Metrology (JCGM).Evaluation of Measurement Data-The Role of Measurement Uncertainty in Conformity Assessment[S/OL].2012[2019-06-06].https://www.bipm.org/en/publications/guides/gum
|
| [16] |
中国合格评定国家认可委员会.CNAS-TRL-010: 2019测量不确定度在符合性判定中的应用[S].2019 China National Accreditation Service for Conformity Assessment.CNAS-TRL-010: 2019 Application of the Measurement Uncertainty in the Conformance Test[S].2019 |
| [17] |
International Standard Organization(ISO).14253-1 Geometrical Product Specifications (GPS)-Inspection by Measurement of Workpieces and Measuring Equipment-Part 1: Decision Rule for Proving Conformance or Non-conformance with Specifications[S].1999
|
| [18] |
DESIMONI E, BRUNETTI B.Uncertainty of measurement and conformity assessment: a review[J/OL].Anal Bioanal Chem, 2011, 400(6): 1729[2019-06-06].http://xueshu.baidu.com/usercenter/paper/show?paperid=49a1b54b6e25010cbb8d32a683830168&site=xueshu_se&hitarticle=1
|
| [19] |
International Laboratory Accreditation Cooperation.ILAC-G8-03 Guidelines on Assessment and Reporting of Conformity with Specification[S/OL].2009[2019-06-06].http://www.enao-eth.org/publication_documents/ILAC_G8_03_2009%20Guidelines%20on%20the%20reporting%20of%20compliance%20with%20specification.pdf
|
| [20] |
ICH Guideline.Q2(R1) Validation of Analytical Procedures: Test and Methodology[S].2005
|
| [21] |
中华人民共和国药典2015年版.四部[S].2015: 347 ChP 2015.Vol Ⅳ[S].2015: 347 |
| [22] |
USP 41-NF 36. < 1210 > Statistical Tools for Procedure Validation[S].2018: 7622
|
| [23] |
谭德讲, 朱容蝶, 耿颖, 等. 判断定量类理化分析方法满足预期用途的标准探讨[J]. 药物分析杂志, 2019, 39(2): 196. TAN DJ, ZHU RD, GENG Y, et al. Discussion about the criteria of quantitative physicochemical analytical methods for satisfying their intended use[J]. Chin J Pharm Anal, 2019, 39(2): 196. |
| [24] |
马莉, 杨化新, 谭德讲, 等. 药品质量标准中限度范围确立方式探讨[J]. 中国新药杂志, 2019, 28(5): 523. MA L, YANG HX, TAN DJ, et al. Discussion of establishment of acceptance criteria in drug specification[J]. Chin J New Drugs, 2019, 28(5): 523. |
| [25] |
OMCL Network of the Council of Europe.Quality Management (QM) Documents[S/OL].[2019-06-06].https://www.edqm.eu/quality-management-guidelines-86.html
|
| [26] |
谭德讲, 隋思涟, 朱容蝶, 等. 理化方法验证统计分析软件的设计与功能[J]. 药物分析杂志, 2019, 39(2): 223. TAN DJ, SUI SL, ZHU RD, et al. Design and function of statistical software for the validation of analysis methods[J]. Chin J Pharm Analysis, 2019, 39(2): 223. |
| [27] |
Commission Decision of 12 August 2002 Implementing Council Directive 96/23/EC. Concerning the Performance of Analytical Methods and the Interpretation of Results[S/OL].2002[2019-06-06].http://eurlex.europa.eu/smartapi/cgi/sga_doc?smartapi!celexplus!prod!DocNumber&lg=en&type_doc=Decision&an_doc=2002&nu_doc=657
|
| [28] |
中国合格评定国家认可委员会.CNAS-CL01-G003测量不确定度的要求[S/OL].2019[2019-06-06].https://www.cnas.org.cn/rkgf/sysrk/rkyyzz/2019/04/896483.shtml China National Accreditation Service for Conformity Assessment.CNAS-CL01-G003 Requirements for Measurement Uncertainty[S/OL].2019[2019-06-06].https://www.cnas.org.cn/rkgf/sysrk/rkyyzz/2019/04/896483.shtml |
| [29] |
中国合格评定国家认可委员会.CNAS-GL006化学分析中不确定度的评估指南[S].2019 China National Accreditation Service for Conformity Assessment.CNAS-GL006 Guidance on Quantifying Uncertainty in Chemical Analysis[S].2019 |
 2019, Vol. 39
2019, Vol. 39 
