曲普瑞林(triptorelin)是促性腺激素释放激素的类似物,化学合成的十肽。目前,进口的制剂产品有醋酸曲普瑞林注射液(商品名:达必佳)、注射用醋酸曲普瑞林(商品名:达菲林)、醋酸曲普瑞林缓释注射剂(商品名:达必佳,达菲林)、双羟萘酸曲普瑞林缓释注射剂(商品名:达菲林),国内上市的制剂产品仅有醋酸曲普瑞林注射液,有3家企业的注射用醋酸曲普瑞林微球正在注册。临床用于治疗子宫内膜异位症、良性前列腺增生和性激素依赖的恶性肿瘤等疾病[1]。
2015年版《中华人民共和国药典》收载了醋酸曲普瑞林和醋酸曲普瑞林注射液,缓释注射剂的质量控制主要依据现行的企业注册标准。在杂质控制方面,各企业注册标准中的杂质控制存在差异,其中总杂与单杂控制水平不一,只有部分企业对曲普瑞林游离酸进行控制。目前,曲普瑞林及其制剂中的杂质研究较少,多数单个杂质没有进行结构确证和归属。
本文采用高效液相色谱法与高效液相色谱-线性离子阱串联质谱法(HPLC-LTQ-MS/MS法)对收集到的醋酸曲普瑞林原料药、3种来源的上市及在研缓释注射剂中的杂质进行分离检测与分析。通过对曲普瑞林裂解规律、主成分与辅料相互作用机理、生产工艺分析,推断杂质结构与来源归属。本文对不同生产工艺的曲普瑞林缓释注射剂中的杂质进行了分离鉴定,并对杂质来源进行了归属,为该类制剂杂质控制提供参考与技术支持。
1 仪器与试药Agilent 1260高效液相色谱仪(Agilent公司),Thermo LTQ-Orbitrap高分辨液质联用仪(Thermo Fisher Scientific公司),离心浓缩仪(Thermo Fisher Scientific公司)。
曲普瑞林游离酸(杂质Ⅰ)对照品(批号140797-201101,中国食品药品检定研究院);醋酸曲普瑞林(企业D提供),醋酸曲普瑞林缓释注射剂样品由企业A、B、C提供。三乙胺、磷酸(分析纯,国药集团化药试剂有限公司),乙腈、正丙醇(色谱纯,Fisher Scientific公司),二氯甲烷(分析纯,北京化工厂)。
2 分析方法 2.1 HPLC分析方法 2.1.1 色谱条件采用XBridge® Peptide BEH C18色谱柱(4.6 mm×250 nm,3.5 μm,300 Å),磷酸-三乙胺缓冲液及乙腈-正丙醇为流动相体系(称取三乙胺15.2 mg,加入超纯水800 mL,以磷酸调节pH至3.0,加水定容至1 000 mL,即得磷酸-三乙胺缓冲液;量取上述缓冲液850 mL,再量取乙腈-正丙醇(3:2)150 mL,混合均匀,过滤脱气,即得),流速1 mL·min-1,柱温35 ℃,检测波长210 nm,进样器温度5 ℃,进样量100 μL(收集杂质)、20 μL(杂质测定和比较),运行时间100 min。
2.1.2 样品溶液的制备精密称取醋酸曲普瑞林10 mg,加水溶解并定容至10 mL,混匀,制成1 mg·mL-1的原料药样品溶液,用于原料药杂质的检测。精密称取醋酸曲普瑞林缓释注射剂样品适量(根据载药量计算,使含曲普瑞林约1 mg),加入二氯甲烷1 mL,振摇1 min,再加入磷酸-三乙胺缓冲液1 mL,涡旋5 min,3 000 r·min-1离心5 min,取上清液(约含曲普瑞林1 mg·mL-1),即得缓释制剂样品溶液,用于缓释制剂杂质的检测。精密称取曲普瑞林游离酸(杂质Ⅰ)对照品2 mg,用2 mL水溶解、混匀,制成1 mg·mL-1的溶液,取该溶液与原料药样品溶液各1 mL,混匀,即得原料药与杂质Ⅰ混合样品溶液,用于曲普瑞林游离酸的定位。
2.2 LC-MS/MS分析方法 2.2.1 LC-MS/MS条件采用Kromasil C18预柱(2.1 mm),柱温30 ℃,检测波长210 nm,纯水(含0.05%甲酸)为流动相A,甲醇为流动相B,梯度洗脱[0~10 min,100%A,不进质谱(此步骤目的为脱盐);10~20 min,100%B,进质谱;20~30 min,100%A,不进质谱],流速0.2 mL·min-1;电喷雾电离源(ESI),正离子模式,扫描范围m/z 150~1 500,毛细管电压35 V,毛细管温度275 ℃,喷雾电压4 kV,鞘气流速35 arb,辅助气流速10 arb。
2.2.2 杂质供试溶液的制备取样品溶液进样100 μL,手动收集每个杂质峰溶液于2 mL EP管中,将收集得到的杂质峰溶液用离心浓缩仪浓缩(转速为3 000 r·min-1,温度4 ℃,时间为6 h),除去流动相中的乙腈得到杂质浓缩干燥品;加入200 μL超纯水溶解该杂质浓缩干燥品,即得。
3 结果与讨论曲普瑞林是人工合成的十肽,合成方法有固相合成与液相合成2种,本文中研究用原料药来源为固相合成,推测其含有曲普瑞林光学异构体、缺失肽、插入肽、未反应的起始肽段等工艺杂质,和氧化杂质、还原杂质、开环杂质等降解杂质。曲普瑞林缓释制剂采用聚乳酸乙醇酸[poly(D,L-lactide-co-glycolide),PLGA]作为载体辅料,制备工艺有相分离法、乳化挥发法、热熔挤出冷冻粉碎法。该制剂系指药物溶解或分散在载体辅料PLGA中而形成的微粒分散体系,微粒(微球)内部具有空隙,缓释机制与聚合物骨架在释放基质中的降解有关。药物缓释分为3个阶段:微球表面药物溶解释放的突释阶段;微球内部的药物从球体空隙扩散出来的扩散阶段;PLGA降解加快,药物从微球中快速释放出来的溶蚀阶段。PLGA是一种可降解高分子,降解后产生酸性低聚物或者乳酸、乙醇酸单体,且具有酸催化效应[2]。推测该制剂除含有来自原料药的杂质外,还包含曲普瑞林与辅料PLGA作用形成的酰化杂质,这类杂质主要是由肽链中的伯氨基、丝氨酸等氨基酸的羟基与PLGA的羧基末端经过化学反应生成[3]。
3.1 HPLC分析本文HPLC分析方法是在《中华人民共和国药典》2015年版二部醋酸曲普瑞林有关物质测定项下方法的基础上进行了优化,改变了缓冲盐浓度、有机相组分及比例,使杂质分离更好。
3.1.1 醋酸曲普瑞林杂质检测取原料药样品溶液及原料药与杂质Ⅰ混合样品溶液,按照“2.1.1”项色谱条件进样分析。
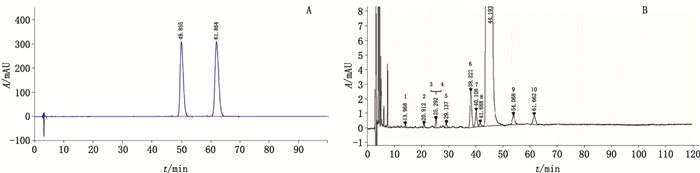
在原料药与杂质Ⅰ混合样品溶液色谱图(图 1-A)中,曲普瑞林游离酸与曲普瑞林相对保留时间为1.24;在原料药样品溶液色谱图(图 1-B)中主要有10个有关杂质峰,主峰与邻近杂质峰8分离度大于1.5,该液相方法分离度良好。杂质峰9为曲普瑞林游离酸。
|
图 1 原料药与杂质Ⅰ混合样品溶液(A)和原料药样品溶液(B)HPLC色谱图 Fig.1 HPLC chromatograms of mixed sample solution of triptorelin acetate and its free acid(A) and sample solution of triptorelin acetate(B) |
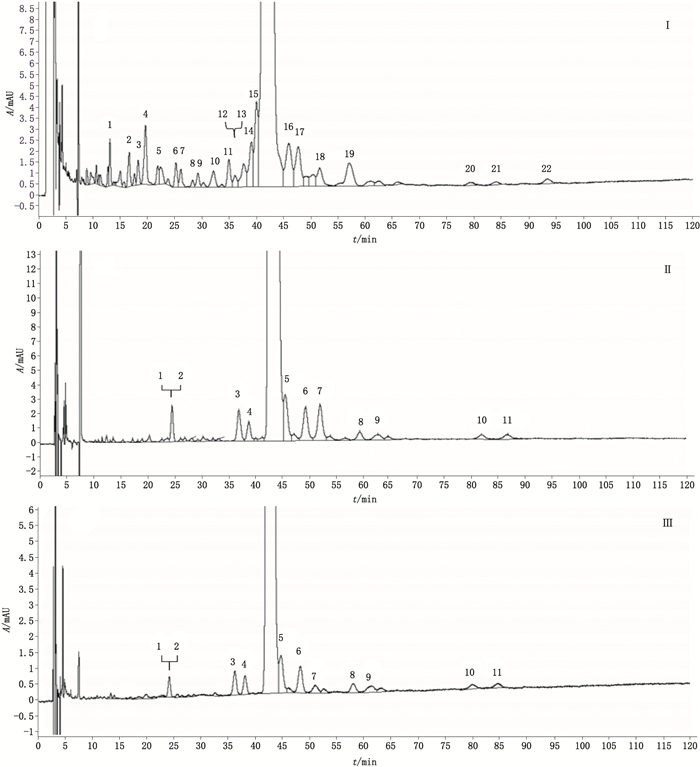
取缓释制剂样品溶液,按照“2.1.1”项色谱条件进样分析。企业A、B、C的样品的HPLC色谱图分别见图 2-Ⅰ~Ⅲ。企业A的样品中主要有22个杂质峰,按面积归一化法计算总有关物质含量为3.46%;企业B和企业C的样品均有11个杂质峰,按面积归一化法计算总有关物质含量分别为2.42%和2.23%。企业A的样品杂质种类多,含量高;企业B和企业C的样品杂质种类相同,含量相近。
|
图 2 企业A(Ⅰ)、B(Ⅱ)、C(Ⅲ)的醋酸曲普瑞林缓释注射剂样品HPLC色谱图 Fig.2 HPLC chromatograms of the sustained-release injection of triptorelin acetate samples from enterprises A(Ⅰ), B(Ⅱ) and C(Ⅲ) |
取原料药样品溶液及原料药杂质供试溶液,按照“2.2.1”项LC-MS/MS条件进样分析。
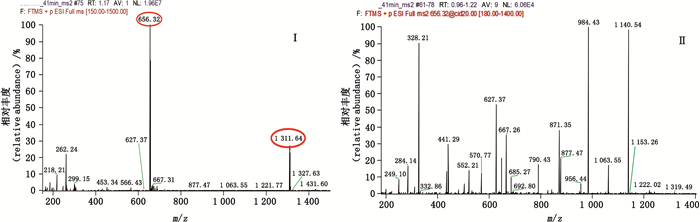
曲普瑞林氨基酸序列见图 3,一级和二级质谱图分别见图 4-Ⅰ、Ⅱ,由质谱图信息得到曲普瑞林各碎片对应的m/z(见表 1)。
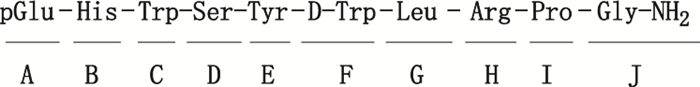
|
图 3 曲普瑞林氨基酸序列 Fig.3 Structural fragments of triptorelin |
|
图 4 曲普瑞林一级(Ⅰ)、二级(Ⅱ)质谱图 Fig.4 Primary(Ⅰ) and secondary(Ⅱ) mass spectra of triptorelin |
|
|
表 1 曲普瑞林二级质谱的主要碎片归属 Tab.1 Major fragment attribution in secondary mass spectrometry of triptorelin |
根据杂质与曲普瑞林相对分子质量的差值,以及杂质二级质谱的主要碎片信息,对醋酸曲普瑞林中的杂质进行了结构确证和来源归属,杂质谱见表 2。10种杂质中工艺杂质包括1种缺失肽(去pGlu曲普瑞林),4种光学异构体,降解杂质包括3种氧化杂质(D-Trp6氧化、Tyr5氧化、Trp3氧化曲普瑞林),1种还原杂质(曲普瑞林游离酸),1种酯化杂质(乙酸化曲普瑞林)。
|
|
表 2 醋酸曲普瑞林杂质谱 Tab.2 Impurity profile of triptorelin |
取醋酸曲普瑞林缓释注射剂杂质供试溶液,按照“2.2.1”项LC-MS/MS条件进样分析。并对醋酸曲普瑞林缓释注射剂样品中的杂质结构确证和来源进行归属,企业A的样品杂质谱见表 3,企业B及企业C的样品杂质谱见表 4,其中乙醇酸曲普瑞林、双乙醇酸曲普瑞林、3种不同构象的双乳酸曲普瑞林总离子流图、一级与二级质谱图分别见图 5~7。
|
|
表 3 企业A醋酸曲普瑞林缓释注射剂杂质谱 Tab.3 Impurity profile of the sustained-release injection of triptorelin acetate from enterprise A |
|
|
表 4 企业B、企业C醋酸曲普瑞林缓释注射剂杂质谱 Tab.4 Impurity profile of the sustained-release injection of triptorelin acetate from enterprises B and C |
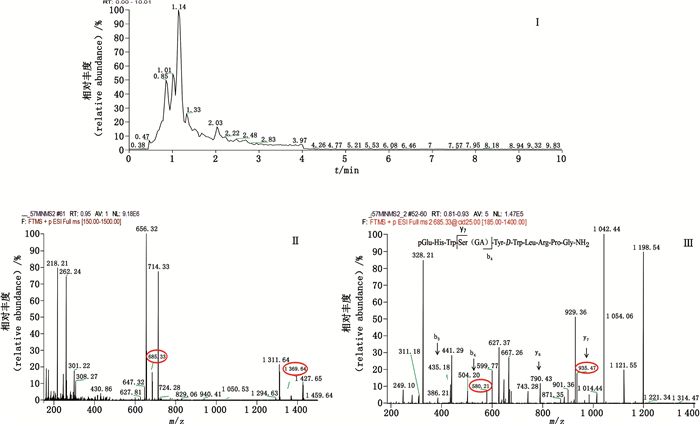
|
图 5 乙醇酸曲普瑞林总离子流图(Ⅰ)、一级(Ⅱ)、二级(Ⅲ)质谱图 Fig.5 Total ion flow chromatogram(Ⅰ) and primary(Ⅱ) and secondary(Ⅲ) mass spectra of glycoyl-conjugated triptorelin |
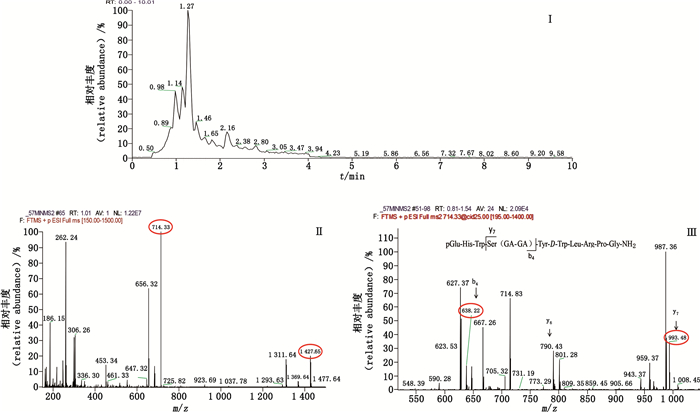
|
图 6 双乙醇酸曲普瑞林总离子流图(Ⅰ)、一级(Ⅱ)、二级(Ⅲ)质谱图 Fig.6 Total ion flow chromatogram(Ⅰ) and primary(Ⅱ) and secondary(Ⅲ) mass spectra of diglycoyl-conjugated triptorelin |
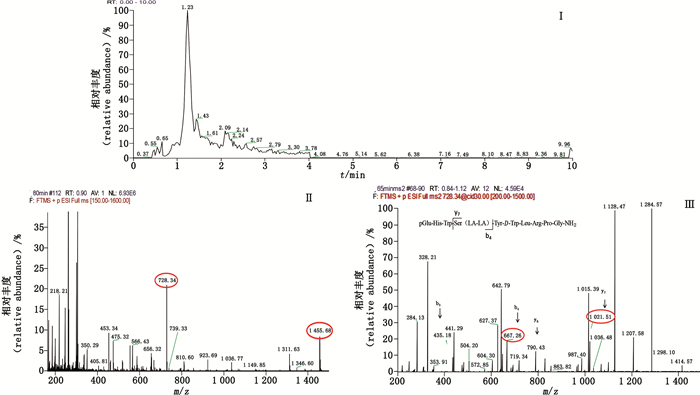
|
图 7 双乳酸曲普瑞林总离子流图(Ⅰ)、一级(Ⅱ)、二级(Ⅲ)质谱图 Fig.7 Total ion flow chromatogram(Ⅰ) and primary(Ⅱ) and secondary(Ⅲ) mass spectra of dilactoyl-conjugated triptorelin |
企业A样品主要有22种杂质,工艺杂质包括2种缺失肽(去PGlu-His-Trp、去脯氨酸曲普瑞林),1种插入肽(多甘氨酸曲普瑞林),2种光学异构体,降解杂质包括10种氧化杂质,6种酰化杂质,1种还原杂质。其中乙醇酸曲普瑞林、双乙醇酸曲普瑞林、3种不同构象的双乳酸曲普瑞林是曲普瑞林与辅料PLGA作用生成的酰化杂质,酰化位点为肽链4位丝氨酸残基上游离的羟基。
企业B和企业C样品中杂质种类完全相同,仅在各杂质含量上有所差异。可检出的11种杂质中,工艺杂质包括1种缺失肽(去pGlu曲普瑞林),2种光学异构体,降解杂质包括1种氧化杂质(Trp3氧化曲普瑞林),5种酰化杂质,1种还原杂质(曲普瑞林游离酸),还有1种未知杂质。其中乙醇酸曲普瑞林、双乙醇酸曲普瑞林、2种不同构象的双乳酸曲普瑞林是曲普瑞林与辅料PLGA作用生成的酰化杂质,酰化位点为肽链4位丝氨酸残基上游离的羟基。杂质G、GG、LL1、LL2是3家企业的共有杂质,面积归一化法得到含量分别为0.96%、0.96%、1.01%。
企业A与企业B和企业C差异较大,企业A样品中杂质种类数量是企业B和企业C样品中的2倍,其中氧化杂质多了9个,推测是由于企业A样品制剂工艺为热熔挤压冷冻粉碎法,该方法的热熔过程温度较高,促进了氧化杂质的生成。企业B和企业C的制剂生产工艺均为乳化挥发法,氧化杂质的生成较少,且杂质种类和水平基本相同。
4 小结本文采用HPLC法对醋酸曲普瑞林及3种缓释注射剂样品中的杂质进行了分离检测,采用HPLC-LTQ-MS/MS法对未知杂质进行了结构确证。
缓释注射制剂样品中均存在曲普瑞林与辅料PLGA相互作用生成的酰化杂质,包括乙醇酸曲普瑞林、双乙醇酸曲普瑞林、不同构象的双乳酸曲普瑞林,采用热熔挤压冷冻粉碎工艺制成的样品易产生这些降解杂质。多肽与PLGA辅料的结合物会对多肽产生不利的影响,比如活性丧失、结构改变、受体结合障碍或改变免疫原性等[4-5]。据文献报道[6],聚乙醇酸化艾塞那肽混合物与艾塞那肽有相似的降血糖效果,提示肽类的酰化杂质具有活性。企业A、B、C样品中酰化杂质含量均达到了1.0%,对酰化杂质进行药理活性研究,为合理地制定该类杂质的质控限度具有重要意义。因此,课题组委托企业合成了乙醇酸曲普瑞林、双乙醇酸曲普瑞林、乙酸化曲普瑞林,并进行了体内外活性研究,结果表明均具有与曲普瑞林相似的药理活性(另文待发表)。
研究表明,多肽的N-末端和赖氨酸侧链残基易与PLGA发生酰化反应[7]。曲普瑞林肽链中丝氨酸、酪氨酸、精氨酸、N-末端残基均含有亲核基团,结果表明制剂中均含有曲普瑞林与乙酸、乙醇酸、双乙醇酸、双乳酸反应生成的乙酰化曲普瑞林,反应位点均为肽链4位丝氨酸残基上游离的羟基,通过酯键连接。根据文献报道[8],多肽中的亲核基团能够与高聚物(如PLGA、PLA)中酯键上的亲电基团-羰基发生亲核反应,形成多肽-高聚物产物,多肽-高聚物中的高聚物水解,生成酰化杂质。在水存在时,以PLGA或PLA为辅料的微球给药系统发生显著的环境变化,聚合物主链中的聚酯基团水解,曲普瑞林在微酸环境下捕获水解中释放的乳酸和乙醇酸单体[9]。由此提示,应关注醋酸曲普瑞林缓释注射剂水分含量及贮存过程中环境湿度对降解杂质产生的影响。
致谢: 衷心感谢张琪副研究员在中国食品药品检定研究院时对本课题完成给予的技术帮助!
| [1] |
SCHALLY AV, COMARUSCHALLY AM, NAGY A, et al. Hypothalamic hormones and cancer[J]. Front Neuroendocrinol, 2001, 22(4): 248. DOI:10.1006/frne.2001.0217 |
| [2] |
王明波, 冯庆玲, 佘振定, 等. PLGA微球包埋药物的稳定性及释放研究的新进展[J]. 功能材料, 2011, 42(S4): 591. WANG MB, FENG QL, SHE ZD, et al. Latest research progress of drug stability and release of PLGA microspheres[J]. J Funct Mater, 2011, 42(S4): 591. |
| [3] |
郭宁子, 辛中帅, 杨化新. 微球制剂质量控制研究进展[J]. 中国新药杂志, 2015, 24(18): 2115. GUO NZ, XIN ZS, YANG HX. Research progress in quality control of microspheres[J]. Chin J New Drugs, 2015, 24(18): 2115. |
| [4] |
NA DH, LEE J E, JANG SW, et al. Formation of acylated growth hormone-releasing peptide-6 by poly(lactide-co-glycolide) and its biological activity[J]. AAPS PharmSciTech, 2007, 8(2): Article 43. |
| [5] |
van de WEERT M, HENNINK WE, JISKOOT W. Protein instability in poly(lactic-co-glycolic acid) microparticles[J]. Pharm Res, 2000, 17(10): 1159. DOI:10.1023/A:1026498209874 |
| [6] |
LIANG R, LI X, ZHANG R, et al. Acylation of exenatide by glycolic acid and its anti-diabetic activities in db/db mice[J]. Pharm Res, 2014, 31(8): 1958. DOI:10.1007/s11095-014-1298-2 |
| [7] |
GUO NZ, ZHANG Q, SUN Y, et al. Separation and identification of acylated leuprorelin inside PLGA microspheres[J]. Int J Pharm, 2019, 560(5): 273. |
| [8] |
LUCKE A, KIERMAIER J, GÖPFERICH A. Peptide acylation by poly(alpha-hydroxy esters)[J]. Pharm Res, 2002, 19(2): 175. DOI:10.1023/A:1014272816454 |
| [9] |
FU K, PACK DW, KLIBANOV AM, et al. Visual evidence of acidic environment within degrading poly(lactic-co-glycolic acid)(PLGA)microspheres[J]. Pharm Res, 2000, 17(1): 100. DOI:10.1023/A:1007582911958 |
 2019, Vol. 39
2019, Vol. 39 
