2. 中国食品药品检定研究院, 北京 100050;
3. 贵阳中医学院, 贵阳 550000
2. Naltional Institutes for Food and Drug Control, Beijing 10050, China;
3. Guiyang College of Traditional Chinese Medicine, Guiyang 550000, China
坤泰胶囊收载于《中华人民共和国药典》2015年版第一增补本,为贵阳新天药业股份有限公司上市产品,具有滋阴清热、安神除烦之功效,用于治疗绝经期前后诸证,阴虚火旺者,症见潮热面红、自汗盗汗、心烦不宁、失眠多梦、头晕耳鸣、腰膝酸软、手足心热;妇女卵巢功能衰退更年期综合征见上述表现者。坤泰胶囊由熟地黄、黄连、白芍、黄芩、阿胶、茯苓六味药组成,富含黄酮类(黄芩苷、黄芩素等)、生物碱类(盐酸巴马汀、盐酸小檗碱等)和多酚类(没食子酸等)等多种成分[1],这些成分具有显著的抗炎、消肿、抗菌活性,但现行质量标准只规定了其中盐酸小檗碱的含量测定,其他成分均为TLC定性鉴别,不能全面反映药品的质量。中药特征图谱是1种可综合反映中药制剂内在整体质量的分析方法,目前已在中药质量控制方面广泛运用。为了更方便有效地控制药品的质量,本文建立了坤泰胶囊特征图谱,并建立了可同时测定没食子酸、芍药苷、黄芩素、黄芩苷、盐酸巴马汀、盐酸小檗碱6个成分含量的HPLC法,色谱峰分离度较好,为其质量控制提供参考依据。
1 仪器与材料 1.1 仪器高效液相色谱仪(Alliance E2695,Waters),检测器(2998 PDA Detector,Waters),色谱柱(Amethyst C18-H(4.6 mm×250 mm,5 µm,120Å),数控超声波清洗器(KQ-500DA,昆山市超声仪器有限公司),电子天平(AE240,Mettler Toledo)。
1.2 材料坤泰胶囊[批号分别为170205(S1)、170403(S2)、170407(S3)、170802(S4)、170808(S5)、170811(S6)、170818(S7)、170907(S8)、170912(S9)、170915(S10)、171014(S11)、171015(S12)、171020(S13)、180103(S14)、180105(S15)、180113(S16)、180125(S17)],贵阳新天药业股份有限公司生产;对照品没食子酸(批号110831-201204,含量89.9%)、芍药苷(批号110736-201337,含量94.9%)、黄芩素(批号111595-200905,含量98.5%)、黄芩苷(批号110715-201318,含量93.3%)、盐酸巴马汀(批号110732-200907,含量86.1%)、盐酸小檗碱(批号110713-201613,含量86.8%)],购自中国食品药品检定研究院;药材饮片均购于黔东南州药材公司,由黔东南州食品药品检验检测中心杨鑫副主任药师鉴定为熟地黄(Rehmanniae Radix Praeparata)、黄连(Coptidis Rhizoma)、白芍(Paeoniae Radix Alba)、黄芩(Scutellariae Radix)、阿胶(Asini Corii Colla)、茯苓(Poria);乙腈(色谱纯,Honeywell公司);磷酸(优级纯,天津市科密欧化学试剂有限公司);甲醇(分析纯,国药集团化学试剂有限公司);纯净水(贵阳娃哈哈饮料有限公司)。
2 方法与结果 2.1 色谱条件色谱柱:Amethyst C18-H(4.6 mm×250 mm,5 µm,120 Å);流动相:乙腈(A)-0.4%磷酸水溶液(B),梯度洗脱(0~10 min,4%A;10~20 min,4%A→16%A;20~30 min,16%A→6%A;30~45 min,6%A→13%A;45~80 min,13%A→30%A;80~100 min,30%A→42%A;100~115 min,42%A→55%A;115~116 min,55%A→4%A;116~125 min,4%A);流速:1.0 mL·min-1;检测波长:230 nm;柱温:25 ℃;进样量:10 μL。
2.2 溶液的制备 2.2.1 对照品溶液取对照品没食子酸、芍药苷、黄芩素、黄芩苷、酸盐巴马汀、盐酸小檗碱适量,加甲醇制成每1 mL分别含没食子酸0.365 0 mg、芍药苷0.711 8 mg、黄芩素0.550 0 mg、黄芩苷0.600 9 mg、酸盐巴马汀1.041 6 mg、盐酸小檗碱0.469 2 mg的对照品储备液。分别精密吸取各对照品储备液适量,配制成每1 mL含没食子酸0.021 9 mg、芍药苷0.142 4 mg、黄芩素0.033 0 mg、黄芪苷0.192 2 mg、盐酸巴马汀0.056 3 mg、盐酸小檗碱0.250 0 mg的混合对照品溶液。
2.2.2 供试品溶液取本品内容物10粒,混匀,取约0.5 g,精密称定,置烧瓶中,加甲醇25 mL,称量,超声处理(功率250 W,频率100 kHz)30 min,放冷,加甲醇补足减失的量,摇匀。用0.45 μm的微孔滤膜滤过,取续滤液,即得。
2.2.3 阴性溶液按处方和生产工艺分别制备不含白芍、黄芩、黄连的3种阴性样品,按“2.2.2”项下方法制备阴性溶液。
2.3 系统适用性试验分别吸取“2.2”项下的混合对照品溶液、供试品溶液、阴性溶液各10 µL,注入HPLC色谱仪,在“2.1”项色谱条件下测定,记录色谱图。在上述色谱条件下,供试品溶液与对照品溶液对应的吸收峰理论塔板数均大于3 000,对应色谱峰的分离度均大于1.5,阴性对照溶液无干扰。色谱图见图 1。
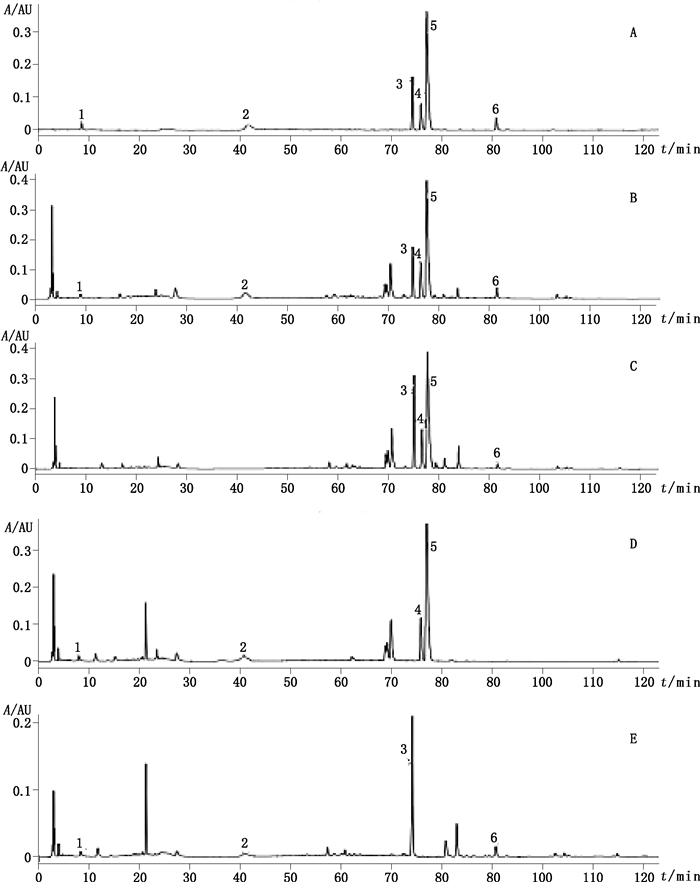
|
1.没食子酸(gallic acid)2.芍药苷(paeoniflorin)3.黄芩苷(baicalin)4.巴马汀(palmatine)5.小檗碱(berberine)6.黄芩素(baicalein)A.对照品(reference substance)B.样品(sample)C.缺白芍阴性样品(negative sample without Paeoniae Radix Alba)D.缺黄芩阴性样品(negative sample without Scutell Radix)E.缺黄连阴性样品(blank sample wihout Coptidis Rhizoma) 图 1 HPLC色谱图 Fig.1 HPLC chromatograms |
精密量取“2.2.1”项下的对照品储备液,分别用甲醇稀释成6个浓度梯度的溶液(没食子酸:0.003 6、0.009 1、0.014 6、0.021 9、0.029 2、0.043 8 mg·mL-1,芍药苷:0.028 5、0.071 2、0.142 3、0.195 7、0.249 2、0.355 9 mg·mL-1,黄芩素:0.005 5、0.011 0、0.022 0、0.033 0、0.044 0、0.066 0 mg·mL-1,黄芪苷:0.060 8、0.120 2、0.180 3、0.240 3、0.360 5、0.480 7 mg·mL-1,盐酸巴马汀:0.009 4、0.023 5、0.046 9、0.070 4、0.093 8、0.140 8 mg·mL-1,盐酸小檗碱:0.052 1、0.104 2、0.156 2、0.260 4、0.416 4、0.520 8 mg·mL-1)。按“2.1”项下色谱条件测定,记录峰面积,以峰面积(Y)对浓度(X)进行回归分析,得没食子酸、芍药苷、黄芩素、黄芩苷、盐酸巴马汀、盐酸小檗碱的回归方程,用对照品溶液逐步稀释后测定检测下限,结果见表 1,表明各成分在各自范围内呈良好的线性关系。
|
|
表 1 各成分线性关系 Tab.1 Linearity of each component |
取“2.2.1”项下混合对照品溶液,按“2.1”项下色谱条件,连续进样6次测定,没食子酸、芍药苷、黄芩素、黄芩苷、盐酸巴马汀、盐酸小檗碱峰面积的RSD分别为0.32%、0.81%、0.27%、0.38%、0.54%、0.24%,表明该仪器精密度良好。
2.6 稳定性试验精密称取样品(编号S17)约0.5 g,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件,分别在0、2、4、8、12、24 h进样测定,没食子酸、芍药苷、黄芩素、黄芩苷、盐酸巴马汀、盐酸小檗碱峰面积的RSD分别为1.3%、1.9%、1.0%、1.5%、1.7%、1.0%,表明供试品溶液在24 h内稳定性良好。
2.7 重复性试验精密称取样品(编号S17)约0.5 g,平行6份,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积,计算含量,没食子酸、芍药苷、黄芩素、黄芩苷、盐酸巴马汀、盐酸小檗碱含量分别为0.933 2、8.294 1、2.510 0、17.572 3、3.213 8、12.486 6 mg·g-1,RSD分别为1.2%、1.8%、0.85%、1.3%、1.6%、0.90%。表明该方法重复性良好。
2.8 加样回收试验精密称取样品(编号S17)约0.25 g,平行6份,分别加入各成分对照品适量,使比例约为1:1,按“2.2.2”项下方法制备供试溶液,按“2.1”项下色谱条件进样,记录峰面积,计算回收率,结果见表 2。
|
|
表 2 加样回收率试验结果(n=6) Tab.2 Results of recovery tests |
分别精密称取17批样品约0.5 g,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,记录峰面积,计算含量,结果见表 3。
|
|
表 3 各成分含有量测定结果(mg·g-1,n=3) Tab.3 Content determination results of each component |
应用SPSS18.0统计分析软件中系统聚类法中的离差平方和法(Ward’s method),对17批HPLC法测定的坤泰胶囊各成分含量进行分析,并综合系统聚类分析,绘出树状图,结果如图 2所示。17批样品大致可分为2类,其中批次S1、S2、S3、S4、S8、S9、S11、S12、S13、S16归为一类,批次S5、S6、S7、S10、S14、、S15、S17归为另一类,不同批次的坤泰胶囊的质量基本稳定,但部分共有峰所含有的化学成分含量还是存在一定的差异。
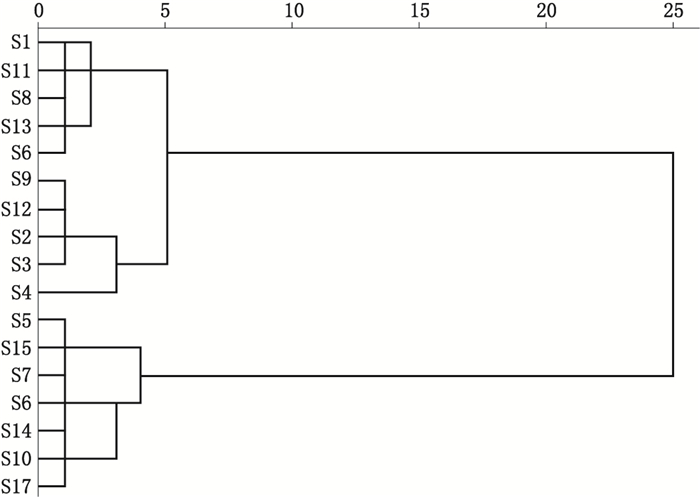
|
图 2 聚类分析结果树状图 Fig.2 Tree diagram of clustering analysis |
在特征图谱中,小檗碱分离度较好,峰面积大,是黄连中的活性成分,有抗菌、抗炎、解热等多种作用[5],故选择其作为参照峰。
2.11.4 精密度试验精密称取样品(编号S17)约0.5 g,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样6次,以小檗碱为参照峰,测得各共有峰的相对峰面积RSD均小于4.8%。应用2012版中药色谱指纹图谱相似度评价软件进行分析,测得色谱图之间的相似度为1,符合相关要求。
2.11.5 稳定性试验精密称取样品(编号S17)约0.5 g,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件于0、2、4、8、12、24h进样测定,以小檗碱为参照峰,测得各共有峰相对峰面积的RSD均小于4.6%。应用2012版中药色谱指纹图谱相似度评价软件进行分析,测得色谱图之间的相似度为1,表明溶液在24 h内稳定性良好,符合相关要求。
2.11.6 重复性试验精密称取样品(编号S17)约0.5 g,平行6份,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,以小檗碱为参照峰,测得各共有峰相对峰面积的RSD均小于1.9%。应用2012版中药色谱指纹图谱相似度评价软件进行分析,测得色谱图之间的相似度为1,符合相关要求。
2.11.7 建立方法按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,导入2012版中药色谱指纹图谱相似度评价软件。选取S1作为参照图谱,时间窗设为1,生成对照特征图谱(图 3),17批样品的HPLC特征图谱见图 3。共确定了21个共有峰,其中1号峰为没食子酸、7号峰为芍药苷、13号峰为黄芩苷、14号峰为巴马汀、15号峰为小檗碱、19号峰为黄芩素。以盐酸小檗碱为参照峰,计算各共有峰的相对保留时间,结果见表 4;计算各共有峰的相对峰面积,结果见表 5;再采用中位数法计算17批样品与对照特征图谱的相似度,结果见表 6。
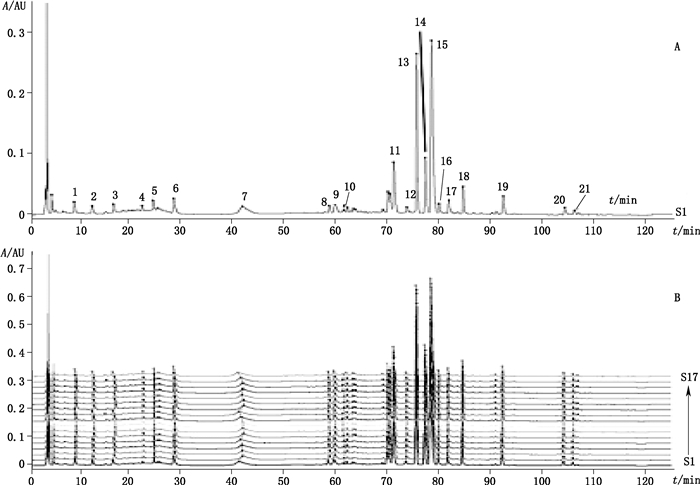
|
A.共有峰(common peaks)B.叠加图谱(overlay chromatograms) 图 3 HPLC特征图谱 Fig.3 HPLC characteristic chromatograms |
|
|
表 4 共有峰相对保留时间 Tab.4 Relative retention time of common peaks |
|
|
表 5 共有峰相对峰面积 Tab.5 Relative area of common peaks |
|
|
表 6 17批样品相似度 Tab.6 Similarities of 17 batches of samples |
参照《中华人民共和国药典》及相关文献报道[6-14],根据坤泰胶囊处方中6味药材主要成分及各成分性质,考察了腺苷、鸟苷、没食子酸、芍药苷、毛蕊花糖苷、梓醇、盐酸小檗碱、盐酸巴马汀、黄芩素、黄芪苷,发现腺苷、鸟苷不易分离,毛蕊花糖苷、梓醇含量太低,最终选择没食子酸、芍药苷、黄芩素、黄芩苷、盐酸巴马汀、盐酸小檗碱作为含量测定的指标成分。
3.2 色谱条件选择 3.2.1 流动相考察了甲醇-0.1%磷酸水溶液、甲醇-0.5%磷酸水溶液、乙腈-0.1%的磷酸水溶液、乙腈-0.4%的磷酸水溶液等度和梯度洗脱,发现乙腈-0.4%的磷酸水溶液梯度作为流动相,目标色谱峰峰形和分离度较好,基线平稳,故作为流动相。
3.2.2 检测波长采用Waters高效液相色谱仪进行全波长扫描,结合《中华人民共和国药典》及相关文献报道,并考虑方法简便性,发现230 nm检测波长处各目标色谱峰均有较好吸收,且峰形和分离度较好,故选择230 nm作为检测波长。
3.3 提取溶剂、提取方法与时间的考察参考文献,本实验用不同浓度的甲醇、乙醇作为溶剂进行提取,结果甲醇的提取相对较好,所以最终选择甲醇作为提取溶剂。分别考察了超声、回流、冷浸的提取方法,结果差别不大,由于超声方便快速,所以采用超声提取。超声时间分别考察了20、30、40、60 min,结果30 min与40 min的提取结果相差不大,最终确定提取时间为30 min。
3.4 17批坤泰胶囊各成分含量分析根据聚类分析树状图,17批样品的质量总体是稳定的,分成的两类(S1、S2、S3、S4、S8、S9、S11、S12、S13、S16一类,其他7个批次样品的另一类),是因部分共有峰所含有的化学成分含量存在差异,不同产地的药材受其品种来源、生存环境、采摘时间、加工和存贮等因素影响,均可能影响药材质量,特别是白芍药材的前处理和加工硫磺的熏蒸多少、均匀性对芍药苷成分的影响很大。因此,要保证中药的质量,应对其每个生产环节提出更高的要求,从原药材到中间体提取物,再到成品的质量控制都应做到可靠并可追溯。
3.5 特征图谱本实验通过HPLC同时测定坤泰胶囊中6个成分的色谱条件进行指纹图谱研究,对17批样品图谱应用2012版中药色谱指纹图谱相似度评价软件进行分析,通过精密度、稳定性和重复性试验,得到21个共有峰且相似度均不低于0.990,同时也确认了没食子酸、芍药苷、黄芩素、黄芩苷、巴马汀、小檗碱6个成分。
3.6 结论综上所述,本实验建立坤泰胶囊的特征图谱,分离得到21个共有峰,通过与对照品对比,指认其中6个成分。17批制剂的相似度大于0.990,相似度高,特征图谱能较全面地反映制剂中的整体成分状况;建立同时测定没食子酸、芍药苷、黄芩素、黄芩苷、盐酸巴马汀、盐酸小檗碱6个成分含量的HPLC法,为坤泰胶囊的质量控制奠定了研究基础。
| [1] |
李定祥, 王珍, 罗建光, 等. 坤泰胶囊化学成分的MC-ESC-MS/MS分析[J]. 中国实验方剂学杂志, 2017, 23(19): 90. LI DX, WANG Z, LUO JG, et al. MC-ESC-MS/MS analysis of chemical components of Kuntai capsules[J]. Chin J Exp Tradit Med Form, 2017, 23(19): 90. |
| [2] |
胡安青. RP-HPLC法测定坤泰胶囊中黄芩苷的含量[J]. 齐鲁药事, 2010, 29(1): 14. HU AQ. RP-HPLC method for the determination of baicalin in Kuntai capsules[J]. Qilu Pharm, 2010, 29(1): 14. |
| [3] |
杨燕飞. RP-HPLC同时测定坤泰胶囊中芍药苷、黄芩苷、盐酸巴马汀、盐酸小檗碱含量[J]. 中成药, 2010, 32(6): 958. YANG YF. RP-HPLC simultaneous determination of paeoniflorin, baicalin, bamatine hydrochloride and berberine hydrochloride in Kuntai capsules[J]. Chin Tradit Pat Med, 2010, 32(6): 958. DOI:10.3969/j.issn.1001-1528.2010.06.020 |
| [4] |
李浩飞. RP-HPLC波长切换法同时测定坤泰胶囊中6个成分的含量[J]. 中国当代医药, 2015, 22(26): 7. LI HF. RP-HPLC wavelength switching method for simultaneous determination of the content of 6 components in Kuntai capsules[J]. Chin Contemp Med, 2015, 22(26): 7. |
| [5] |
盖晓红, 刘素香, 任涛, 等. 黄连的化学成分及药理作用研究进展[J]. 中草药, 2018, 49(20): 4919. GAI XH, LIU SX, REN T, et al. Progress in the study of chemical composition and pharmacological effects of Coptidis Rhizoma[J]. Chin Tradit Herb Drugs, 2018, 49(20): 4919. DOI:10.7501/j.issn.0253-2670.2018.20.032 |
| [6] |
中华人民共和国药典2015年版.一部[S].2015: 106, 301, 303 ChP 2015.Vol Ⅰ[S].2015: 106, 301, 303 |
| [7] |
张波泳, 江振作, 王跃飞, 等. UPLC/ESI-Q-TOP MS法分析鲜地黄、生地黄、熟地黄的化学成分[J]. 中成药, 2016, 38(5): 1104. ZHANG BY, JIAN ZZ, WANG YF, et al. UPLC/ESI-Q-TOP MS method for the analysis of the chemical composition of fresh realgar, raw realgar, and cooked realgar[J]. Chin Tradit Pat Med, 2016, 38(5): 1104. |
| [8] |
崔虹, 朱佳茜, 冯秋芳, 等. 中药白芍化学成分及生物活性研究进展[J]. 海峡药学, 2017, 29(9): 1. CUI H, ZHU JQ, FENG QF, et al. Advances in chemical composition and biological activity of Chinese Herbal Paeoniae[J]. Strait Pharm J, 2017, 29(9): 1. DOI:10.3969/j.issn.1006-3765.2017.09.001 |
| [9] |
黄月纯, 魏刚, 刘翠玲, 等. 白芍HPLC特征指纹图谱的稳定性考察[J]. 中药新药与临床药理, 2009, 21(3): 280. HUANG YC, WEI G, LIU CL, et al. Stability of HPLC characteristic fingerprint of paeony alba[J]. Tradit Chin Drug Res Clin Pharmacol, 2009, 21(3): 280. |
| [10] |
付国辉, 马香芹. 黄芩的化学成分及药理作用研究进展[J]. 中国当代医药, 2015, 22(22): 18. FU GH, MA XQ. Advances in the study of chemical composition and pharmacological effects of scutellaria[J]. Chin Contemp Med, 2015, 22(22): 18. |
| [11] |
孙国祥, 时存义, 宋文, 等. 黄芩HPLC数字化指纹图谱研究[J]. 中成药, 2007, 29(10): 1408. SUN GX, SHI CY, SONG W, et al. Study on digital fingerprint of scutellaria baicalensis HPLC[J]. Chin Tradit Pat Med, 2007, 29(10): 1408. DOI:10.3969/j.issn.1001-1528.2007.10.002 |
| [12] |
刘芳, 张浩, 青琳森. 黄连HPLC数字化指纹图谱研究及7种生物碱含量测定[J]. 中国中药杂志, 2013, 38(21): 3713. LIU F, ZHANG H, QING LS. Study on HPLC digital fingerprint of Coptis chinensis and determination of seven alkaloids[J]. China J Chin Mater Med, 2013, 38(21): 3713. |
| [13] |
杜怡波, 樊慧蓉, 阎昭. 阿胶的化学成分及药理作用研究进展[J]. 天津医科大学学报, 2018, 24(3): 267. DU YB, FAN HR, YAN Z. Advances in the study of chemical composition and pharmacological effects of gum[J]. J Tianjin Med Univ, 2018, 24(3): 267. |
| [14] |
徐硕, 姜文清, 邝咏梅, 等. 茯苓化学成分及生物活性研究进展[J]. 西北药学杂志, 2016, 31(3): 327. XU S, JIANG WQ, KUANG YM, et al. Advances in the study of chemical composition and biological activity of poria[J]. Northwest Pharm J, 2016, 31(3): 327. DOI:10.3969/j.issn.1004-2407.2016.03.032 |
 2019, Vol. 39
2019, Vol. 39 
