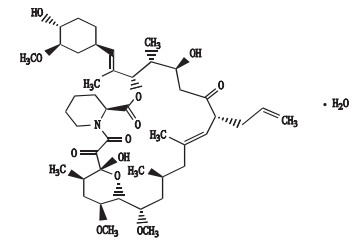
他克莫司(tacrolimus)为17-烯丙基-1,14-二羟基-12-[2-(4-羟-3-甲氧基环己基)-1-甲基乙烯基]-23,25-二甲氧基-13,19,21,27-四甲基-11,28-二噁-4-氮杂环[22.3.1.04,9]二十八烷-18-烯-2,3,10,16-四酮一水合物,结构式见图 1。相对分子质量822.02,按无水物计算,含C44H69NO12(他克莫司与异构体Ⅰ、异构体Ⅱ之和)应为98.0%~102.0%。
|
图 1 他克莫司结构式 Fig.1 Structure of tacrolimus |
他克莫司是从筑波山土壤真菌发酵产物中提取的一种新型23元大环内酯聚酮类免疫抑制剂[3-4],又名FK-506,普乐可复,是由日本藤泽制药公司于1982年提取的一种真菌代谢产物。本品对T细胞具有选择性的抑制作用,主要是通过抑制TH细胞释放IL-2、IL-3,IFN-γ,以及抑制IL-2R的表达而发挥其强大的免疫抑制作用[5],适用于防治器官移植后的排斥反应,其临床疗效是CsA的100倍。本品对需氧菌特别是真菌有很强的抗菌活性。真菌是一类很重要的致病原,最常见的真菌病原体为酵母、霉菌和皮肤真菌[6]。他克莫司抑菌作用强,采用单一常规微生物检查法试验时,会对菌落产生抑制作用,导致回收比值不能达到要求,从而不能对药品本身菌落进行计数检查。通过本次试验,消除了他克莫司本身的抑菌性[7],建立了科学的微生物限度检查方法,极大地提高了药品的安全性,也为其他有类似抑菌性的药品建立微生物限度方法学验证提供了相应的借鉴。
1 实验材料 1.1 样品他克莫司原料,国药川抗有限公司生产,批号160501、160502、160503。
1.2 试验用菌种验证实验所用的菌株传代次数不得超过5代,并采用适宜的菌种传代、保藏技术,以保证试验菌株的生物学特性。大肠埃希菌CMCC(B)44102(第三代)、金黄色葡萄球菌CMCC(B)26003(第三代)、枯草芽孢杆菌CMCC(B)63501(第三代)、铜绿假单胞菌CMCC(B)10104(第三代)、黑曲霉CMCC(F)98003(第三代)、白色念珠菌CMCC(F)98001(第三代),均由四川省食品药品检测检验院提供。
1.3 稀释液及培养基含0.1%吐温80(成都市科隆化学品有限公司,AR,500 mL·瓶-1)的pH 7.0无菌氯化钠-蛋白胨缓冲液(北京三药科技开发公司,250 g·瓶-1),无菌十四烷酸异丙酯(北京牛牛基因技术有限公司,200 mL·瓶-1),胰酪琼大豆胨脂培养基(北京三药科技开发公司,250 g·瓶-1),胰酪琼大豆胨液体培养基(北京三药科技开发公司,250 g·瓶-1),沙氏葡萄糖琼脂培养基(北京三药科技开发公司,250 g·瓶-1),麦康凯液体培养基(北京三药科技开发公司,250 g·瓶-1),麦康凯琼脂培养基(北京三药科技开发公司,250 g·瓶-1)。
1.4 试验器具SW-CJ-2FD洁净工作台(苏州安泰空气技术有限公司),ESCO-AC2-6S1生物安全柜(新加坡艺思高有限公司),LDZH-100KBS压力蒸汽灭菌器(上海精宏实验设备有限公司),LY05-300恒温恒湿培养箱(上海龙跃仪器设备有限公司,LY05-300,MJP-150霉菌培养箱(上海精宏实验设备有限公司),HTY-2000集菌仪(杭州泰林生物技术设备有限公司)等。
2 方法 2.1 试验菌菌液制备 2.1.1 铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌菌液接种铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌置10 mL胰酪大豆胨液体培养基中,33 ℃培养18~24 h。取上述新鲜培养液1 mL,加0.9%无菌氯化钠溶液9 mL,采用10倍递增稀释法,稀释至10-5~10-8,制成含菌数约小于100 cfu·mL-1的菌悬液。
2.1.2 白色念珠菌菌液接种白色念珠菌至10 mL沙氏葡萄糖液体培养基中,25 ℃培养24~48 h。取此新鲜培养液1 mL,加0.9%无菌氯化钠溶液9 mL,采用10倍递增稀释法,稀释至10-5~10-7,制成含菌数约为小于100 cfu·mL-1的菌悬液。
2.1.3 黑曲霉菌菌液接种黑曲霉菌至沙氏葡萄糖琼脂斜面培养基中,25 ℃培养5~7 d,在新鲜培养物中加入3~5 mL含0.05%聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱,取1 mL吸至无菌试管内,加含0.05%聚山梨酯80的0.9%无菌氯化钠溶液9 mL,采用10倍递增稀释法,稀释至10-5~10-7,制成含菌数约小于100 cfu·mL-1的菌悬液。
2.2 供试液 2.2.1 萃取法取供试品5 g,加含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液495 mL,于40 ℃水浴振荡摇匀溶解,静置分层,取上清液60 mL入分液漏斗,加入无菌十四烷酸异丙酯40 mL,振摇2~5 min,静置分层,取下层(水层)作为1:100供试液①。
2.2.2 常规法另取供试品5 g,加含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液45 mL,于40 ℃水浴振荡摇匀溶解,静置分层,取上清液作为1:10供试液②。供试品需氧菌总数、霉菌和酵母菌总数计数方法适用性试验步骤(整个过程冲洗液均水浴40 ℃保温)。
2.3 回收比值测定(薄膜过滤法) 2.3.1 试验组取5份1:100供试液①1 mL,分别加入100 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液,混匀,过滤,用900 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液分次冲洗,每次不超过100 mL,在最后1次冲洗液中分别加入金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉5种实验菌菌悬液1 mL(小于100 cfu·mL-1),过滤后取出滤膜,菌面朝上贴于TSA平板上,按规定条件培养,菌落计数;另取2份1:100供试液①1 mL,分别加入100 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液,混匀,过滤,用900 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液分次冲洗,每次不超过100 mL,在最后1次冲洗液中分别加入白色念珠菌、黑曲霉悬液1 mL(小于100 cfu·mL-1),过滤后取出滤膜,菌面朝上贴于沙氏葡萄糖琼脂培养基平板上,按规定条件培养,菌落计数。
2.3.2 菌液对照组取40 mL无菌十四烷酸异丙酯,加入含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液495 mL,振摇混匀,静置分层,取水层1 mL加入含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液100 mL,混匀,过滤,用900 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液分次冲洗,每次不超过100 mL,在最后1次冲洗液中分别加入金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉五种实验菌菌悬液1 mL(小于100 cfu·mL-1),过滤后取出滤膜,菌面朝上贴于TSA平板上,按规定条件培养,菌落计数;另取上述水层各1 mL,分别加入100 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液,混匀,过滤,用900 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液分次冲洗,每次不超过100 mL,在最后1次冲洗液中分别加入白色念珠菌、黑曲霉悬液1 mL(小于100 cfu·mL-1),过滤后取出滤膜,菌面朝上贴于沙氏葡萄糖琼脂培养基平板上,按规定条件培养,菌落计数。同时也考察稀释剂的适用性。
2.3.3 供试品对照组取1:100供试液①1 mL,用菌液稀释液1 mL代替菌液,其余操作按“2.3.1”项下方法操作。
2.3.4 阴性对照组用菌液稀释液1 mL代替供试液,其余操作按“2.3.1”项下方法操作。
3 结果计算按上述方法,进行3次独立平行试验,并分别计算各试验菌每次试验的回收试验比值。
| $ \begin{array}{l} \;\;\;\;\;\;\;\;\;试验组平均菌落数 - 供试品\\ 回收试验比值 = \frac{对照组平均菌落数}{菌液对照组组平均菌落数} \end{array} $ |
3次独立平行试验中回收试验比值应在0.5~2范围内。
3.1.1 需氧菌薄膜过滤法进行他克莫司需氧菌计数方法适用性检查结果见表 1。
|
|
表 1 需氧菌计数结果回收比值 Tab.1 Aerobic bacteria count results are expressed as recovery ratio |
薄膜过滤法进行他克莫司霉菌、酵母菌计数方法适用性检查结果见表 2。
|
|
表 2 霉菌、酵母菌回收结果比值 Tab.2 Mold and yeast recovery results ratio |
取1:10的供试液②10 mL,加入100 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液,混匀,过滤,用900 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液分次冲洗,每次不超过100 mL,在最后1次冲洗液中加入大肠埃希菌菌悬液1 mL(小于100 cfu),取滤膜至300 mL胰酪大豆胨液体培养基中,混匀,置33 ℃培养18~24 h。
3.2.2 阴性对照组取含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液10 mL,按“3.2.1”项操作。
3.2.3 样品组取1:10的供试液②10 mL,加入100 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液,混匀,过滤,用900 mL含0.1%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液分次冲洗,每次不超过100 mL,取滤膜至300 mL胰酪大豆胨液体培养基中,混匀,置33 ℃培养18~24 h。
3.2.4 大肠埃希菌试验方法分别取上述3组培养物1 mL至100 mL麦康凯液体培养基中,混匀,置43 ℃培养48 h(43 ℃是区分大肠埃希菌和其他大肠菌群的关键条件[8])。再分别取3组麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,置33 ℃培养18~24 h。
3.2.5 控制菌大肠埃希菌方法适用性试验结果见表 3。
|
|
表 3 控制菌适用性试验结果 Tab.3 Results of control bacteria suitability test |
试验组应检出大肠埃希菌,阴性对照组和样品组应不检出大肠埃希菌。
4 讨论本次对他克莫司微生物限度方法学验证过程中发现,他克莫司原料对霉菌的抑菌作用最强,须将供试品进行1:100浓度稀释、萃取,并按最大冲洗量对滤膜进行冲洗(《中华人民共和国药典》要求每张滤膜每次冲洗量一般为100 mL,总冲洗量不得超过1 000 mL[1])并使用了吐温80作为乳化剂[2];而对需氧菌抑菌性作用没有对霉菌抑菌性作用强,实验过程中发现按1:10浓度稀释并冲洗1 000 mL冲洗液能达到消除抑菌性的效果,但根据药典要求都采取了相同的供试液制备方法及冲洗用量进行计数方法适用性试验。验证过程中采用了单一的平皿法或培养基稀释法进行适用性试验,也采用单一的薄膜过滤法用不同的冲洗量进行适用性试验,未能达到回收比值要求,只将最后试验成功的方法联用进行了体现。试验中按规定条件培养需氧菌计数5 d,酵母菌和霉菌计数培养7 d,培养期间进行观察[9]。处于生长期细菌,代谢旺盛,生长迅速,个体形态、化学组成和生理特性等均较一致,是微生物检验、鉴定理想状态[10],延长培养时间有利于微生物检出[11]。
通过对他克莫司原料微生物限度方法学验证,找到了消除药品较强抑菌活性的方法,联合使用药典要求的常用检测方法。目前对药品微生物限度检测还有干片培养法、荧光分析法、微生物活性测定法、近红外光谱检测法和高光谱成像检测法等[9-12]。各种方法各有所长,但是常用的平皿法、培养基稀释法、薄膜过滤法、萃取法仍然是最简便耐用的方法,对药品微生物限度检验有着重大的意义。
| [1] |
中华人民共和国药典2015年版.四部[S]. 2015: 114 ChP 2015. Vol Ⅳ[S]. 2015: 114 |
| [2] |
邵敏, 赵然, 周鹤峰. 霉菌检测培养基改良实验研究[J]. 食品工业科技, 2010, 20(2): 331. SHAO M, ZHAO R, ZHOU HF. Study on the improvement of medium for mold inspection[J]. Sci Technol Food Ind, 2010, 20(2): 331. |
| [3] |
落合武德, 矶野可一, 张之荫. 新型免疫抑制剂FK506[J]. 国外医药·抗生素分册, 1991, 12(3): 225. LUO HWD, JI YKY, ZHANG ZY. A new type immunosuppressive agent FK506[J]. World Notes Antibiot, 1991, 12(3): 225. |
| [4] |
KINO T, HATANAKA H, HASHIMOTO M, et al. FK506, a novel immunosuppressant isolated from a treptomyces, Ⅰ. Fementation, isolation, and physico -chemical and biological characteristic.[J]. J Antibiot, 1987, 40(9): 1249. DOI:10.7164/antibiotics.40.1249 |
| [5] |
王意如. 免疫抑制剂研究新进展[J]. 中国新药杂志, 2002, 11(7): 512. WANG YR. Recent advances in immunosuppressive drugs[J]. Chin J New Drugs, 2002, 11(7): 512. DOI:10.3321/j.issn:1003-3734.2002.07.004 |
| [6] |
DENYER SP, HODGES NA, GORMAN SP.司书毅, 洪斌, 余利岩译.药物微生物学.第七版[M].北京: 化学工业出版社, 2007: 39 DENYER SP, HODGES NA, GORMAN SP. Translated by SI SY, HONG B, YU LY. Drug Microbiology. 7th Ed[M]. Beijing: Chemical Industry Press, 2007: 39 |
| [7] |
周剑, 李霞. 药品微生物限度检查法中几种样品前处理方法的可行性研究[J]. 中国药房, 2012, 23(33): 273. ZHOU J, LI X. Feasibility of pretreatment methods of samples in the microbial limit test[J]. China Pharm, 2012, 23(33): 273. |
| [8] |
BAIRD RM, HODGES NA, DENEY SP. Handbook of Microbiological Quality Control[M]. Boca Raton: Chemical Rubber Company Press, 2000: 97.
|
| [9] |
马群飞. GB 4789.15-2016《食品安全国家标准-食品微生物学检验霉菌和酵母计数》标准解读[J]. 中国卫生标准管理, 2018, 9(5): 1. MA QF. Interpretation for GB 4789.15-2016 national food safety standard-food microbiological examination-enumeration of moulds and yeasts[J]. China Health Stand Manage, 2018, 9(5): 1. DOI:10.3969/j.issn.1674-9316.2018.05.001 |
| [10] |
贾俊涛, 梁成珠, 马维兴. 食品微生物检测工作指南[M]. 北京: 中国质检出版社/中国标准出版社, 2012: 211. JIA JT, LIANG CZ, MA WX. Guidelines for Food Microbiological Testing[M]. Beijing: China Quality and Standards Publishing, 2012: 211. |
| [11] |
吴美华. 对中国药典微生物限度霉菌和指示菌检查的探索[J]. 海峡药学, 2005, 17(2): 81. WU MH. A study on the examination of microbial limit mould and indicator bacteria in Chinese Pharmacopoeia[J]. Strait Pharm J, 2005, 17(2): 81. DOI:10.3969/j.issn.1006-3765.2005.02.043 |
| [12] |
周玉庭, 任佳丽, 张紫莺. 粮食中霉菌污染检测方法现状及发展趋势[J]. 食品安全质量检测学报, 2016, 7(1): 244. ZHOU YT, REN JL, ZHANG ZY. Current situation and development trends of detection methods for mold contamination in grains[J]. J Food Saf Qual, 2016, 7(1): 244. |
 2019, Vol. 39
2019, Vol. 39 