2. 浙江省立同德医院药学部, 杭州 310012
2. Department of Pharmacy, Tongde Hospital of Zhejaing Province, Hangzhou 310012, China
白术为菊科植物白术Atractylodes macrocephala Koidz.的干燥根茎,始载于《神农本草经》,为“补气健脾第一要药”,味甘、苦,性温,入脾、胃经,具有补气健脾、固表止汗、燥湿利水、安胎之功效[1-2]。白术药材主产于浙江、安徽、江西、河南、河北、湖北等地。白术饮片主要包括清炒白术和麸炒白术。2015年版《中华人民共和国药典》(简称《中国药典》)仅对白术浸出物含量做出标准规定,然而,仅通过浸出物单一指标难以全面评价白术药材及饮片的质量。
白术化学成分研究表明,其活性成分有内酯[3]、挥发油、苷类、多糖及氨基酸等。李滢等[4]采用硅胶柱色谱方法进行分离纯化,通过质谱、核磁共振等谱学数据鉴定化合物结构,结果从麸炒白术70%乙醇提取物中鉴定了20个化合物,多为内酯类成分;邹辉等[5]采用色谱技术进行分离纯化,通过理化性质及光谱方法鉴定化合物的结构,结果从白术的乙酸乙酯提取物中分离得到16个化合物。白术内酯类是白术的主要化学成分,药理研究表明白术内酯类成分具有调节胃肠道蠕动、抗炎、抗肿瘤等作用。近年来,以白术内酯为指标的HPLC含量测定方法多有报道[6-7],而采用主成分分析(principal component analysis,PCA)能够用少量的因子描述多指标变量之间的关系,在中药质量评价中应用日益广泛[8-11]。
为探讨影响白术饮片质量的主要因素,本研究以麸炒白术为研究对象,采集9省6个产地的38批麸炒白术饮片,通过测定白术内酯Ⅰ、白术内酯Ⅱ和白术内酯Ⅲ、浸出物、挥发油的含量,采用SPASS19.0软件对38批麸炒白术饮片进行聚类分析,采用SIMCA-P13.0软件对38批麸炒白术饮片进行无监督模式的PCA及有监督模式的正交偏最小二乘法判别分析(OPLS-DA),明确影响麸炒白术饮片质量的差异性指标成分,并以差异性成分含量为指标进行质量评价。
1 材料U3000高效液相色谱仪(赛默飞世尔公司);YJ-40L/h型超纯水机(杭州余杭亚洁水处理设备有限公司);FW177型中草药粉碎机;AE-50电子天平(梅特勒公司);HH-8水浴锅(常州市江南实验仪器厂);KQ400超声提取器(昆山市超声仪器有限公司);GS-6R离心机(Beckman公司)。
对照品白术内酯Ⅰ(批号111975-201501,含量99.9%)、白术内酯Ⅱ(批号111976-201501,含量99.9%)和白术内酯Ⅲ(批号111978-201501,含量99.9%)均购自中国食品药品检定研究院。甲醇、乙腈为色谱纯,其余为分析纯。38批麸炒白术饮片采集自全国白术主产区和主要药材市场,其中24批麸炒白术饮片(BZYP001-0024)产地为浙江、5批饮片(BZYP0025-0029)产地为北京、3批饮片(BZYP0030-0032)产地为江西、3批饮片(BZYP0033-0035)产地为四川、3批饮片(BZYP0036-0038)产地为天津等地,经浙江中医药大学饮片有限公司杜伟峰副教授鉴定为菊科植物白术Atractylodes macrocephala Koidz.的干燥根茎。
2 方法与结果 2.1 含量测定 2.1.1 色谱条件Thermo syncronis C18色谱柱(4.6 mm×250 mm,5 μm);以乙腈(A)和水(B)为流动相,梯度洗脱(0~16 min,40%B→24%B;16~18 min,24%B→0%B;18~30 min,0%B);流速:1.0 mL·min-1;柱温:25 ℃;进样体积10 μL。白术内酯Ⅰ检测波长276 nm,白术内酯Ⅱ和白术内酯Ⅲ检测波长220 nm。理论塔板数按白术内酯Ⅰ、白术内酯Ⅱ、白术内酯Ⅲ计算均高于5 000。
2.1.2 对照品溶液的制备取3个白术内酯对照品适量,精密称定,加入甲醇制成每1 mL含白术内酯Ⅰ、Ⅱ、Ⅲ分别为0.114、0.078、0.321 mg的溶液,即得。
2.1.3 供试品溶液的制备取白术饮片样品粉末(过3号筛)约1 g,精密称定,置于具塞锥形瓶中,加入甲醇50 mL,密塞,称量,超声(400 W,40 kHz)提取30 min,放至室温,称量,加甲醇补足减失的量,摇匀,取上清液滤过,取续滤液25 mL于蒸发皿中,75 ℃水浴浓缩至约2 mL,转移至5 mL量瓶中,加甲醇定容,即得。
2.1.4 线性关系精密移取“2.1.2”项下白术内酯Ⅰ、Ⅱ、Ⅲ对照品溶液,加甲醇逐级稀释成不同浓度梯度的混合对照品溶液,按照“2.1.1”色谱条件进样,以浓度(X,mg·mL-1)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,得回归方程,线性关系结果表明,白术内酯Ⅰ、Ⅱ、Ⅲ在含量限度范围内线性关系良好,结果见表 1。
|
|
表 1 回归方程、线性范围及相关系数 Tab.1 Regression equations, linear ranges and related coefficients of three components |
取“2.1.4”项下同一对照品混合溶液,按“2.1.1”项下色谱条件连续进样6次,进行日内精密度考察;每天进样2次,连续3 d,进行日间精密度考察;白术内酯Ⅰ、Ⅱ、Ⅲ的日内精密度RSD分别为0.46%、0.49%、0.47%,日间RSD分别为1.0%、1.7%、1.7%。表明仪器日内、日间精密度良好。
2.1.6 重复性试验取同一批麸炒白术饮片样品,按“2.1.3”项下供试品溶液制备方法操作,制备6份供试品溶液,按“2.1.1”项下色谱条件进样,计算白术内酯Ⅰ、Ⅱ、Ⅲ的含量(x±s),白术内酯Ⅰ、Ⅱ、Ⅲ平均含量分别为0.014 25%±0.000 4%、0.022 90%±0.000 6%、0.023 95%±0.000 5%;RSD分别为2.0%、2.7%、2.7%。表明此方法重复性良好。
2.1.7 稳定性试验取“2.1.4”项下同一混合对照品溶液,按“2.1.1”项下色谱条件,分别在0、2、4、6、8、12、24 h时各进样1次,白术内酯Ⅰ、Ⅱ、Ⅲ 24 h内峰面积的RSD分别为0.96%,1.8%,0.76%。表明对照品溶液在24 h内稳定。
2.1.8 加样回收率试验取已知含量的麸炒白术饮片样品6份,每份约1.0 g,精密称定,分别精密加入混合对照品溶液(白术内酯Ⅰ 0.047 mg·mL-1、白术内酯Ⅱ 0.073 mg·mL-1、白术内酯Ⅲ 0.080 mg·mL-1)3 mL,按“2.1.3”项下供试品溶液制备方法操作,按“2.1.1”项下色谱条件进样,计算白术内酯Ⅰ、Ⅱ、Ⅲ加样回收率(n=6)分别为100.2%、100.1%、101.3%,RSD分别为2.8%、1.9%、2.4%。表明本方法回收率良好。
2.1.9 样品含量测定取不同批次麸炒白术样品共38批,按“2.1.3”项下方法每个样品平行制备2份供试品溶液(n=2),按“2.1.1”项下色谱条件测定,每份供试品溶液平行测定2次(n=2),色谱图见图 1。按标准曲线法计算样品白术内酯Ⅰ、Ⅱ、Ⅲ的含量(以干燥品计算),结果见表 2,含量结果以均值表示(n=4)。
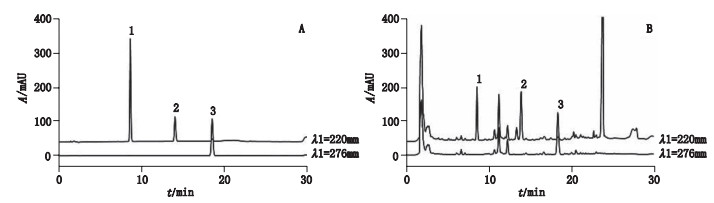
|
1.白术内酯Ⅲ(atractylenolide Ⅲ)2.白术内酯Ⅱ(atractylenolide Ⅱ)3.白术内酯Ⅰ(atractylenolide Ⅰ) 图 1 混合对照品(A)、麸炒白术样品(B)HPLC色谱图 Fig.1 HPLC chromatograms of mixed reference substances(A), sample of bran-processed Atractylodes Macrocephala Rhizoma(B) |
按照2015年版《中国药典》四部通则〈2201〉项下热浸法以60%乙醇为溶剂测定醇溶性浸出物的含量,结果见表 2。
|
|
表 2 麸炒白术白术内酯Ⅰ、Ⅱ、Ⅲ、浸出物、挥发油含量测定结果(%) Tab.2 Determination results of atractylenolide Ⅰ, atractylenolide Ⅱ, atractylenolide Ⅲ, extract and volatile oil in bran-processed Atractylodes Macrocephala Rhizoma |
按照2015年版《中国药典》四部通则〈2204〉项下挥发油测定法甲法测定,结果见表 2。
2.4 多元统计分析 2.4.1 主成分分析与聚类分析对38批麸炒白术饮片中浸出物,白术内酯Ⅰ、Ⅱ、Ⅲ,白术总内酯,挥发油的含量测定结果,采用SIMCA-P 13.0软件,进行无监督模式的主成分分析(PCA)分析,采用SPASS 19.0,进行聚类分析,结果见图 2。由图 2-A主成分分析结果可看出,除样本BZYP001离群外,其余样本均在群内,38批样本可明显分为3组。2015版《中国药典》一部白术质量标准规定,其浸出物含量不得低于35%,对3组样本组内指标性成分含量分布进行统计分析,发现组1和组2为浸出物含量符合《中国药典》规定样本,组3包含浸出物含量不符合《中国药典》规定样本;由图 2-B SPASS聚类分析可知,除样本BZYP001独自聚为一类外,38批麸炒白术可明显地聚为3类,这与主成分分析结果相一致。
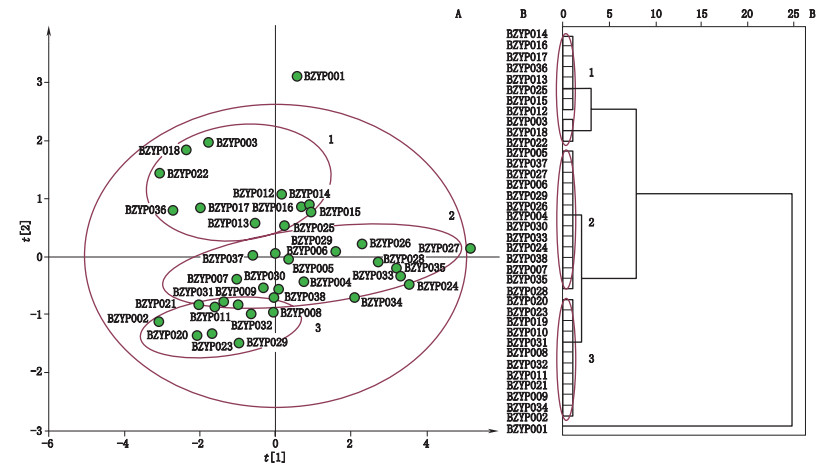
|
图 2 麸炒白术PCA散点图(A)和聚类分析图(B) Fig.2 PCA score scatter plot(A)and hierarchical cluster analysis plot(B) |
在PCA分析的基础上,以6种含量测定指标为自变量,样本类别为因变量,对组1和组2 2组样品进行OPLS-DA分析,利用变量权重重要性排序(VIP)对组间差异性指标进行筛选和指认,结果R2Y(cum)=0.904,Q2=0.818,表明模型拟合和预测效果良好;VIP值均大于1的成分为白术内酯Ⅱ、白术总内酯、白术内酯Ⅰ、白术内酯Ⅲ,其中VIP值最大的的主成分为白术内酯Ⅱ(见图 3-B);组1和组2 OPLS-DA散点图见图 3-A。以VIP值最大的白术内酯Ⅱ含量为指标,对组1和组2进行单因素方法分析,结果显示2组样本中白术内酯Ⅱ含量具有显著性差异(P < 0.01),组1样本中白术内酯Ⅱ含量较高,含量范围在0.015 0%-0.044 5%之间,组2样本中白术内酯Ⅱ含量较低,范围在0.003 5%~0.015 0%之间。表明白术内酯Ⅱ可作为饮片等级划分的依据。
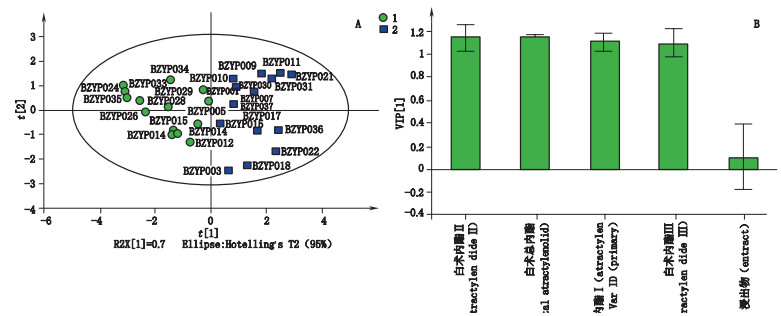
|
图 3 组1和组2 OPLS-DA散点图(A)和VIP图(B) Fig.3 Score scatter plot(A)and VIP plot(B)of OPLS-DA on group1 and group 2 |
以6种含量测定指标为自变量,样本类别为因变量,对组2和组3 2组样品进行OPLS-DA分析,结果R2Y(cum)=0.759,Q2=0.730,模型拟合和预测效果良好,其中VIP值最大的主成分为浸出物(见图 4-B);组2和组3 OPLS-DA散点图见图 4-A。对组2和组3 2组样点的浸出物含量分布进行分析,结果显示组2浸出物含量在36%~50%之间、组3浸出物含量在30%~35%之间;表明浸出物是区分合格与不合格样本的主要有效成分。
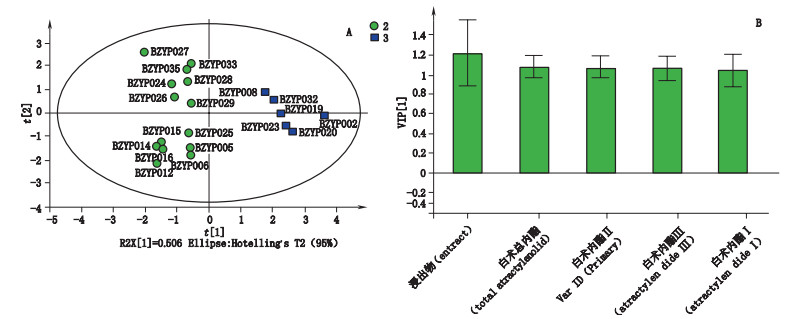
|
图 4 组2和组3 OPLS-DA散点图(A)和(B)VIP图(B) Fig.4 Score scatter plot(A)and VIP plot(B)of OPLS-DA on group 2 and group 3 |
本研究采用HPLC法,以麸炒白术中含量较高的白术内酯Ⅰ、Ⅱ、Ⅲ为指标,对流动相体系甲醇-水和乙腈-水体系进行考察,并对梯度洗脱程序进行优化,结果以乙腈-水为流动相体系,所确定的梯度洗脱程序各色谱峰在30 min内均被洗脱,且分离较佳;对白术样品进行紫外-可见波长扫描,结果白术内酯Ⅰ在276 nm处有最强吸收,白术内酯Ⅱ、Ⅲ在220 nm处有最强吸收,因此选择276 nm作为白术内酯Ⅰ检测波长、220 nm作为白术内酯Ⅱ、Ⅲ检测波长;对柱温20、25、30、35 ℃进行考察,结果25 ℃柱温的出峰时间和峰形最为理想。本研究所建立的HPLC方法可用于白术其它炮制品中白术内酯Ⅰ、Ⅱ、Ⅲ的检测。
提取条件的优化首先采用单因素考察法,以白术内酯Ⅰ、Ⅱ、Ⅲ含量为指标,对提取方法浸提法、超声提取法、索氏提取法,提取溶剂乙酸乙酯、乙醇、甲醇进行考察,结果提取方法选择超声提取法,提取溶剂选择甲醇。根据单因素考察的结果,采用正交试验法,以甲醇百分体积分数50%、75%、100%,提取料液比1:10、1:50、1:100,提取时间30、45、60 min为因素,最终确定最佳提取条件为100%甲醇超声提取30 min。
3.2 麸炒白术质量评价的意义白术内酯Ⅰ、Ⅱ、Ⅲ作为白术的重要有效成分,其含量直接影响白术的药效发挥。药理研究表明,内酯类成分具有调节胃肠道蠕动、抗炎、抗肿瘤等作用[12-13]。高小玲等[14]同时比较了白术3种内酯类成分的抗肿瘤作用,发现白术内酯Ⅱ抗肿瘤作用更优于白术内酯Ⅰ,白术内酯Ⅲ;张彩霞[15]采用体外培养人大肠癌Lovo细胞,采用不同浓度的白术内酯Ⅱ分别作用于细胞,结果表明白术内酯Ⅱ对大肠癌Lovo细胞增殖的抑制作用;陈一竹等[16]通过体外血小板聚集实验,发现白术内酯Ⅱ对胶原诱发的小鼠及人血小板聚集能产生显著抑制作用,对人血小板的铺展也有抑制作用,其作用机制可能与血小板活化过程中的P13K-Akt信号通路有关,提示白术内酯Ⅱ是一种有效的抗血小板化合物。
本文以白术内酯Ⅰ、Ⅱ、Ⅲ、浸出物、挥发油为指标,采用多元统计分析,证明白术内酯Ⅱ是影响麸炒白术质量的显著性因素。由于2015年版《中国药典》一部收录的白术质量标准中无HPLC含量测定项,本研究该结果可为白术质量评价提供划分依据,为含量测定标准的制定提供实验依据。
| [1] |
中华人民共和国药典2015年版.一部[S]. 2015: 103 ChP 2015. Vol Ⅰ[S]. 2015: 103 |
| [2] |
张程荣, 曹岗, 丛晓东, 等. 白术化学成分和质量控制研究进展[J]. 中华中医药杂志, 2011(10): 2328. ZHANG CR, CAO G, CONG XD, et al. Advances in studies on chemistry and quality control of Atractylodes macrocephala Koidz[J]. China J Tradi Chin Med Pharm, 2011(10): 2328. |
| [3] |
李滢, 杨秀伟. 生白术化学成分研究[J]. 中国现代中药, 2018, 20(4): 382. LI Y, YANG XW. Chemical constituents of Rhizomes of Atractylodes macrocephala[J]. Mod Chin Med, 2018, 20(4): 382. |
| [4] |
李滢, 杨秀伟. 麸炒白术化学成分的研究[J]. 中国现代中药, 2018, 20(9): 1074. LI Y, YANG XW. Chemical constituents of Atractylodis macrocephalae Rhizoma Stir-fried with Wheat Bran[J]. Mod Chin Med, 2018, 20(9): 1074. |
| [5] |
邹辉, 杨郴, 易美玲. 白术化学成分分离鉴定[J]. 中国实验方剂学杂志, 2016, 22(17): 43. ZOU H, YANG C, YI ML. Chemical constituents of Atractylodis Macrocephalae Rhizoma[J]. Chin J Exp Tradit Med Form, 2016, 22(17): 43. |
| [6] |
盛云杰, 严斌俊, 穆朝峰, 等. 基于指纹图谱与化学计量学评价白术炮制品质量[J]. 中成药, 2017, 39(10): 2124. SHENG YJ, YAN BJ, MU CF, et al. Quality evaluation of Atractylodis macrocephalae Rhizoma processed products based on fingerprints and chemometrics[J]. Chin Tradit Pat Med, 2017, 39(10): 2124. DOI:10.3969/j.issn.1001-1528.2017.10.028 |
| [7] |
李琴瑜, 吴卫刚, 崔波, 等. 高效液相色谱法结合多元统计分析用于苍术药材的质量评价[J]. 药物分析杂志, 2018, 38(4): 598. LI QY, WU WG, CUI B, et al. Quality evaluation of atractylodes by high-performance liquid chromatography and multivariate statistical analysis[J]. Chin J Pharm Anal, 2018, 38(4): 598. |
| [8] |
CHEN J, GAO J, SUN G. Quantitative analysis combined with chromatographic fingerprint and antioxidant activities for the comprehensive evaluation of compound Danshen tablets[J]. J Sep Sci, 2017, 40(6): 1244. DOI:10.1002/jssc.201600813 |
| [9] |
梁乙川, 郭换, 刘素娟, 等. 基于颜色变化的麸炒白术最佳炮制火候的客观量化判别[J]. 中国实验方剂学杂志, 2018, 24(6): 12. LIANG YC, GUO H, LIU SJ, et al. Objective quantification discriminant of optimum processing time of Atractylodis Macrocephalae Rhizoma Stir-fried with Bran based on color change[J]. Chin J Exp Tradit Med Form, 2018, 24(6): 12. |
| [10] |
LI Y, ZHANG J, JIN H, et al. Ultraviolet spectroscopy combined with ultra-fast liquid chromatography and multivariate statistical analysis for quality assessment of wild wolfiporia extensa from different geographical origins[J]. Spectrochim Acta Part A Molecul Biomolecul Spectrosc, 2016, 165: 61. DOI:10.1016/j.saa.2016.04.012 |
| [11] |
杨燕梅, 林丽, 卢有媛, 等. 基于多指标成分分析野生与栽培秦艽药材商品规格等级[J]. 中国中药杂志, 2016, 41(5): 786. YANG YM, LIN L, LU YY, et al. Analysis of co mmercial specifications and grades of wild and cultivated Gentianae Macrophyllae Radix based on multi-indicative constituents[J]. China J Chin Mater Med, 2016, 41(5): 786. |
| [12] |
张晓娟, 左东东. 白术化学成分及药理作用研究进展[J]. 中医药信息, 2018, 35(6): 101. ZHANG XJ, ZUO DD. Chemical constituents and pharmacological effects of Atractylodes macrocephalae Rhizoma[J]. Inf Tradit Chin Med, 2018, 35(6): 101. |
| [13] |
刘志强, 刘和波, 王博龙. 白术中白术内酯Ⅰ、Ⅱ、Ⅲ的靶标预测及蛋白互作网络研究[J]. 中国药房, 2018, 23(29): 3241. LIU ZQ, LIU HB, WANG BL. Study on target prediction and protein-protein interaction networks of atractylenolideⅠ, Ⅱ, Ⅲ in Atractylodes macrocephala[J]. China Pharm, 2018, 23(29): 3241. |
| [14] |
高小玲, 汪保英, 尹素改, 等. 白术内酯对IEC-6细胞及食管癌细胞ECA9706增殖能力的影响[J]. 中华中医药杂志, 2015, 30(3): 921. GAO XL, WANG BY, YIN SG, et al. Research of atractylenolide on proliferation ability of IEC-6 cells and esophageal cancer[J]. China J Tradit Chin Med Pharm, 2015, 30(3): 921. |
| [15] |
张彩霞, 张亚杰, 江滨, 等. 白术内酯Ⅱ促进大肠癌Lovo细胞凋亡及对PARP1和caspase-3表达的影响[J]. 中国实验方剂学杂志, 2017, 23(5): 157. ZHANG CX, ZHAGN YJ, JIANG B, et al. Effect of atractylenolideⅡin promoting apoptosis of Lovo cells and its impact on expression of PARP1 and caspase-3[J]. Chin J Exp Tradit Med Form, 2017, 23(5): 157. |
| [16] |
陈一竹, 杨文龙, 郭玲玉, 等. 白术内酯Ⅱ抗血小板作用及对血小板中蛋白激酶B磷酸化水平的影响[J]. 中国医药导报, 2016, 13(11): 18. CHEN YZ, YAGN WL, GUO LY, et al. Influence of atractylenolide Ⅱ on platelet and phosphorylation level of protein kinase B[J]. China Med Her, 2016, 13(11): 18. |
 2019, Vol. 39
2019, Vol. 39 
