苗药红禾麻为荨麻科艾麻属植物珠芽艾麻Laportea bulbifera(Sieb.et Zucc.)Wedd.的新鲜或干燥全草,又名野绿麻,是贵州苗药常用药材[1]。具有祛风除湿,活血化瘀的功效。用于治疗风湿麻木,跌扑损伤,骨折等症状[1-7]。该药材收载于《贵州省中药材、民族药材质量标准》(2003年版)中,该标准中仅对其性状、性味、功能主治、用法用量及储藏条件进行了描述,而对其成分的含量测定鲜见报道,为完善其质量标准,本研究在基于课题组前期化学成分研究的基础上[8],结合超高效液相色谱-串联质谱(UPLC-ESI-MS)技术的高灵敏度、高通量、专属性好及检测周期短的特点[9-15],建立同时测定苗药红禾麻中没食子儿茶素、新绿原酸、表没食子儿茶素、儿茶素、绿原酸、隐绿原酸、表儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷及槲皮苷11个成分的含量的检测分析方法,以期为红禾麻的质量控制及资源利用提供实验依据。
1 仪器与材料 1.1 仪器ACQUITY UPLC型超高效液相色谱-TQ Detector型质谱联用仪(Waters公司),Allegra 64R型低温高速离心机(Beckman Coulter公司),ZH-2型涡旋混合器(天津药典标准仪器厂),AE240型十万分之一电子天平(上海梅特勒-托利多仪器有限公司),XYN-15LP型氮吹仪氮气发生器(上海析友分析仪器有限公司),FL-UP-YZ-20型超纯水仪(苏州飞鹿环保科技有限公司),KQ-250E型超声波清洗器(昆山市超声仪器有限公司)。
1.2 材料对照品没食子儿茶素、表没食子儿茶素、儿茶素、表儿茶素(均为实验室自制,含量≥98%),新绿原酸(江西佰草源生物科技有限公司,批号BCY-0921,含量≥98%),绿原酸(江西佰草源生物科技有限公司,批号BCY-0414,含量≥98%),隐绿原酸(江西佰草源生物科技有限公司,批号BCY-0920,含量≥98%),芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、槲皮苷(中国食品药品检定研究院,批号100080-201610、112007-201602、111809-201403、111538-201606,含量均≥98%)。甲醇、乙腈、甲酸均为色谱纯,购自Merck公司,水为超纯水,其余试剂为分析纯。
实验用红禾麻药材采收贵州省,经贵阳中医学院生药学教研室孙庆文副教授鉴定为荨麻科植物珠芽艾麻Laportea bulbifera(Sieb.et Zucc.)Wedd.的干燥全草。样品信息表见表 1。
|
|
表 1 样品信息表 Tab.1 Sample information table |
分别精密称取对照品没食子儿茶素、新绿原酸、表没食子儿茶素、儿茶素、绿原酸、隐绿原酸、表儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、槲皮苷适量,加甲醇溶解并定容至10 mL量瓶中,制成每1 mL含没食子儿茶素0.521 mg,新绿原酸1.024 mg,表没食子儿茶素0.575 mg,绿原酸1.114 mg,隐绿原酸1.086 mg,儿茶素1.026 mg,表儿茶素0.494 mg,芦丁0.508 mg,异槲皮苷0.538 mg,山柰酚-3-O-芸香糖苷0.531 mg,槲皮苷0.710 mg的单一对照品储备液。分别精密量取上述各单一对照品溶液适量,加甲醇水(50:50)制成每1 mL中含没食子儿茶素3.25 μg、新绿原酸3.200 μg、表没食子儿茶素3.594 μg,儿茶素3.206 μg,绿原酸6.975 μg,隐绿原酸3.394 μg,表儿茶素3.088 μg,芦丁50.8 μg,异槲皮苷3.360 μg,山萘酚-3-O-芸香糖苷26.55 μg,槲皮苷3.32 μg的混合对照品储备液,-20 ℃保存,备用。
2.2 供试品溶液制备精密称取红禾麻粗粉(过2号筛)约1.0 g,首先用17倍量的70%乙醇水回流提取2 h,过滤,其次用14倍量的70%乙醇水回流提取1.5 h,过滤,最后用14倍量的70%乙醇水回流提取1.5 h,过滤。合并3次提取液,加热浓缩至无乙醇味并稀释至含生药量1 g·mL-1,水饱和正丁醇按等体积(1:1)萃取3次,合并正丁醇液,回收正丁醇,在60 ℃水浴挥干,得到红禾麻正丁醇萃取的固体物,用甲醇超声(270 W,40 kHz)溶解并定容至10 mL,12 000 r·min-1离心10 min,取上清液,进样前用50%甲醇水稀释1倍进样。
2.3 色谱条件采用色谱柱Waters BEH C18(2.1 mm×50 mm,1.7 μm),保护柱Waters Van Guard BEH C18(2.1 mm×5 mm,1.7 μm),流动相为0.1%甲酸乙腈(A)-0.1%甲酸水(B),梯度洗脱(0~0.5 min,5%A;0.5~4 min,5%A→10%A;4~7 min,10%A→40%A;7~7.5 min,40%A→95%A;7.5~8 min,95%A;8~8.5 min,95%A→5%A;8.5~10 min,5%A),流速0.25 mL·min-1,柱温45 ℃,进样体积为3 μL。
2.4 质谱条件采用电喷雾电离源(ESI),毛细管电离电压3 kV,离子源温度120 ℃,去溶剂气温度350 ℃,喷雾气与反吹气(N2)流速550 L·h-1,扫描方式为选择离子监测(SIM),质谱数据采集及处理软件为MassLynx 4.1工作站,11个成分用于定量分析的监测离子见表 2。
|
|
表 2 待测成分的质谱参数 Tab.2 Parent ion and parameters of selected ion recording(SIM)mode of analytes |
取混合对照品溶液及50%甲醇水空白溶剂按照“2.3”“2.4”项下的液质联用条件进样分析,结果提取离子流图见图 1。结果表明专属性良好。
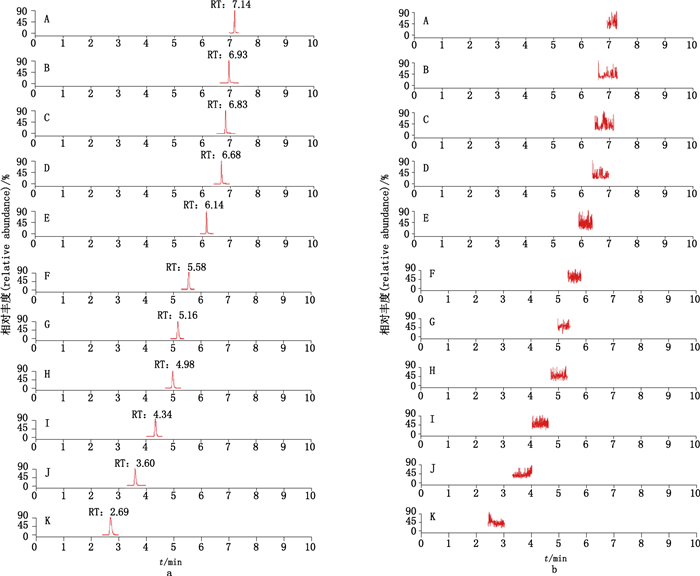
|
A.槲皮苷(gallocatechin)B.山柰酚-3-O-芸香糖苷(kaempferol-3-O-rutinoside)C.异槲皮苷(isoquercitrin)D.芦丁(rutin)E.表儿茶素(epicatechin)F.隐绿原酸(cryptochlorogenic acid)G.绿原酸(chlorogenic acid)H.儿茶素(catechin)I.表没食子儿茶素(epigallocatechin)J.新绿原酸(neochlorogenic acid)K.没食子儿茶素(gallocatechin) 图 1 混合对照品(a)及空白溶剂(b)中11个成分提取离子流图 Fig.1 Extracted ion chromatograms of 11 compounds in mix-reference substances(a)and blank solvent(b) |
取“2.1项下”混合对照品储备液适量,加50%甲醇水稀释成6个浓度的系列混合对照品溶液,按照“2.3”“2.4”项下的液质联用方法进样分析。以各待测成分质量浓度(X)为横坐标,以检测成分峰面积(Y)为纵坐标,得回归方程及相关系数,结果表明11个成分在相应的范围内线性关系良好。配制混合对照品溶液,成比例稀释,进样分析,按待测成分信燥比S/N=10计算定量下限,结果见表 4。
|
|
表 4 回归曲线方程及定量限 Tab.4 Linearity and quantitation Limits |
取混合对照品溶液,连续进样6次,测得没食子儿茶素、新绿原酸、表没食子儿茶素、儿茶素、绿原酸、隐绿原酸、表儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、槲皮苷峰面积的RSD分别为1.2%、1.7%、、1.8%、1.6%、1.1%、1.8%、1.8%、1.4%、1.5%、1.8%、2.1%,结果表明精密度良好。
2.5.4 重复性按照“2.2”项下方法制备同一批样品(DL-1)的供试品溶液6份,按照按照“2.3”“2.4”项下的液质联用条件进样分析,测得各成分峰面积,结果没食子儿茶素、新绿原酸、表没食子儿茶素、儿茶素、绿原酸、隐绿原酸、表儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、槲皮苷的平均含量分别为29.85、22.66、28.07、18.74、14.11、14.52、17.49、640.25、17.50、262.68、48.19 μg·g-1,RSD分别为2.5%、3.3%、1.4%、1.1%、2.2%、2.3%、1.0%、2.0%、2.4%、2.4%、1.8%,结果表明重复性良好。
2.5.5 稳定性取“2.2”项下同一份供试品溶液,分别于0、2、4、8、12、24 h进样检测,结果没食子儿茶素、新绿原酸、表没食子儿茶素、儿茶素、绿原酸、隐绿原酸、表儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、槲皮苷峰面积的RSD分别为1.7%、2.0%、2.6%、2.4%、3.2%、2.5%、3.2%、2.8%、1.7%、2.4%、2.7%,结果表明供试品溶液在24 h内稳定性良好。
2.5.6 加样回收率精密称取已知含量的红禾麻药材粉末(批号DL-1)6份,每份0.5 g,根据已知药材含量比例1:1,精密加入“2.1”项下制备的混合对照品储备液,照“2.2”项下方法制备供试溶液,进样检测分析。结果没食子儿茶素、新绿原酸、表没食子儿茶素、儿茶素、绿原酸、隐绿原酸、表儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、槲皮苷的平均加样回收率分别为98.3%、97.3%、95.3%、98.1%、96.5%、94.2%、103.1%、99.6%、95.8%、101.2%、98.7%,RSD分别为1.9%、1.8%、2.1%、2.0%、2.2%、2.5%、1.8%、2.0%、2.5%、1.6%、2.2%。
2.6 样品测定分别取13批红禾麻药材,按照“2.2”项下方法制备供试品溶液,进样检测。通过计算回归方程计算含量,结果见表 5。
|
|
表 5 样品测定结果(μg·g-1,n=3) Tab.5 Results of sample analyssis |
苗药红禾麻为荨麻科艾麻属珠芽艾麻的全草,收载于2003年版《贵州中药材、民族药材质量标准》中,民间广泛用于治疗风湿痹痛、肢体麻木、跌打损伤、骨折疼痛等疾病,疗效显著。但据市场调查红禾麻与其相同种属根叶十分相似,容易混淆,因此查阅文献,总结红禾麻药材具有几个特征:(1)根略呈纺锤状或细长圆锥状,多弯曲,表面棕褐色或灰棕色,具纵皱纹。质硬而脆,易折断粉性强,可见纤维,淡红褐色,茎平滑或具短毛及少数螫毛。(2)叶狭卵形或卵形,先端渐尖,基部宽楔形或圆形,边缘具钝锯齿、圆齿或尖齿,两面疏生短毛和螫毛,常以脉上较密,具柄。(3)叶腋常生1~4个珠芽。
3.2 提取条件的选择根据文献报道及在实验室前期对红禾麻抗炎镇痛动物模型研究的基础上,本实验考察了不同溶剂(甲醇、50%甲醇水溶液、乙醇、95%乙醇水溶液、70%乙醇水溶液、50%乙醇水溶液)加热回流提取和水煎煮的提取方式,结果用70%乙醇水溶液作为提取溶剂时回流提取时成分较多;萃取溶剂考察了石油醚、乙酸乙酯和正丁醇3种,结果用正丁醇萃取部位中被测成分峰形好且提取成分较丰富,因此,实验确定苗药红禾麻提取路线为70%乙醇水溶液回流提取,提取液挥至无醇后用正丁醇萃取。
3.3 检测方法的选择实验过程中尝试了多反应监测(MRM)法测定,结果各成分响应较低,尤其是含量较低的成分比如说儿茶素类和绿原酸类,无法实现定量分析。然而通过选择离子监测(SIM)模式对母离子的[M+H]+和[M-H]-进行准分子离子扫描时,发现准分子离子峰的强度明显高于MRM模式下扫描的碎片离子峰的强度,因此实验选选SIM扫描方式用于定量红禾麻药材中指认的11个成分。红禾麻药材中有儿茶素与表儿茶素、没食子儿茶素与表没食子儿茶素及新绿原酸、绿原酸及隐绿原酸3对同分异构体,用常规液相色谱方法分离几个成分耗时长,分离较难,而采用LC-ESI-MS法具有耗时短,选择性高,灵敏度高,专属性好的特点,可用于准确定量苗药红禾麻中各成分的含量。
3.4 小结本实验建立了LC-ESI-MS分析方法同时测定红禾麻药材中没食子儿茶素、新绿原酸、表没食子儿茶素、儿茶素、绿原酸、隐绿原酸、表儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、槲皮苷11个成分的含量,该方法简单、快捷,灵敏度高,专属性好,可为红禾麻药材的质量控制提供参考依据。该方法较普通液相色谱而言,具有准确可靠,灵敏度高,专属性好和定量下限更低的优点,使用液质联用分析技术对药材成分含量分析更具有效。
| [1] |
贵州省药品监督管理局.贵州省中药材、民族药材质量标准[S].贵阳: 贵州科学技术出版社, 2003: 187 Drug Administration of Guizhou Province. Quality Standard of Chinese Herbal Medicine and National Medicine in Guizhou[S]. Guiyang: Guizhou Science and Technology Publishing House, 2003: 187 |
| [2] |
国家中医药管理局《中华本草》编委会. 中华本草·苗药卷[M]. 贵阳: 贵州科学技术出版社, 2005: 283. Editorial Committee of China National Materia Medica Administration. Chinese Materia Medica·Miao Medicine Roll[M]. Guiyang: Guizhou Science and Technology Publishing House, 2005: 283. |
| [3] |
孙庆文, 徐文芬, 齐维娜, 等. 苗药红禾麻与易混品艾麻的生药鉴别研究[J]. 中药材, 2015, 38(9): 1862. SUN QW, XU WF, QI WN, et al. To study the crude drug identification of Laportea bulbifera of Miao medicine and easymixed Laportea cuspidate[J]. J Chin Med Mater, 2015, 38(9): 1862. |
| [4] |
汪石丽.红禾麻抗炎镇痛物质基础及质量控制研究[D].贵阳: 贵阳医学院, 2015 WANG SL. Material Basis for the Anti-Infla Mmatory and Analgesic Effects of Laportea bulbifera and its Quality Control[D]. Guiyang: Guiyang Medical College, 2015 |
| [5] |
汪石丽, 李勇军, 廖尚高, 等. HPLC同时测定黔产红禾麻中4种儿茶素类成分含量[J]. 中国实验方剂学杂志, 2014, 20(21): 91. WANG SL, LI YJ, LIAO SG, et al. Simultaneous determination of four catechins in Laportea bulbifera by HPLC[J]. Chin J Exp Tradit Med Form, 2014, 20(21): 91. |
| [6] |
苏志强, 赵增宇, 谢胜男, 等. 红活麻提取物镇痛抗炎和免疫抑制活性研究[J]. 中国药理学通报, 2009, 25(4): 559. SUN ZQ, ZHAO ZY, XIE SN, et al. Effect of analgesia, antiinfla mmation and immunosuppression of acetic ether extract of Chinese medicine Honghuoma[J]. Chin Pharmacol Bull, 2009, 25(4): 559. DOI:10.3321/j.issn:1001-1978.2009.04.037 |
| [7] |
马琳, 梁冰, 朱珠, 等. 民族药珠芽艾麻醇提物镇痛药理作用的研究[J]. 贵阳中医学院学报, 2012, 34(1): 24. MA L, LIANG B, ZHU Z, et al. To research the analgesia pharmacologica action of the ethanolic extrat of national medicine Laportea bulbifeara[J]. J Guiyang Coll Tradit Chin Med, 2012, 34(1): 24. DOI:10.3969/j.issn.1002-1108.2012.01.11 |
| [8] |
唐娟, 吴耽, 陈思颖, 等. 基于UPLC-ESI-Q-TOF-MS的红禾麻提取物化学成分分析[J]. 中国实验方剂学杂志, 2018, 24(10): 1. TANG J, WU D, CHEN SY, et al. Identification of chemical compositions in Laportea bulbifera by UPLC-ESI-Q-TOF-MS[J]. Chin J Exp Tradit Med Form, 2018, 24(10): 1. |
| [9] |
孙大赢, 赵文法, 李广华, 等. LC-MS/MS法同时测定参芍胶囊中人参皂苷和芍药苷的含量[J]. 药物分析杂志, 2018, 38(1): 186. SUN DY, ZHAO WF, LI GH, et al. Simultaneous determination of ginsenosides and paeoniflorin in Shenshao capsules by LC-MS/MS[J]. Chin J Pharm Anal, 2018, 38(1): 186. |
| [10] |
唐蕾, 王琳玲, 徐新元. 液相色谱-质谱联用同时测定芪胶升白胶囊中黄芪甲苷、淫羊藿苷、阿魏酸的含量[J]. 药物分析杂志, 2016, 36(12): 2199. TANG L, WANG LL, XU XY. Simultaneous determination of the contents of astragaloside Ⅳ, icariin and ferulic acid in Shenbai capsules by LC-MS[J]. Chin J Pharm Anal, 2016, 36(12): 2199. |
| [11] |
宋凡, 宋晓妮, 王磊, 等. 酒石酸伐尼克兰中6个类苯胺基因毒性杂质的LC-MS法测定[J]. 药物分析杂志, 2018, 38(1): 130. SONG F, SONG XN, WANG L, et al. Determination of six anilinelike genotoxic impurities in varenicline tartrate by LC-MS[J]. Chin J Pharm Anal, 2018, 38(1): 130. |
| [12] |
梁琨, 孙辉, 安叡, 等. LC-MS/MS法同时测定护心口服液中11种成分[J]. 中成药, 2018, 40(1): 105. LIANG K, SUN H, AN R, et al. Simultaneous determination of eleven constituents in Huxin oral liquid by LC-MS/MS[J]. Chin Tradit Pat Med, 2018, 40(1): 105. DOI:10.3969/j.issn.1001-1528.2018.01.020 |
| [13] |
潘立卫, 罗泽萍, 范明燕. HPLC法同时测定华山矾中8种成分的含量[J]. 中药材, 2017, 40(6): 1377. PAN LW, LUO ZP, FAN MY. Simultaneous determination of eight constituents in Symplocos chinensis by HPLC[J]. J Chin Med Mater, 2017, 40(6): 1377. |
| [14] |
胡莹, 吴啟南, 郑啸, 等. LC-MS/MS法同时测定金樱子中7种主要成分的含量[J]. 中药材, 2016, 39(12): 2798. HU Y, WU QN, ZHEN X, et al. Simultaneous determination of seven constituents in Rosa laevigata Michx. by LC-MS/MS[J]. J Chin Med Mater, 2016, 39(12): 2798. |
| [15] |
杨才琼, 吴海军, 张潇文, 等. LC-MS测定黑豆中异黄酮和花色苷的含量[J]. 天然产物研究与开发, 2018, 30(5): 817. YANG CQ, WU HJ, ZHANG XW, et al. Determination of isoflavone and anthocyanin in black soybean seed(Glycine max)by LC-MS[J]. Nat Prod Res Dev, 2018, 30(5): 817. |
 2019, Vol. 39
2019, Vol. 39 
