2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
前胡,首载于《名医别录》,列为中品[1],来源于伞形科前胡属植物白花前胡Peucedanum praeruptorum Dunn的干燥根,具有降气化痰及散风清热的功效,用于痰热喘满,咳痰黄稠,风热咳嗽痰多等症的治疗[2],主产于甘肃、河南、贵州等地[3]。现代研究发现,前胡的化学成分主要包括香豆素、菲醌、有机酸、甾醇及挥发油等类化合物[4-8],具有止咳、平喘等药理活性。
历版《中华人民共和国药典》前胡项下收载药材植物来源存在变化,1963年版至2000年版,前胡项下收载白花前胡和紫花前胡作为其来源,自2010年版药典起,将前胡与紫花前胡分列为2种药材,其基原分别为白花前胡和紫花前胡。与此同时,全国多个省份中药材标准收载前胡属、当归属及藁本属的少毛北前胡[9-10]、短片藁本[11]、红前胡[11]、长前胡[11]、华中前胡[11]、紫花前胡[12]等药材可代替前胡入药,市场中尚存在其他多种来源的药材掺伪使用现象,这为市场监管带来了诸多困难。本文拟通过采集白花前胡、紫花前胡及少毛北前胡标本及样品,结合植物分类进行准确的基原鉴定。以该类药材中所含主要香豆素类化合物为研究对象,利用HPLC法建立不同来源样本的特征图谱,通过Chempattern及Ezinfo化学计量学软件对数据进行处理,结合主成分分析(principle component analysis,PCA),对不同批次的前胡及其易混用品紫花前胡及硬前胡进行整体比较研究,旨在建立前胡及其易混用品的定性鉴别方法,为其质量控制、标准提升提供参考与依据,以期实现有效的质量控制,确保用药安全。
1 仪器与试药Waters 2695高效液相色谱仪(包括四元泵、PDA检测器、自动进样器及Empower工作站;Waters公司),Mettler MS105DU电子天平(Mettle-Toledo公司),KQ-300DA型数控超声波清洗器(昆山市超声仪器有限公司)。Umetrics Ezinfo数据处理软件(Waters公司)。
甲醇为色谱级,水为Milli-Q超纯水,其他试剂均为分析纯。对照品白花前胡甲素(批号111711-200602,含量以100%计)、白花前胡乙素(批号111904-201203,含量以98.0%计)、紫花前胡苷(批号111821-201604,含量以99.6%计)均来自中国食品药品检定研究院;白花前胡E素(批号DFZY-20180112,含量以99.9%计)购自成都瑞芬思生物技术有限公司。
实验所用样品信息详见表 1,采集时间为2017年8月—12月,并经中国食品药品检定研究院程显隆研究员鉴定。
|
|
表 1 样品来源 Tab.1 Sample source list |
采用Aglient TC-C18(2)色谱柱(4.5 mm×250 mm,5 μm),以水(A)-甲醇(B)为流动相,梯度洗脱(0~15 min,40%B;15~16 min,40%B→48%B;16~26 min,48%B→75%B;26~55 min,75%B→95%B;55~56 min,95%B→99%B;56~60 min,99%B),流速1.0 mL·min-1,检测波长325 nm,柱温30 ℃,进样量5 μL;理论塔板数以白花前胡甲素峰计算应不得小于4 000。
2.2 混合对照品溶液的制备取紫花前胡苷、白花前胡甲素、白花前胡乙素、白花前胡E素的对照品适量,精密称定,加甲醇溶解制成上述4个成分分别含0.509 9、0.465 5、0.501 2、0.504 9 mg·mL-1的混合对照品储备液。精密量取混合对照品储备液1.0 mL,置于10 mL量瓶中,加甲醇稀释至刻度线,摇匀,即得。
2.3 供试品溶液的制备取样品粉碎,过4号筛,取粉末约0.25 g,精密称定,置100 mL锥形瓶中,精密加入甲醇25 mL,称定质量,超声处理(功率240 W,频率45 kHz)20 min,放冷,再称定质量,用甲醇补足减失的量,摇匀,过0.22 μm微孔滤膜,取续滤液,即得。
3 特征图谱 3.1 方法学考察 3.1.1 精密度试验分别取QH-01、ZHQH-01及YQH-01号药材粉末约0.25 g,精密称定,分别按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件分别连续进样6次,记录色谱图,考察仪器的精密度。结果表明,各主要色谱峰保留时间的RSD均小于0.5%;各主要色谱峰峰面积的RSD均小于3.0%,采用Chempattern化学计量学软件进行数据处理,相似度均大于0.95,表明仪器的精密度良好。
3.1.2 重复性试验分别取QH-01、ZHQH-01及YQH-01号药材粉末6份,精密称定,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件分别进样分析,记录色谱图,考察方法的重复性。结果表明,6份样品中各主要色谱峰保留时间的RSD均小于0.5%,各色谱峰峰面积的RSD均小于1.5%,采用Chempattern化学计量学软件进行数据处理,相似度均大于0.95,表明重复性良好。
3.1.3 稳定性试验取精密度试验项下供试品溶液,按“2.1”项下色谱条件,分别在0、4、8、12、18 h进行测定,考察供试品溶液的稳定性。结果表明,各主要色谱峰保留时间的RSD均小于0.6%,各色谱峰峰面积的RSD均小于3.0%,采用Chempattern化学计量学软件进行数据处理,相似度均大于0.95,表明供试品溶液的稳定性良好。
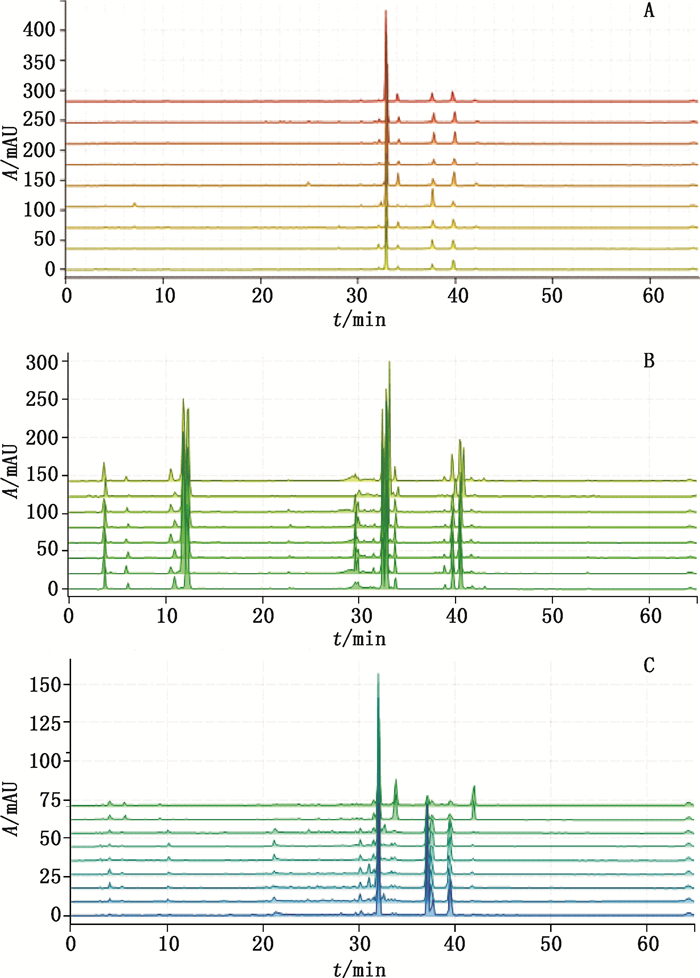
3.2 前胡类药材特征图谱的建立分别取前胡样品(QH-01~QH-09)、紫花前胡(ZHQH-01~ZHQH-08)及硬前胡(YQH-01~YQH-09)粉末,精密称定,按“2.3”项下方法制备供试品溶液,精密吸取5 μL,分别进样测定,记录60 min的HPLC色谱图(图 1)。
|
图 1 前胡(A)、紫花前胡(B)及硬前胡(C)的HPLC色谱图 Fig.1 HPLC chromatograms of Peucedani Radix(A), Peucedani Decursivi Radix(B)and Peucedani Subglabri Radix(C) |
根据色谱结果,采用Chempattern化学计量学软件进行数据分析处理,分别设定样品QH-01、ZHQH-01及YQH-01为参照图谱,分别将前胡、紫花前胡及硬前胡的色谱峰与参照图谱进行自动匹配,分别生成前胡、紫花前胡及硬前胡的特征图谱(图 2)。
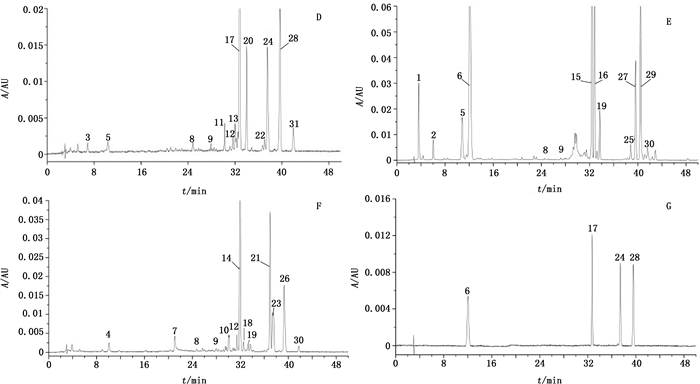
|
6.紫花前胡苷(nodakenin) 17.白花前胡甲素(praeruptorin A) 24.白花前胡乙素(praeruptorin B) 28.白花前胡E素(praeruptorin E) 图 2 前胡(D)、紫花前胡(E)及硬前胡(F)的HPLC特征图谱及混合对照品色谱图(G) Fig.2 HPLC specific fingerprints of Peucedani Radix(D), Peucedani Decursivi Radix(E), Peucedani Subglabri Radix(F)and mixed reference substances(G) |
取“2.2”项下混合对照品溶液,按“2.1”项下色谱条件进行分析,色谱图见图 2-G,与前胡、紫花前胡和硬前胡特征图谱进行比对,确认前胡中17号、24号及28号峰与混合对照品峰相一致,紫花前胡中6号峰与混合对照品峰相一致,硬前胡中未检出与混合对照品相一致的色谱峰。
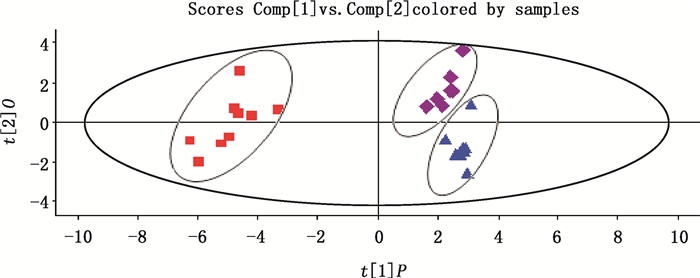
3.4 特征图谱分析依据26批次样品的供试品溶液的HPLC色谱图获得的相关参数(保留时间和峰面积),分别比较各样品的色谱图,采用Umetrics EZinfo软件进行主成分统计分析(PCA),将前胡、紫花前胡和硬前胡分设为3组,以相对峰面积大于2%的各主要色谱峰的保留时间和峰面积为变量,将数据导入软件进行分析,获得Score图和Loading图(见图 3、4)。由Score图可见:前胡、紫花前胡及硬前胡分别聚于不同的区域,组内具有统一性,组间差异明显,可使前胡类药材获得良好的区分,表明前胡、紫花前胡及硬前胡间的化学特征图谱主成分间存在明显的差异。
|
图 3 前胡(      |
|
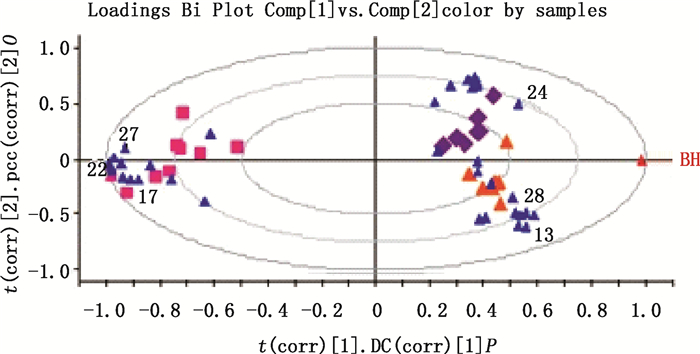
图 4 前胡(      |
在Loading图中选取距离原点较远的几个点,得到主成分中变量的权重值,权重值越大,则表明该成分在决定样品区分中所发挥的作用越大,其中起主要变量的权重值分别为特征图谱中的白花前胡甲素、白花前胡乙素、白花前胡E素、13和22号的色谱峰。
4 讨论 4.1 供试品提取方法考察本实验考察了不同提取溶剂(甲醇、三氯甲烷、50%乙醇)、不同的提取方法(超声、回流)及不同的提取时间(10、20、30 min)等因素对提取效率的影响,最终比较测定结果并结合环保的考虑,确定以甲醇为提取溶剂,超声提取20 min,提取效率最高,方法操作简单,结果可靠。
4.2 测定波长的确定采用二极管阵列检测器进行扫描,考察不同吸收波长处的图谱响应强度,紫花前胡苷、白花前胡甲素、白花前胡乙素及白花前胡E素分别在335.7、322.5、320.1及322.5 nm处有最大吸收(见图 5),本研究侧重于前胡药材中的主要香豆素类化合物,对321、325和335 nm处的谱图信息比较发现,在325 nm处各成分具有良好的紫外吸收,基线平稳,且色谱图信息更丰富。
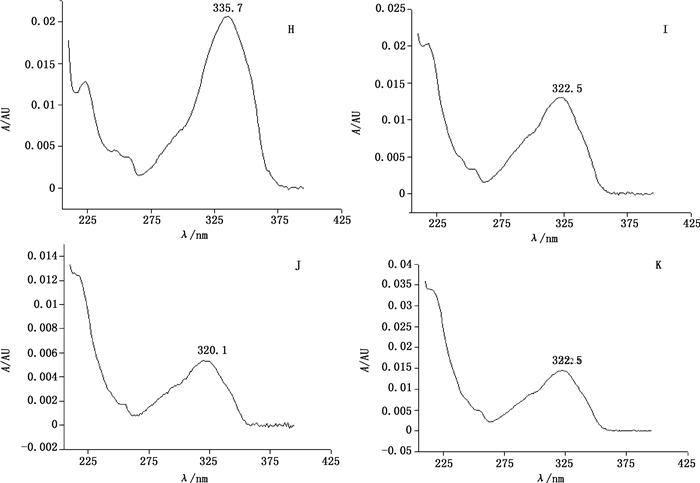
|
图 5 紫花前胡苷(H)、白花前胡甲素(I)、白花前胡乙素(J)及白花前胡E素(K)的紫外光谱图 Fig.5 The UV spectra of nodakenin(H), praeruptorin A(I), praeruptorin B(J)and praeruptorin E(K) |
本实验通过对不同比例的流动相系统(甲醇-水溶液、乙腈-水、甲醇-醋酸水溶液)的分离效果进行系统的考察,发现采用甲醇-水体系即可实现良好的分离效果。另外,因每种中药材所含物质基础复杂,等度洗脱耗时长,分离度较差,无法满足有效分离,故采用梯度洗脱;按照优化后的色谱条件,主要目标色谱峰的基线平稳,分离度良好,可满足检测的要求。
4.4 数理统计方法的应用前胡药材含有多种化学成分,采用单一指标成分进行质量控制,很难体现中药复杂体系的特点。在本研究中,引入主成分分析方法,将前胡、紫花前胡、硬前胡所含主要化学成分进行综合分析,通过全成分的整体差异性,来达到区分不同前胡类药材的目的。
4.5 小结本实验采用特征图谱结合主成分分析法,可有效地区分前胡、紫花前胡、硬前胡,并可以找出对整体差异性贡献比较大的化学成分,为选择指标成分进行质量控制提供了科学依据。
| [1] |
陶弘景. 名医别录[M]. 北京: 人民卫生出版社, 1986. TAO HJ. Mingyi Bielu[M]. Beijing: People's Medical Publishing House, 1986. |
| [2] |
中华人民共和国药典2015年版.一部[S].2015: 265 ChP 2015.Vol Ⅰ[S].2015: 265 |
| [3] |
中国科学院中国植物志编辑委员会. 中国植物志.第55卷.第3分册[M]. 北京: 科学出版社, 1996: 147. Flora of China Editorial Committee. Flora Reipublicae Popularis Sinicae.55(3)[M]. Beijing: Science Press, 1996: 147. |
| [4] |
陈政雄, 黄宝山, 佘其龙, 等. 中药白花前胡化学成分的研究[J]. 药学学报, 1979, 14(8): 486. CHEN ZX, HUANG BS, SHE QL, et al. The chemical constituents of bai-hua-qian-hu, the root of Peucedanum praeruptorum Dunn(Umbelliferae)-four new coumarlns[J]. Acta Phram Sin, 1979, 14(8): 486. |
| [5] |
KONG LY, LI Y, MIN ZD, et al. Coumarins from Peucedanum praeruptorum[J]. Phytochemistry, 1996, 41(5): 1423. DOI:10.1016/0031-9422(95)00783-0 |
| [6] |
LU M, NICOLETTI M, BATTINELLI L, et al. Isolation of praeruptorins A and B from Peucedanum praeruptorum Dunn and their general pharmacological evaluation in comparison with extracts of the drug[J]. IL Farmaco, 2001, 567(5-7): 417. |
| [7] |
LIU RM, FENG L, SUN AL, et al. Preparative isolation and purification of coumarins from Peucedanum praeruptorum Dunn by high-speed counter-current chromatography[J]. J Chromatogr A, 2004, 1057(1-2): 89. DOI:10.1016/j.chroma.2004.09.047 |
| [8] |
ZHANG C, LI L, XIAO YQ, et al. A new phenanthraquinone from the roots of Peucedanum praeruptorum[J]. Chin Chem Lett, 2010, 21(7): 816. DOI:10.1016/j.cclet.2010.03.020 |
| [9] |
甘肃省中药材标准2008年版[S].2008: 119 Standard for Chinese Medicinal Materials of Gansu Province 2008[S].2008: 119 |
| [10] |
陕西省药材标准2015年版[S].2015: 176 Standard for Chinese Medicinal Materials of Shaanxi Province 2015[S].2015: 176 |
| [11] |
四川省中药材标准1987年版[S].1987: 47, 50, 61, 98 Standard for Chinese Medicinal Materials of Sichuan Province 1987[S].1987: 47, 50, 61, 98 |
| [12] |
湖南省中药材标准2009年版[S].2009: 226 Standard for Chinese Medicinal Materials of Hunan Province[S].2009: 226 |
 2019, Vol. 39
2019, Vol. 39 
