青霉素类抗生素的聚合物杂质容易诱发过敏反应,是影响药物安全性的潜在风险因素之一[1-4]。聚合物杂质属于内源性杂质,在药品原料与制剂的生产、运输、存储过程中均可能产生。为保证药品的安全性,应对青霉素类药物的聚合物杂质进行严格控制。
聚合物质控的理念逐渐由控制聚合物的总量向精准控制指针性聚合物杂质的方向发展[5]。目前已报道的注射用哌拉西林钠他唑巴坦钠聚合物分析方法包括葡聚糖凝胶G10色谱法(Sephadex G10色谱法)[6]、高效凝胶色谱法(HPSEC法)[7]。美国药典(USP)41版采用RP-HPLC法对注射用哌拉西林钠他唑巴坦钠中的二聚体及其衍生物进行了质控[8]。《中华人民共和国药典》(简称《中国药典》)2015年版、欧洲药典(EP)9.2版、英国药典(BP)2018版、日本薬局方(JP)ⅩⅥ版均未对该复方制剂的聚合物杂质进行专门质控。
据报道,Sephadex G10色谱系统存在柱效低,分离效果差等缺点;HPSEC法同时具备分子排阻和反相吸附2种分离机理,对聚合物杂质具有较好的分离能力,但是聚合物色谱峰易受到药物中其他极性较大的小分子杂质的共出峰干扰,从而影响聚合物杂质的定量分析[9];采用RP-HPLC法对聚合物指针式杂质进行分析是近年来研究的热点,但是该类方法能否检出更高聚合态的聚合物杂质缺乏方法专属性研究。在前期研究中,已对青霉素类抗感染药物聚合物杂质做过研究工作,证明采用《中国药典》2015年版的RP-HPLC有关物质测定方法可对指针性聚合物杂质进行精准控制[10-11]。
本研究系统地比较了HPSEC法和RP-HPLC法对该复方制剂的分离检测能力。首先人工制备了哌拉西林钠他唑巴坦钠降解浓溶液为参考溶液,然后建立HPSEC法分析样品中的聚合物杂质,并采用二维高效液相色谱法(2D-HPLC法)、柱切换-LC/MSn法对降解浓溶液中的聚合物杂质结构进行鉴定,对HPSEC法分析聚合物杂质的方法专属性进行验证;接下来对USP 41版收载的有关物质方法进行方法优化,建立用于聚合物分析的RP-HPLC法,考察并验证RP-HPLC法分析更高聚合态杂质的方法专属性。在此基础上,建立适用于注射用哌拉西林钠他唑巴坦钠制剂的聚合物杂质分析方法。
1 仪器、样品与试剂 1.1 仪器Dionex公司Summit 100型二维色谱系统,包括P680型双三元低压梯度泵、ACI-100型自动进样器、Tcc-100型柱温箱及PDA-100型二极管阵列检测器,工作站为Chromeleon 6.8版;柱切换LC-MS系统Ⅰ由资生堂HPLC色谱系统(包括NanoSpace S1-2二元高压梯度泵、自动进样器、柱温箱、切换阀和PDA检测器)和ABsciex公司Qtrap 3200型MS/MS质谱仪组成,工作站为Analyst 1.6版;柱切换LC-MS系统Ⅱ由Dionex公司U3000液相色谱仪(包括双三元低压梯度泵、自动进样器、柱温箱、切换阀和UV检测器)和Thermal公司Q Exactive Focus高分辨质谱仪组成,工作站为Xcalibur 4.0版。
1.2 样品与试剂注射用哌拉西林钠他唑巴坦钠样品(批号AKHJ/11)由中国食品药品检定研究院提供。乙腈(色谱纯)购自美国Fisher公司,其他化学试剂(分析纯)均购自国药集团化学试剂公司,水为实验室自制双蒸水。
2 实验方法 2.1 HPSEC法色谱柱:TSK-gel G2000 SWxl(填料:刚性、球形、亲水硅胶;7.8 mm×30 cm);流动相:pH 7.0磷酸盐缓冲液[0.01 mol·L-1磷酸氢二钠溶液-0.01 mol·L-1磷酸二氢钠溶液(61:39)];流速:0.8 mL·min-1;检测波长:220 nm;柱温:30 ℃;进样量:20 μL。稀释溶剂:水;样品浓度:2.0 mg·mL-1。用于HPSEC法分析聚合物杂质。
2.2 RP-HPLC法色谱柱:CAPCELL MGII C18(4.6 mm×250 mm,5 μm);流动相:A相为3.12 g·L-1磷酸二氢钠缓冲液(用磷酸调节pH至3.5),B相为甲醇,梯度洗脱(0~5.0 min,90%A→85%A;5.0~10.0 min,85%A→65%A;10.0~35.0 min,65%A→55%A;35.0~60.0 min,55%A→35%A;60.0~85.0 min,35%A→15%A;85.0~86.0 min,15%A→90%A;86.0~100.0 min,90%A);流速:1.0 mL·min-1;柱温:30 ℃;检测波长:220 nm。用于分析注射用哌拉西林钠他唑巴坦钠的指针性聚合物杂质。
2.3 2D-HPLC法色谱系统Ⅰ同“2.1”项色谱系统;色谱系统Ⅱ同“2.2”项色谱系统。切换阀的连接方式如图 1所示,切换程序:①将切换阀设为A位置,采用右泵,以TSK凝胶色谱系统(色谱系统Ⅰ)对供试品进行分离,同时采用色谱系统Ⅱ对RP C18色谱柱进行平衡。②当采用色谱系统Ⅰ分离的目标杂质出峰后,将切换阀设为B位置。③采用色谱系统Ⅱ将柱后定量环中的目标杂质洗脱至第2根色谱柱中,并采用色谱系统Ⅱ进行分离分析。用于对HPSEC色谱系统分离的弱保留值杂质在RP-HPLC色谱系统中进行定位。

|
图 1 2D-HPLC中10孔切换阀示意图 Fig.1 Schemes of the Dimensional HPLC system |
用于分析TSK凝胶色谱系统中的聚合物。
2.3.1.1 色谱系统Ⅲ同“2.1”项色谱系统,进样量增加至50 μL,用于杂质的分离。
2.3.1.2 色谱系统Ⅳ色谱柱:CAPCELL C18(4.6 mm×150 mm,5 μm);流动相:A相为水-冰醋酸(100:1.7),B相为乙腈-冰醋酸(100:1.7),梯度洗脱[0~(tR+5)min(tR为目标杂质在色谱系统Ⅲ的保留时间),100%A相(脱盐处理);(tR+5)~(tR+20)min,100%A→10%A;(tR+20)~(tR+25)min,10%A;(tR+25)~(tR+26)min,10%A→100%A;(tR+26)~(tR+40)min,100%A];柱温:室温;流速:0.7 mL·min-1;切换阀:六通阀A和B,切换用定量环体积500 μL。用于对HPSEC系统分离的聚合物杂质进行脱盐处理、质谱定性研究。
2.3.1.3 质谱条件(Qtrap 3200)+EMS和+EPI扫描范围:m/z 50~1700;气帘气:20 L·min-1;离子源电压:+5 000V;离子源温度:500.00 ℃;气路1:65 L·min-1;气路2:60 L·min-1;碰撞气强度:强;解簇电压:+50.0 V;入口电压:+10.0 V;碰撞室入口电压:+10.00 V;碰撞能:+30.00 V;碰撞室出口电压:+0.00 V。
2.3.2 柱切换-LC/MS-Ⅱ法用于对RP-HPLC中聚合物色谱峰的确认
2.3.2.1 色谱系统Ⅴ同“2.2”项色谱系统,进样体积增加至50 μL,用于杂质的分离。
2.3.2.2 色谱系统Ⅵ同色谱系统Ⅳ,其中tR为目标杂质在色谱系统Ⅴ的保留时间。用于对RP-HPLC色谱系统分离的聚合物杂质进行脱盐处理及质谱定性研究。
2.3.2.3 质谱条件(Q Exactive Focus)调谐方法:扫描电压(+)3 000.00 V,毛细管温度(+)350.00 ℃,鞘气(+)35.00 L·h-1,辅助气(+)10.00 L·h-1,最大喷雾电流(+)100.00 A,探针加热器温度(+)350.00 ℃,S-棱镜RF水平50.00,离子源为HESI;一级质谱方法:正离子模式,分辨率70 000,扫描范围m/z 200~2 000,AGC目标1e6;二级质谱方法:分辨率17 500,分离窗口m/z 3.0,(N)CE 25 V,缺省电荷状态1,AGC目标5e4。
3 溶液配制 3.1 降解浓溶液(1)取注射用哌拉西林钠他唑巴坦钠样品1瓶(内含哌拉西林钠4.0 g,他唑巴坦钠0.5 g),加入纯净水40.0 mL,溶解后在室温下放置3 d,备用。
3.2 降解浓溶液(2)取样品1瓶(内含哌拉西林钠4.0 g,他唑巴坦钠0.5 g),加入纯净水40.0 mL,溶解后在室温下放置26 d,备用。
4 结果与讨论 4.1 HPSEC分析注射用哌拉西林钠他唑巴坦钠聚合物本研究首先参照《中国药典》2015年版二部中头孢地嗪有关物质Ⅱ的方法,对流动相的pH、缓冲盐的浓度、强溶剂比例与检测波长等因素进行了优化,最后建立了HPSEC法,见“2.1”项。
4.1.1 流动相的pH因为哌拉西林钠和他唑巴坦钠均为离子型化合物,在HPSCE系统中的色谱保留行为易随着流动相pH的改变而发生变化,所以首先对流动相系统的pH进行优化筛选。分别选用4个pH(pH 4.0、5.0、6.0、7.0)的磷酸盐缓冲液[0.005 mol·L-1磷酸氢二钠溶液-0.005 mol·L-1磷酸二氢钠溶液(61:39)]分别与乙腈比例为95:5的4种流动相分离降解溶液(1)中的弱保留值杂质。结果显示,随缓冲盐pH由4.0升高到7.0,哌拉西林钠和他唑巴坦钠逐渐由2个色谱峰合并为1个峰,同时弱保留值杂质的峰形由多个分离度较差的小峰合并为1个对称的单峰,说明pH 7.0的缓冲溶液更有利于弱保留值杂质的分离,结果见图 2-a。
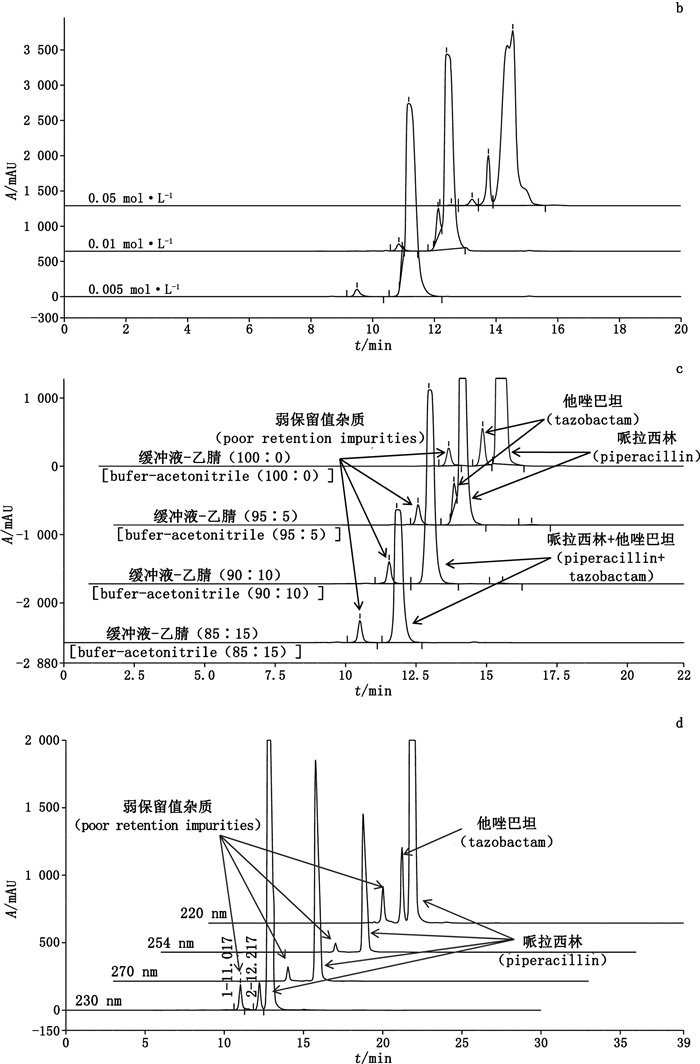
|
a. pH b.缓冲盐浓度(buffer concentration) c.强溶剂比例(strong solvent proportion) d.检测波长(detection wavelength) 图 2 HPSEC法优化的典型色谱图 Fig.2 Typical chromatograms of HPSEC method optimized |
流动相的洗脱能力会因为缓冲盐的离子强度不同而发生改变,因此本研究对磷酸盐缓冲液的离子浓度(0.005、0.01、0.05 mol·L-1)进行了筛选。结果表明,当缓冲盐的离子浓度为0.05 mol·L-1时,主峰发生裂分,不适合作为流动相;0.005和0.01 mol·L-1的缓冲盐均能较好地分离弱保留值杂质峰和主峰;但是与0.005 mol·L-1的缓冲液相比,0.01 mol·L-1的缓冲液对哌拉西林和他唑巴坦2个主峰也有一定的分离能力;因此,选择了0.01 mol·L-1的磷酸盐缓冲液(pH 7.0)作为流动相,结果见图 2-b。
4.1.3 流动相的强溶剂比例流动相中强溶剂的比例也是影响方法洗脱能力的关键因素之一,因此本研究对0.01 mol·L-1的磷酸盐缓冲液(pH 7.0)与强溶剂乙腈的比例(100:0、95:5、90:10、85:15)进行了筛选。当强溶剂比例由0%增加至15%的过程中,他唑巴坦和哌拉西林2个主峰逐渐融合为1个色谱峰。当不采用强溶剂时,他唑巴坦与哌拉西林2个主峰能够实现基线分离。因此最终选择流动相中不使用强溶剂,见图 2-c。
4.1.4 检测波长的选择为了提高聚合物杂质的检测灵敏度,本文设定了220、230、254、270 nm 4个检测波长,对样品进行测定,如图 2-d所示。在220 nm和230 nm波长处主峰前杂质峰和他唑巴坦峰的响应最强,在254 nm和270 nm波长处他唑巴坦无响应,由于体现哌拉西林结构的最大特征吸收波长为220 nm和275 nm,同时参考USP 41版注射用哌拉西林钠他唑巴坦钠制剂有关物质的检测波长(220 nm),最终选定220 nm为检测波长。
4.2 柱切换-LC/MSn法鉴别哌拉西林钠他唑巴坦钠聚合物的化学结构以哌拉西林钠他唑巴坦钠强制降解溶液(2)为供试品,采用“2.1”项下条件进行分析,在哌拉西林钠他唑巴坦钠主峰前分离得到弱保留值杂质HPSEC-1~4,见图 3,然后采用“2.3.1”项的柱切换-LC/MS-Ⅰ法鉴别各组分的化学结构。分离得到的杂质结构见图 4,杂质归属见表 1。
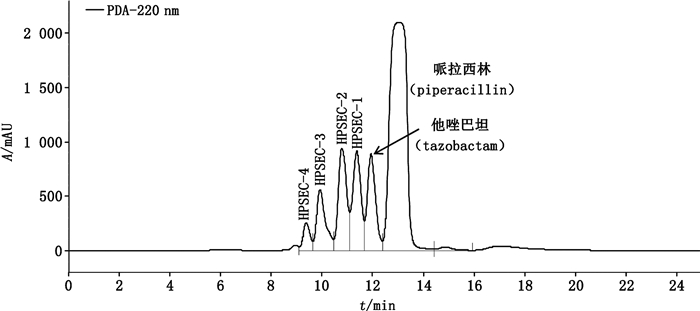
|
图 3 HPSEC法分析降解浓溶液(2)的典型色谱图 Fig.3 Typical chromatogram of degradation stock solution(2)by HPSEC method |
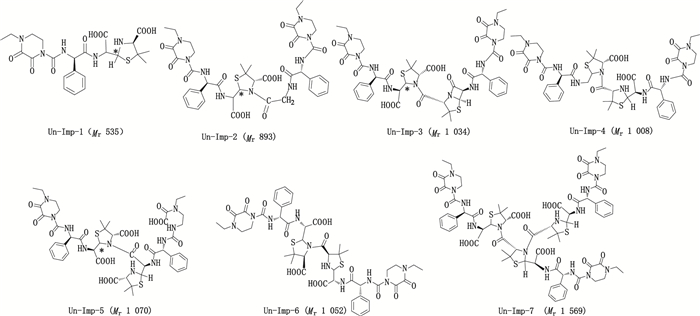
|
图 4 降解浓溶液(2)中弱保留值杂质的化学结构 Fig.4 Chemical structures of poor retention impurities in degradation stock solution(2) |
|
|
表 1 降解浓溶液(2)中相关杂质汇总表 Tab.1 List of impurities in degraded stock solution(2) |
在HPSEC-1的质谱TIC图中共分离得到3个色谱峰,色谱保留时间分别为HPSEC-1a(28.25 min),HPSEC-1b(29.0 min),HPSEC-1c(29.75 min)。弱保留值杂质HPSEC-1的TIC图、+EMS及+EPI质谱图见图 5。
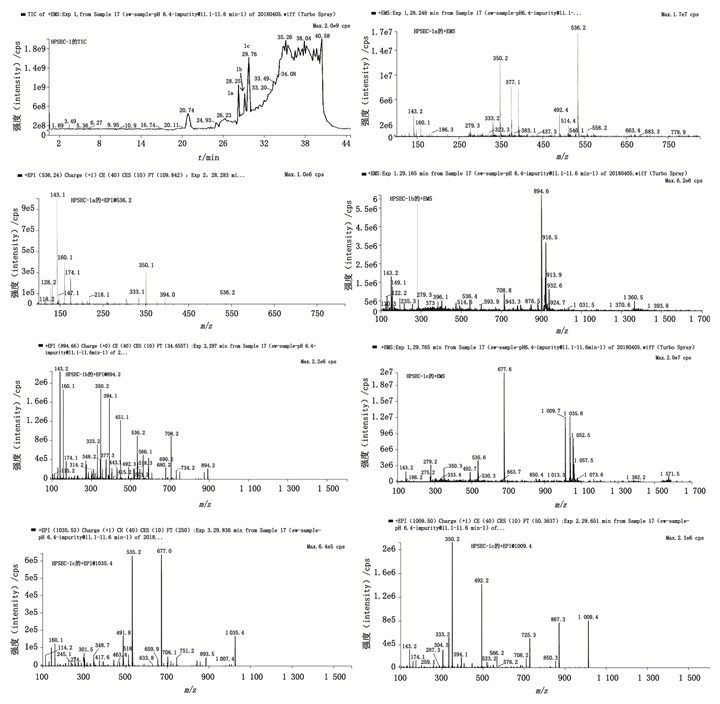
|
图 5 弱保留值杂质HPSEC-1的TIC图、典型+EMS与+EPI质谱图 Fig.5 TIC, typical +EMS and +EPI mass spectra of poor retention impurity HPSEC-1 |
在HPSEC-1a(28.25 min)的一级质谱图中存在m/z 536.2、m/z 558.2、m/z 574.2的系列加合离子峰,分别为[M+H]+、[M+Na]+、[M+K]+峰,说明其相对分子质量为535.2,比哌拉西林的相对分子质量517.3多18,命名为Un-Imp-1。二级质谱图中存在m/z 492.2[M+H-44]+的碎片离子,是典型的脱羧基的碎片离子,说明杂质结构中多了一分子的活泼羧基。因为青霉素类抗生素在水溶液中易发生四元内酰胺环的开环反应,生成水解产物,所以推测杂质Un-Imp-1为哌拉西林水解开环物,化学结构见图 4,质谱裂解途径见图 6-A。
|
A. Un-Imp-1 B. Un-Imp-2 C. Un-Imp-3 D. Un-Imp-4 E. Un-Imp-5 F. Un-Imp-6 图 6 弱保留值杂质的典型质谱裂解途径 Fig.6 Typical mass fragmentation pathway of poor retention impurities |
在HPSEC-1b(29.0 min)的一级质谱图中存在m/z 894.6、m/z 916.5、m/z 932.6的系列加合离子峰,分别为[M+H]+、[M+Na]+、[M+K]+峰,说明其相对分子质量为893,根据氮规则可知分子中含有奇数个氮。在二级质谱图中存在m/z 536(哌拉西林开环物)、m/z 160(五元噻唑环)的碎片离子,说明其哌拉西林结构有关,命名为Un-Imp-2。经二级质谱数据归属,推测其结构为哌拉西林开环二聚体脱噻唑酸物,具体结构见图 4,质谱裂解途径见图 6-B。在HPSEC-1c(29.75 min)的一级质谱图中存在m/z 1 035.4和m/z 1 009.4的加合离子峰,说明存在2种不同的聚合物杂质,分别命名为Un-Imp-3和Un-Imp-4。参考USP 41收载的杂质结构,可知m/z 1 035.4的杂质Un-Imp-3为哌拉西林闭环二聚体,结构见图 4,质谱裂解途径参见图 6-C。杂质Un-Imp-4(m/z 1 009.4)相对分子质量比哌拉西林闭环二聚体少26,推测为哌拉西林开环二聚体脱羧物,结构参见图 4,质谱裂解途径参见图 6-D。
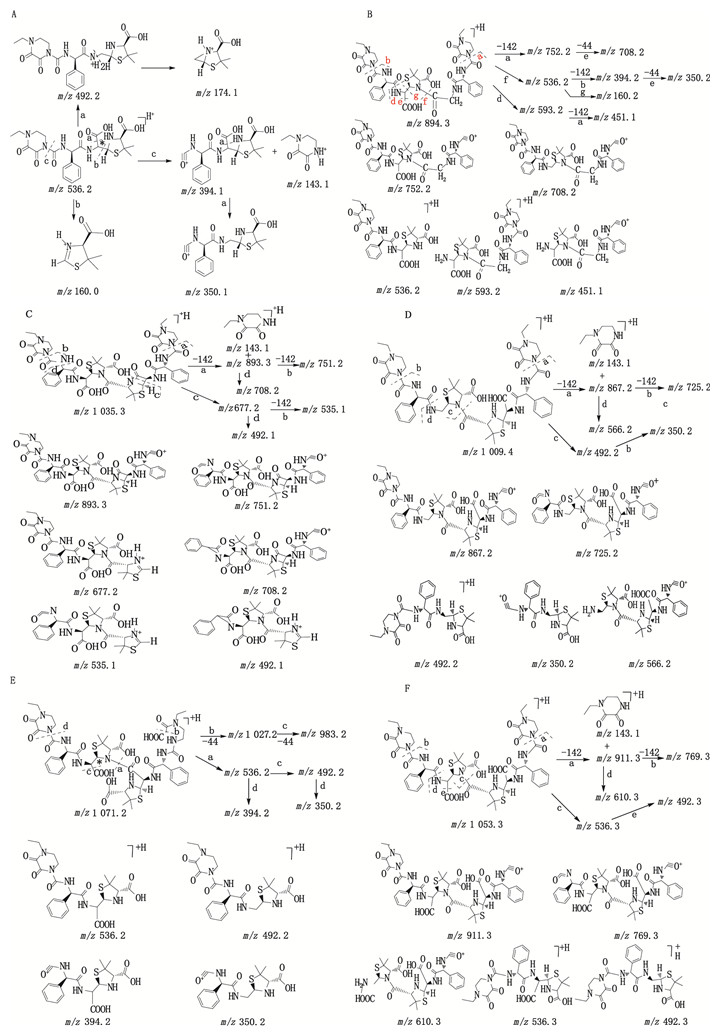
4.2.2 弱保留值杂质HPSEC-2弱保留值杂质HPSEC-2的+EMS图及+EPI质谱如图 7所示。质谱数据显示,在一级质谱图中,存在m/z 1 071.4的加合离子峰,为[M+H]+峰,说明其相对分子质量为1 070.4,为哌拉西林相对分子质量的2倍。根据二级质谱数据,推测为哌拉西林二聚体的开环水解物,命名为Un-Imp-5,其化学结构参见图 4,质谱裂解途径参见图 6-E。
|
图 7 弱保留值杂质HPSEC-2的典型+EMS与+EPI质谱图 Fig.7 Typical +EMS and +EPI mass spectra of poor retention impurity HPSEC-2 |
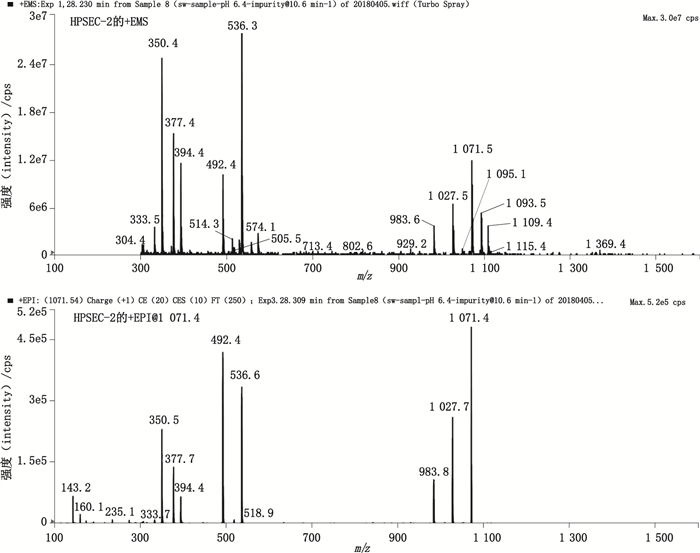
弱保留值杂质HPSEC-3的+EMS及+EPI质谱图如图 8所示。一级质谱图中存在m/z 1 053、m/z 1 075.4的加合离子峰,分别为[M+H]+和[M+Na]+峰,说明其相对分子质量为1 052,命名为Un-Imp-6。该杂质的相对分子质量与USP 41版的杂质n一致,推测该杂质为哌拉西林二聚体开环水解物。其化学结构参见图 4,质谱裂解途径参见图 6-F。
|
图 8 弱保留值杂质HPSEC-3的典型+EMS与+EPI质谱图 Fig.8 Typical +EMS and +EPI mass spectra of poor retention impurity HPSEC-3 |
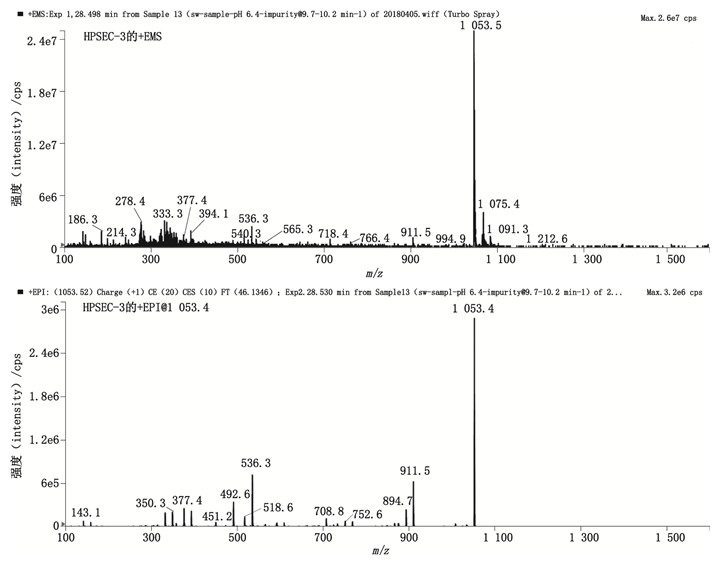
弱保留值杂质HPSEC-4的+EMS及+EPI质谱图如图 9所示。该杂质的质谱图中存在m/z 1 570.6、m/z 1 592.5的加合离子峰,分别为[M+H]+和[M+Na]+峰,说明其相对分子质量为1 569.6,命名为Un-Imp-7。该杂质的相对分子质量比哌拉西林闭环二聚体(相对分子质量1 034)多535,推测该杂质为哌拉西林三聚体开环水解物。其化学结构参见图 4。
|
图 9 弱保留值杂质HPSEC-4的典型+EMS与+EPI质谱图 Fig.9 Typical +EMS and +EPI mass spectra of poor retention impuriy HPSEC-4 |
HPSEC结合MS分析,在哌拉西林钠他唑巴坦钠降解溶液中共发现有哌拉西林开环三聚体(Un-Imp-7)、哌拉西林闭环二聚体(Un-Imp-3)、哌拉西林开环二聚体(Un-Imp-5、Un-Imp-6)、哌拉西林开环二聚体脱羧物(Un-Imp-4)。在阿莫西林克拉维酸钾的聚合物研究中[10]未发现与克拉维酸相关的聚合物杂质,与此类似,本研究同样未发现与他唑巴坦相关的聚合物杂质,具体原因有待于进一步研究。
4.3 HPSEC法的专属性分析HPSEC法分析降解溶液(2)的结果表明,聚合物杂质均在他唑巴坦和哌拉西林主峰前出峰,不同聚合态的杂质基本上按照相对分子质量由大到小的顺序依次出峰,说明HPSEC法对聚合物杂质具有一定的分离能力,但是降解浓溶液(2)的质谱分析结果证明,在HPSEC-1中存在小分子杂质哌拉西林开环水解物,该小分子杂质为降解杂质,极易产生,含量较高;在HPSEC色谱系统中无法与其他聚合物杂质有效分离,严重影响了聚合物杂质的含量测定准确性。因此,HPSEC法分析聚合物杂质的方法专属性较差,不适合用于注射用哌拉西林钠他唑巴坦钠制剂的聚合物质控。
4.4 RP-HPLC法分析哌拉西林钠他唑巴坦钠的聚合物杂质HPSEC法分析哌拉西林钠他唑巴坦钠聚合物杂质的方法专属性较差,因此尝试建立RP-HPLC法,并采用2D-HPLC法和柱切换-LC/MS法对RP-HPLC的专属性进行研究。
4.4.1 建立RP-HPLC法分离聚合物杂质在USP 41版注射用哌拉西林钠他唑巴坦钠有关物质测定方法的基础上,通过增大有机相的比例,延长洗脱时间的方法,优化建立了聚合物分析的RP-HPLC法,见“2.2”项。
4.4.2 2D-HPLC法验证RP-HPLC法分离聚合物杂质的专属性为了考察RP-HPLC法分离聚合物杂质的专属性,本文采用2D-HPLC法(“2.3”项方法),将HPSEC法分离的聚合物杂质HPSEC-1~4,转移至RP-HPLC系统中进行分析,归属各种聚合物杂质的出峰位置,如图 10所示。降解溶液(2)的典型切换色谱图中在哌拉西林主峰后检出多个杂质峰,参见图 10-a;虽然HPSEC-1的质谱TIC图中可见3个色谱峰,但在其二维色谱图中主要为保留值小于哌拉西林色谱峰的2个杂质峰Rs-1(tR=23.21 min)、Rs-2(tR=24.41 min),见图 10-e,推测其可能为Un-Imp-1,即哌拉西林开环物;在HPSEC-2的二维色谱图中,除检出了他唑巴坦峰外,还发现多个保留值大于哌拉西林的杂质峰,最主要的杂质峰为Rs-4(tR=53.98 min),见图 10-b,推测其可能为哌拉西林二聚体;在HPSEC-3的二维色谱图中,检出了保留值大于哌拉西林的3个杂质峰Rs-5~7(tR=44.6 min,tR=46.26min,tR=48.66min),见图 10-c,推测其中含有哌拉西林开环二聚体;在HPSEC-4的二维色谱图中,检出了保留值大于哌拉西林的4个主要杂质峰,最主要的杂质峰为Rs-8,参见图 10-d,推测其中含有哌拉西林三聚体。
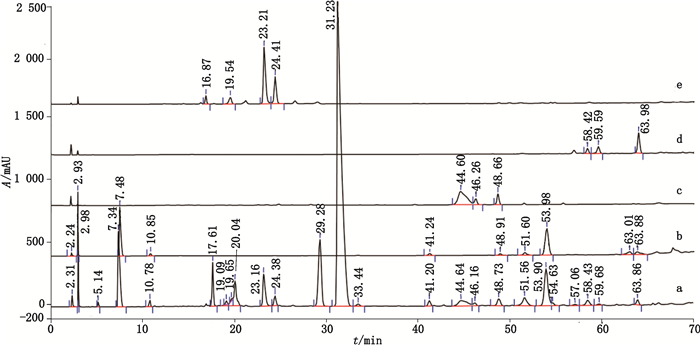
|
a.降解溶液(2)[degradation stock solution(2)] b. HPSEC-2 c. HPSEC-3 d. HPSEC-4 e. HPSEC-1 图 10 2D-HPLC法分离的相关杂质汇总色谱图 Fig.10 Typical pool chromatograms of poor retention impurities by 2D-HPLC |
上述2D-HPLC研究表明,HPSEC中的诸杂质不仅均能在RP-HPLC法中检出,且RP-HPLC具有更好的专属性,并初步证明优化后的RP-HPLC法适用于聚合物的分析。
4.4.3 柱切换-LC/MS法验证RP-HPLC法分离聚合物杂质的专属性为了确认RP-HPLC法检出的聚合物杂质结构,根据2D-HPLC法的归属结果,采用柱切换-LC/MSn法-Ⅱ对RP-HPLC法分离的部分杂质进行定性分析,从而在RP-HPLC系统中对聚合物杂质进行精确定位。分别对图 10-a中与HPSEC-1~4相对应的8个杂质进行了质谱鉴别。
结果表明,与HPSEC-1相对应的2个杂质Rs-1、2(tR=23.16 min,tR=24.38 min)的一级质谱图如图 11-a、b所示,2个杂质的准分子离子峰均为m/z 536.17[M+H]+,表明2个杂质的相对分子质量为535,与Un-Imp-1的相对分子质量一致,因此证明二者为哌拉西林开环物,不是聚合物杂质。
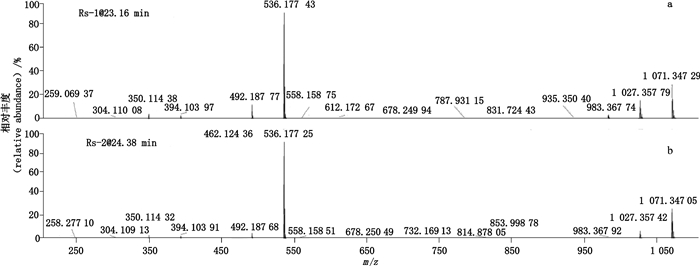
|
图 11 RP-HPLC法分析降解浓溶液(2)中杂质Rs-1(a)和Rs-2(b)的典型+EMS质谱图 Fig.11 Typical +EMS mass spectra of impurities Rs-1(a)and Rs-2(b)in stress degradation solution(2)by RP-HPLC |
与HPSEC-2相关联的2个杂质Rs-3、4(tR=51.60 min,tR=53.98 min)的质谱图如图 12-a、b所示,2个杂质的准分子离子峰分别为m/z 1 009.35[M+H]+和m/z 1 035.32[M+H]+,表明2个杂质的相对分子质量为1 008和1 034,与Un-Imp-4、3的相对分子质量一致,证明二者为哌拉西林开环二聚体脱羧物和哌拉西林闭环二聚体,其他几个杂质的质谱数据需要进一步解析,目前无法得出合理的化学结构。
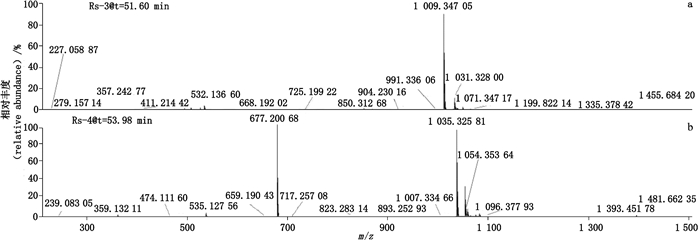
|
图 12 RP-HPLC法分析降解浓溶液(2)中杂质Rs-3(a)和Rs-4(b)的典型+EMS质谱图 Fig.12 Typical +EMS mass spectra of impurities Rs-3(a)and Rs-4(b)in stress degradation solution(2)by RP-HPLC |
与HPSEC-3相关联的3个杂质Rs-5~7(tR=44.60 min,tR=46.26 min,tR=48.66 min)的质谱图如图 13-a~c所示,3个杂质的准分子离子峰均为m/z 1 053.35[M+H]+、m/z 1 053.32[M+H]+以及m/z 1 009.35[M+H]+,表明3个杂质的相对分子质量为1 052、1 052以及1 008,与Un-Imp-6、4的相对分子质量一致,因此证明三者分别为哌拉西林开环二聚体和哌拉西林开环二聚体脱羧物异构体。
|
图 13 RP-HPLC法分析降解浓溶液(2)中杂质Rs-5(a)、Rs-6(b)及Rs-7(c)的典型+EMS质谱图 Fig.13 Typical +EMS mass spectra of impurities Rs-5(a), Rs-6(b)and Rs-7(c)in stress degradation solution(2)by RP-HPLC |
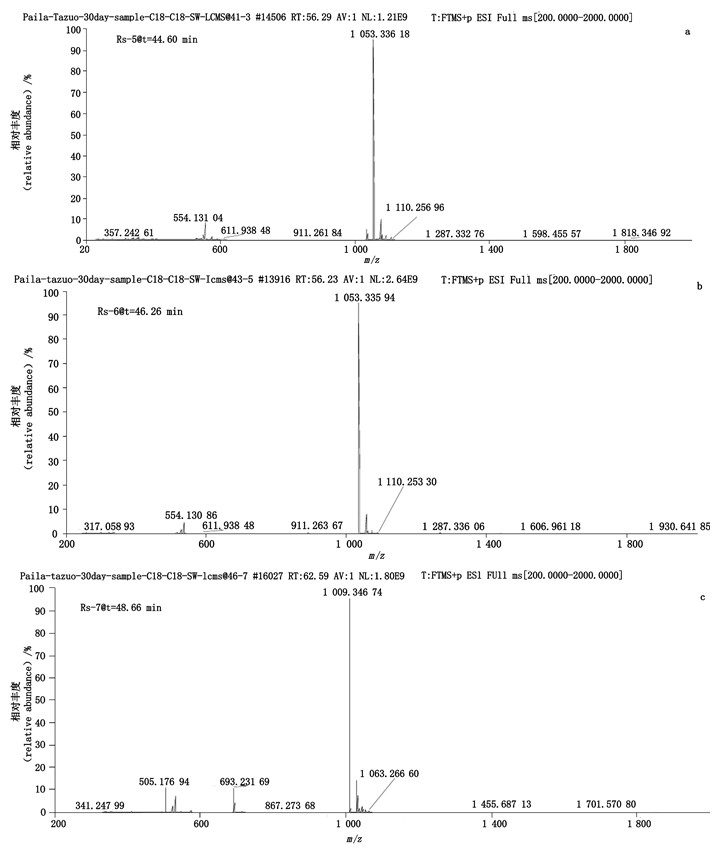
与HPSEC-4相关联的杂质Rs-8(tR=63.98 min)的质谱图如图 14所示,该杂质的加合离子峰均为m/z 1 570.49[M+H]+,表明该杂质的相对分子质量为1 569,与Un-Imp-7的相对分子质量一致,因此证明该杂质为哌拉西林开环三聚体。
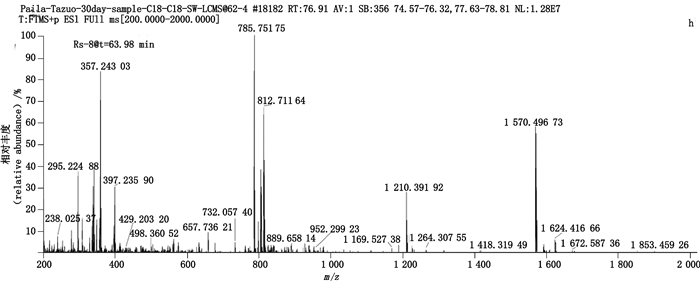
|
图 14 RP-HPLC法分析降解浓溶液(2)中杂质Rs-8的典型+EMS质谱图 Fig.14 Typical +EMS mass spectrum of impurity Rs-8 in stress degradation solution(2)by RP-HPLC |
本文通过上述的质谱分析,将HPSEC法分离的聚合物杂质精确定位至RP-HPLC的色谱图中。在5种聚合物杂质中,哌拉西林二聚体的含量最高,而且其他的聚合物杂质均由哌拉西林闭环二聚体生成,因此可将哌拉西林闭环二聚体作为聚合物控制的指针性杂质,聚合物杂质的具体归属结果参见图 15,哌拉西林的推测聚合及降解反应途径参见图 16。
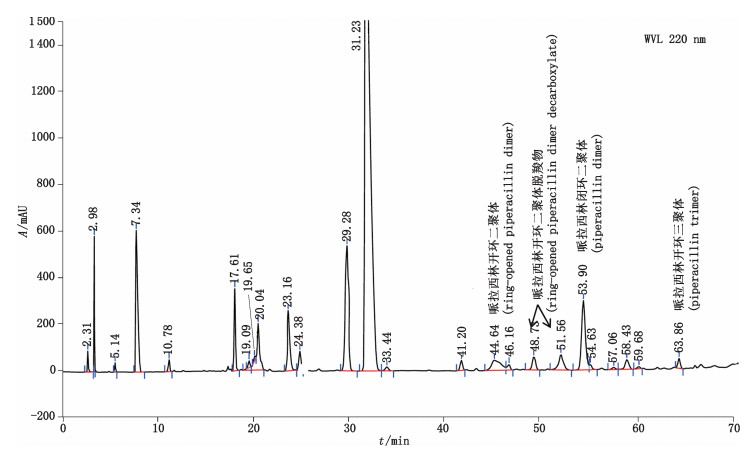
|
图 15 降解溶液(2)聚合物杂质的典型色谱图 Fig.15 Typical chromatogram of polymer impurities in degradation stock solution(2) by RP-HPLC |

|
图 16 哌拉西林的推测聚合及降解反应途径 Fig.16 Schemes of predictive polymerization and degradation pathway of piperacillin |
本文综合运用HPSEC法、2D-HPLC、柱切换-LC/MSn法等现代色谱分析技术,证明了基于TSK2000 SWxl型高效凝胶柱系统的HPSEC法分析哌拉西林钠他唑巴坦钠原料及制剂的聚合物杂质的方法专属性差,新建立的RP-HPLC法分析哌拉西林钠他唑巴坦钠聚合物杂质灵敏度高,耐用性好,专属性强,适用于注射用哌拉西林钠他唑巴坦钠的聚合物质控;研究发现,哌拉西林钠他唑巴坦钠原料中的聚合物杂质主要包括哌拉西林二聚体、二聚体降解物和三聚体,其中二聚体的含量最高,是主要的聚合物杂质,可以用该杂质作为指针性聚合物杂质,控制产品中的聚合物限度;未发现他唑巴坦自身聚合杂质以及哌拉西林与他唑巴坦之间聚合产生的聚合物杂质。哌拉西林钠他唑巴坦钠强制降解溶液可作为哌拉西林钠他唑巴坦钠聚合物分析的系统适用性溶液。
| [1] |
金少鸿. 头孢菌素过敏反应的研究进展[J]. 国外药学:抗生素分册, 1984(3): 191. JIN SH. Research progress on cephalosporin allergic reaction[J]. World Notes Antibiot, 1984(3): 191. |
| [2] |
金少鸿. 抗生素的过敏反应-Ⅰ.β-内酰胺类抗生素的过敏反应[J]. 中国临床药理学杂志, 1986, 2(4): 251. JIN SH. Allergic reaction of antibiotics-Ⅰ Allergic reaction of beta-lactam antibiotics[J]. Chin J Clin Pharmacol, 1986, 2(4): 251. |
| [3] |
金少鸿, 胡昌勤. β内酰胺类抗生素过敏反应的研究[J]. 医学研究通讯, 2002, 31(4): 22. JIN SH, HU CQ. Study on allergic reactions to beta-lactam antibiotics[J]. Bull Med Res, 2002, 31(4): 22. |
| [4] |
金少鸿. β-内酰胺类抗生素的质量和过敏反应关系的评述[J]. 中国抗生素杂志, 1988, 13(1): 65. JIN SH. A review on relationship between quality of β-lactam antibiotics and allergic reactions[J]. Chin J Antibiot, 1988, 13(1): 65. |
| [5] |
胡昌勤. β-内酰胺抗生素聚合物分析技术的展望[J]. 中国新药杂志, 2008, 17(24): 2098. HU CQ. Developments on analysis of polymers of β-lactam antibiotics[J]. Chin J New Drugs, 2008, 17(24): 2098. DOI:10.3321/j.issn:1003-3734.2008.24.006 |
| [6] |
张菁, 朱建平, 苑华. 凝胶色谱法测定注射用哌拉西林钠他唑巴坦钠中高分子聚合物[J]. 中国现代应用药学, 2010, 27(5): 452. ZHANG J, ZHU JP, YUAN H. Sephadex chromatographic system for determination of polymer in piperacillin sodium/tazobactam sodium for injection[J]. Chin J Mod Appl Pharm, 2010, 27(5): 452. |
| [7] |
许前辉. 注射用哌拉西林钠他唑巴坦钠聚合物研究[J]. 医药前沿, 2016, 6(8): 22. XU QH. Research of piperacillin sodium for injection tazobactam sodium polymer[J]. Med Front, 2016, 6(8): 22. |
| [8] |
USP 41-NF 36[S].2018: 5728
|
| [9] |
王勇跃, 陈悦, 洪丽娅. β-内酰胺类抗生素中高分子杂质的分离与检测方法进展[J]. 中国药事, 2015, 29(6): 608. WANG YY, CHEN Y, HONG LY. Review on progresses of isolation and test methods for high-molecular weight polymer impurities in β-lactam antibiotics[J]. Chin Pharm Aff, 2015, 29(6): 608. |
| [10] |
李进, 张培培, 崇小萌, 等. 阿莫西林克拉维酸钾复方制剂中聚合物杂质的分析[J]. 药物分析杂志, 2017, 37(8): 1430. LI J, ZHANG PP, CHONG XM, et al. Analysis of polymer impurities in co-amoxicillin and potassium clavulanate preparations[J]. Chin J Pharm Anal, 2017, 37(8): 1430. |
| [11] |
杨美琴, 金少鸿, 胡昌勤. HPLC-柱切换法归属青霉素钠有关物质中的聚合物分析[J]. 药物分析杂志, 2009, 29(10): 1615. YANG MQ, JIN SH, HU CQ. Analysis of polymer impurities in related substances of benzylpenicillin sodium by HPLC-column-switching[J]. Chin J Pharm Anal, 2009, 29(10): 1615. |
 2019, Vol. 39
2019, Vol. 39 
