苯丙酮尿症(phenylketonuria,PKU)是国际上第1个被发现可以早期诊断和治疗的先天性氨基酸代谢病,在新生儿中的发生率为1/19 000到1/13 500[1]。PKU是由于体内先天性苯丙氨酸羧化酶缺陷而引起的苯丙氨酸(phenylalanine,Phe)代谢障碍,使Phe不能转化为酪氨酸(tyrosine,Tyr),从而导致大量Phe和丙酮酸在体内堆积,引起中枢神经系统损害,是严重影响智力的一种常染色体隐性遗传病[2-3],临床血液指标表现为Phe增高。PKU目前最有效的治疗主要是低苯丙氨酸饮食治疗,以控制血中Phe的浓度,并且需要坚持终身,但尚不能彻底治疗。早期发现、诊断、治疗是预防智力低下的有效措施,因而早期检出该病对改善PKU的预后起着决定性的作用。目前许多国家和地区已将PKU作为新生儿常规必查项目进行了多年[4-5],方法涉及茚三酮-荧光法、酶显色法及串联质谱法等,既有手工加样,也有全自动系统,不同方法虽原理各异,但样本均由滤纸干血片浸出。
本次研究选择11种试剂盒,涵盖的3种主要原理如下:①茚三酮-荧光反应。被浸出的Phe在适当条件下与茚三酮反应产生荧光物质,其荧光强度与样品中的Phe浓度成正比;②酶显色法。被浸出的Phe在苯丙氨酸脱氢酶作用下产生烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH),NADH将无荧光的染料还原为强荧光物质,其荧光强度与样品中的Phe浓度成正比,或者NADH将四唑盐转化成甲臜产物,其产物量与样本中的Phe浓度成正比;③串联质谱法。使用含有同位素标记的Phe内标准品溶液对血斑进行萃取,被浸出的Phe对其相应的内标准品的响应程度与Phe的浓度成正比。统一用国际新生儿筛查组织新生儿筛查参考物质及本研究自制的精密度质控品对试剂盒进行质量评价。
1 仪器和材料 1.1 仪器Fluoroskan Ascent FL荧光化学发光读数仪(Ani Labsystems公司)、ANYTEST2000时间分辨荧光分析仪(苏州新波生物技术有限公司)、VICTOR2D 1420多标记检测仪(芬兰PerkinElmer公司),用于检测“茚三酮-荧光法”手工试剂盒;GSP全自动新生儿筛查系统(PerkinElmer公司),用于检测“酶显色法”全自动试剂盒;Spectra MAX M2酶标仪(Molecular Devices公司),用于检测“酶显色法”手工试剂盒;LCMS-8040质谱仪(岛津)、API3200TM质谱仪(AB SciexPte公司)、ACQUITY TQD质谱仪(Waters公司),用于检测不同厂家的“串联质谱法”试剂盒。
1.2 试剂盒批号20150331、20150625、20150922(茚三酮-荧光法),广州市丰华生物工程有限公司提供;批号20150305、20150905、20140905(茚三酮-荧光法),苏州新波生物技术有限公司提供;批号201501(茚三酮-荧光法),广州市达瑞生物技术股份有限公司提供;批号20150616(酶显色法),郑州安图生物工程股份有限公司提供;批号640149、640402全自动试剂盒(酶显色法)和批号640995、641500、641806手工试剂盒(茚三酮-荧光法),珀金埃尔默仪器有限公司提供;批号85MG3B-1、85MG4B-1(茚三酮-荧光法),芬兰雷勃(Labsystems)提供;批号2015110300(串联质谱法),购自济南英盛生物技术有限公司;批号641285、639180(串联质谱法),Neobase系统(非衍生化)和批号639966、641162(串联质谱法),Neogram系统(衍生化),珀金埃尔默仪器有限公司提供;批号400MG3(串联质谱法),NeoMass AAAC系统,雷勃公司(Labsystems)提供。
11种试剂盒以字母序号表示,茚三酮-荧光法为B、C、D、E、F试剂盒,酶显色法为A、G试剂盒,串联质谱法为H、I、J、K试剂盒,其中,国产为D、E、F、G、J试剂盒,进口为A、C、B、H、I、K试剂盒。
1.3 样品与滤纸4thISNS-RPNS参考品(International society for newborn screening-reference preparation for neonatal screening),为含有6个浓度点的滤纸片干血斑,为方便区分,自命名为S1~S6,浓度分别为:2.1、2.87、3.67、5.24、8.4、14.73 mg·dL-1,购自国际新生儿筛查组织;精密度质控品,低值范围1.5~2.5 mg·dL-1,高值范围7.5~12.5 mg·dL-1,本研究所自制。Phe,Sigma公司,货号78019;903号滤纸,Whatman公司。
2 方法与结果 2.1 样品制备精密度质控血片制备:肝素钠抗凝全血(正常体检人群),调整红细胞压积比至55%,添加叠氮化钠(NaN3)作为防腐剂,终浓度0.05%。称取Phe 8.0 mg,以0.9%生理盐水1 mL溶解后成8.0 mg·mL-1,再以生理盐水稀释至2.0 mg·mL-1。取上述2种浓度Phe 0.3 mL,分别加入30 mL的全血中,混匀,分取0.1 mL滴加到Whatman 903号滤纸,待血滴自然渗透,室内自然晾干,每个血斑直径大于8 mm,制备滤纸片干血斑质控品,靶值浓度分别为8.0和2 mg·dL-1,密封保存备用,滤纸正反面血斑一致。
检测前,以打孔钳对试剂盒校准品、6个浓度点的4th ISNS-RPNS参考品、精密度质控品(上述自制精密度质控血片或试剂盒自带靶值在要求范围的质控片)及零质控品(空白血斑)进行打孔,每片直径3 mm左右,分取2片于96孔板进行提取(使用试剂盒配备萃取液或按各试剂盒要求方法配制),分别按照各试剂盒说明书操作规程依次加样、孵育、加反应及显色试剂,串联质谱试剂盒在萃取后直接上机。
2.2 准确度测定各荧光及酶显色试剂盒以自带的校准品进行线性拟合,质谱试剂盒以各试剂盒内同位素标记的氨基酸内标准品进行定标,以4thISNS-RPNS为样本进行测定,分别计算测定值与靶值的相对偏差。每个独立检测重复2个测试,每批试剂盒重复2个独立检测,取2次独立检测的均值为最终结果。
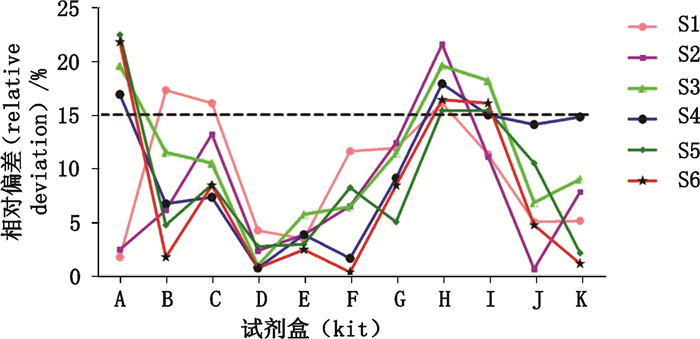
结果显示,6个浓度点相对偏差均在15%以内的有6种试剂盒(图 1-D、E、F、G、J、K试剂盒),其中5种为国产试剂;5个浓度点控制在15%以内的有2种试剂盒(图 1-B、C试剂盒),其偏差较大的点为参考品的最低浓度点,即S1点(2.1 mg·dL-1);有3种试剂盒超过半数浓度点偏差大于15%,个别浓度点接近甚至超过20%(图 1-A、H、I试剂盒);质谱法试剂盒的多数浓度点相对偏差表现较高趋势。
|
S1. 2.1 mg·dL-1 S2. 2.87 mg·dL-1 S3. 3.67 mg·dL-1 S4. 5.24 mg·dL-1 S5. 8.4 mg·dL-1 S6. 14.73 mg·dL-1 图 1 11种不同试剂盒的准确度分析 Fig.1 Analysis of accuracy of eleven kinds of kits |
各试剂盒均以4thISNS-RPNS双孔平行测定,以参考品靶值为横坐标,以测定值为纵坐标进行线性拟合,11种试剂盒的线性相关系数(r)以平均值计算,线性区间数据来自试剂盒说明书。数据(表 1)表明,各试剂盒标准曲线检测范围不同,其中最大范围为0.3~45.1 mg·dL-1,80%试剂盒线性区间分布在1.0~15 mg·dL-1范围。各试剂盒相关系数均大于0.99,差别不显著。
|
|
表 1 11种试剂盒的线性区间与线性 Tab.1 Linear range and linearity of eleven kinds of kits |
参考各试剂盒说明书及技术要求,按“2.1”项中的操作程序,荧光法、酶显色法及J、K串联质谱法试剂盒,连续测定零质控品20次,计算出空白样本反应信号值的标准差(b),根据直线方程y=ax+b的斜率和截距计算检测下限(LOD),当b > 0,LOD=3SD/a;当b < 0,LOD=(3SD/a-b)/a。H与I串联质谱试剂盒将内标准品溶液进行17次连续稀释(1:2),共产生18个浓度递减的内标准品溶液(L1~L18)。将含有各个浓度水平内标准品溶液的工作萃取液分别萃取高值和低值质控血斑,按相同浓度内标准溶液分别混合各萃取液即为检测下限测试样本。使用多种氨基酸串联质谱试剂盒在LC/MS/MS系统上对每个样本进行6次重复测定,取均值。以内标物/分析物信号比例值(Y轴)和血液中内标物理论浓度值(X轴)绘制坐标图以得到线性数据。逐步线性回归分析,从最高浓度样本(L1)到接下来的3个数据点(即L1~L4)起计算r,同时计算每一种样品重复测试的精密度(RSD)。当线性回归分析中所得r≥0.99且RSD≤25%时,血样中最低内标的理论浓度为对应分析物的检测下限。
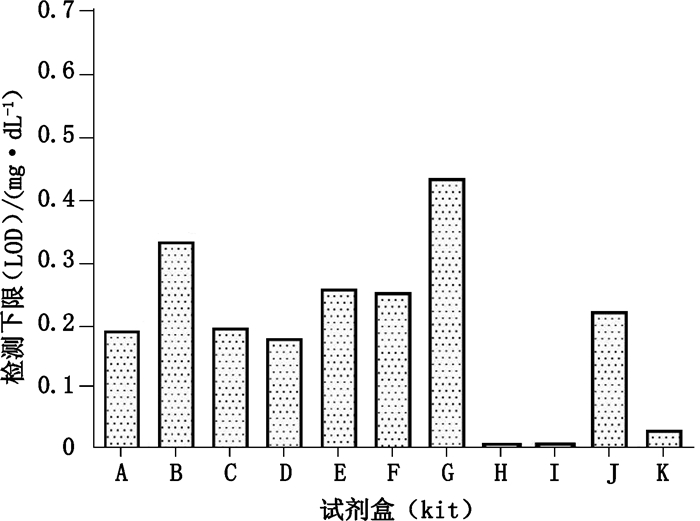
结果显示,所有试剂盒检测下限均在1.0 mg·dL-1以下,串联质谱法具有较低的检测下限(图 2-H、I、K试剂盒)。
|
图 2 11种不同试剂盒的检测下限 Fig.2 LOD of eleven kinds of kits |
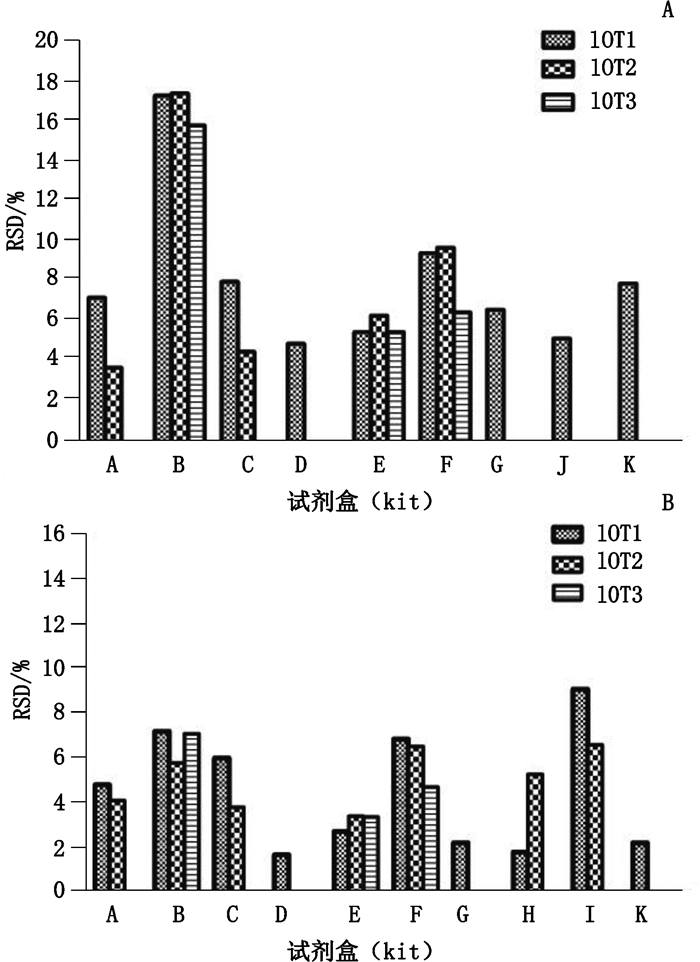
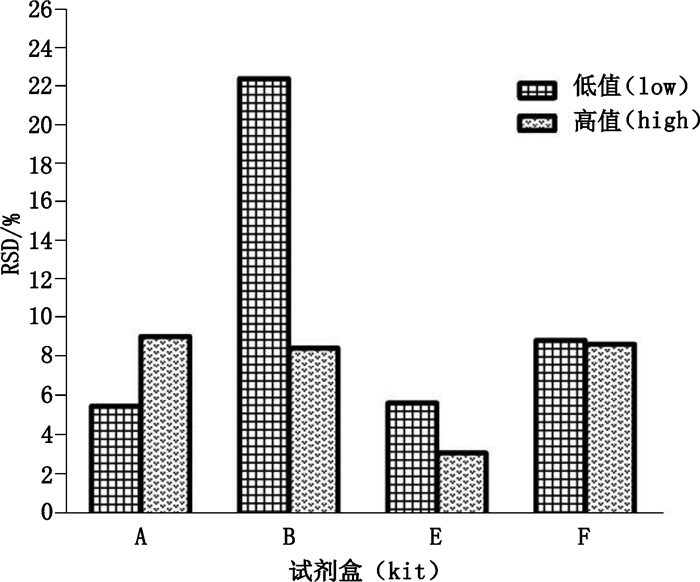
按“2.1”项中的操作程序,对1.5~2.5 mg·dL-1和7.5~12.5 mg·dL-1 2种范围的质控片进行检测,荧光法各批次试剂盒均连续测定10次,质谱法连续测定6次并计算RSD。11种试剂盒共计21个批次中,B、E、F试剂盒均为3个批次,分别以lot1~lot3表示;A、C、H、I试剂盒均为2个批次,分别以lot1~lot2表示;D、G、J、K试剂盒均为1个批次,以lot1表示,不足3批不评价批间精密度。除B试剂盒外,批内和批间的精密度均在10%以内。B试剂盒的批内精密度较其他试剂盒偏高,对1.5~2.5 mg·dL-1范围的质控片样品测定的平均RSD为16.8%(图 3-A);对7.5~12.5 mg·dL-1范围的质控片样品测定的平均RSD为6.7%(图 3-B);B试剂盒对低值样品测定的批间精密度RSD相对较高,为22.6%(图 4)。
|
A. 1.5~2.5 mg·dL-1 B. 7.5~12.5 mg·dL-1 图 3 11种不同试剂盒的批内精密度 Fig.3 Within-batch precision of eleven kinds of kits |
|
图 4 4种不同试剂盒的批间精密度 Fig.4 Between-batch precision of four kinds of kits |
PKU是1种危害严重的先天性、遗传性疾病,可在新生儿期临床症状未出现前,用实验手段明确诊断,从而通过严格控制饮食中的低Phe摄入量使患儿得到早期预防,以降低新生儿PKU患者不同程度的智力缺陷[6]。我国高度重视该疾病的筛查[7-8],近年来,Phe检测在新生儿遗传筛查诊疗中的应用备受关注,其相关检测试剂盒也成为国内外诊断试剂厂家研发和注册上市的重点。该检测是1个不可补偿的一过性检验项目,缺乏由临床即时发现实验错误并予以订正的机会,因此一旦漏诊,患儿早期未能发现并获得有效预防及治疗,将造成智力和体格发育不可逆转的、无法弥补的严重后果[9]。因此,除了实验过程中严格执行质量控制,试剂盒本身的质量水平至关重要。由于目前没有统一的医疗器械行业标准和国家标准品,该试剂盒在注册检验中,通常自行提供质控品、制定产品技术要求完成对产品的注册检验。缺乏统一的标准,是造成不同厂家的试剂盒质量参差不齐的重要因素,也是引起诊疗误诊的最大风险。
评价氨基酸类定量测定试剂盒质量水平的指标一般包括准确度、精密度、检测下限及线性,其中准确度是指测量结果偏离被测量真值的程度,精密度则是指在规定条件下,相互独立的测量结果之间的一致程度。在对病人样本的1次检测中,只有同时保证准确和精密,检测结果才能较为真实地反映被测物的水平,从而为临床诊断提供可靠的依据。本研究中,使用国际组织的标准物质及临床决定水平浓度附近样本对11种试剂盒的检测试验结果显示,11种试剂盒均有较好的检测下限和线性关系,线性范围也足以满足临床检测需要,但试剂盒的准确度令人担忧。对参考品全范围的浓度检测结果发现,部分试剂盒表现为两端的浓度偏差较大,尤其是对参考品的最低点的测定偏差,尽管各地区实验室间临界值不同,但该点仍最接近医学决定水平浓度[10-11]。追溯原因,由于第一代ISNS标准物质是2004年制备[12],此后又经历了3次换批,而早期上市的试剂盒恰恰是大部分在2005年前后注册申报,受当时标准品来源的限制以及并无注册法规的强制要求,大部分试剂盒并没有统一溯源,这也是各厂家的质量控制品没有可比性、大型检验实验室质评检测结果较差、离散程度较大的主要原因之一[8]。精密度检测结果显示,除个别试剂盒在医学决定水平出现较大的批内和批间变异外,整体精密度良好。事实上,新生儿遗传筛查更多的是强调试剂长期的稳定性,即批间的一致性,美国疾病预防控制中心质控品的测定结果也显示不同试剂盒有较大的差异,因此,他们强调各试剂盒生产商要保持自己试剂盒对质控测定的平均值稳定[13]。另外,临床上,当血液浓度超过2 mg·dL-1时统称为高苯丙氨酸血症[11],因此,试剂盒应该配备至少有1个质控样本接近临床决定水平浓度,这一浓度对任何通过实验室检查辅助进行诊断或治疗的疾病都起关键作用,是临床上必须采取措施的检测水平[14],且应始终使用质控样本来保证实验室日常结果的有效性,每次测试或用1块以上的微孔板都应该运行这些质控品;每个实验室都应建立自己的平均值和允许误差范围。但是本研究被考察的试剂盒中,三分之一未配备该临界值附近或内源性浓度水平质控品,尤其是有的试剂盒在自己的技术要求内却声称使用高值质控血斑去控制质量。医学决定水平以及内源性浓度水平测定结果的不可控应用于临床检验中,必然导致病人在不同医疗机构的检验结果可比性较差,准确性难以保证[15]。
生化荧光法在测量的过程中可以抵御其他氨基酸对检测的干扰,是1种高度灵敏、定量且快速的测定手段,同时具有抵制抗生素影响、测定血样中Phe含量准确度高等特点,对PKU的临床诊断、治疗有重大的意义,在上市10年的时间里,在新生儿遗传筛查、提高人口素质等方面做出重要的贡献[16-17],尤其本研究中,虽然国产试剂盒在自动化程度上略逊进口试剂盒,但在准确度检测方面优于进口试剂盒,提示国产试剂盒已达到较高的质量水平。值得一提的是,串联质谱试剂盒不仅具有更低的检测下限,并可一次检测几十种代谢物浓度,近年来被普遍看好并用于新生儿遗传筛查[18-19],在高苯丙氨酸血症筛查中可同时检测上游底物Phe浓度和代谢产物Tyr浓度,并计算这2种物质的浓度比值,可有效降低外源性Phe对疾病诊断的影响,因而具有更好的应用前景。本次应用ISNS标准物质进行评价时发现,除一种国产质谱试剂盒具有较好的准确度外,另3种进口质谱试剂盒的准确度不容乐观,尤其需要依靠Phe浓度、Phe/Tyr比值进行综合判断以提高阳性预期值[20-21],更需要测定结果的准确性以及确立不同实验室不同试剂盒的界值。如何发挥串联质谱在疾病检测上高灵敏性、高特异性、高选择性、高通量的优势,尚需要进一步探讨。
本研究暴露出目前该试剂盒存在的问题:在行业标准和国家标准品缺失的情况下,在注册检验和市场监管中,很难通过统一的尺度对试剂盒性能的优劣做出判断,从而在上市后临床应用中留下隐患。因此,需要通过建立苯丙氨酸定量检测试剂盒行业标准和国家标准品,在注册检验及市场监督中,对试剂盒的质量进行控制,为该类试剂盒的合理应用及科学监管提供技术依据。
| [1] |
KAYE CI, ACCURSO F, la FRANCH IS, et al. Newborn screening fact sheets[J]. Pediatrics, 2006, 118(3): e934. DOI:10.1542/peds.2006-1783 |
| [2] |
HO G, CHRISTODOULOU J. Phenylketonuria:translating research into novel therapies[J]. Transl Pediatr, 2014, 3(2): 49. |
| [3] |
SUMAILY KM, MUJAMAMMI AH. Phenylketonuria:a new look at an old topic, advances in laboratory diagnosis, and therapeutic strategies[J]. Int J Health Sci(Qassim), 2017, 11(5): 63. |
| [4] |
顾学范, 王治国. 中国580万新生儿苯丙酮尿症和先天性甲状腺功能减低症的筛查[J]. 中华预防医学杂志, 2004, 38(2): 99. GU XF, WANG ZG. Screening for phenylketonuria and congenital hypothyroidism in 5.8 million neonates in China[J]. Chin J Prev Med, 2004, 38(2): 99. DOI:10.3760/j:issn:0253-9624.2004.02.009 |
| [5] |
GIEWSKA M, MACDONALD A, BLANGER-QUINTANA A, et al. Diagnostic and management practices for phenylketonuria in 19 countries of the South and Eastern European Region:survey results[J]. Eur J Pediatr, 2016, 175(2): 261. DOI:10.1007/s00431-015-2622-5 |
| [6] |
ALEXANDER D, VANDYCK PC. A vision of the future of newborn screening[J]. Pediatrics, 2006, 117(5 Pt 2): s350. |
| [7] |
杨青, 牟鸿江, 汪俊华. 我国新生儿遗传代谢疾病筛查进展[J]. 中国妇幼卫生杂志, 2017, 8(4): 1. YANG Q, MU HJ, WANG JH. Progress in newborn genetic metabolic disease screening of China[J]. Chin J Women Child Health, 2017, 8(4): 1. |
| [8] |
王薇, 钟堃, 法霖, 等. 全国新生儿遗传代谢病筛查室内质量控制结果分析)[J]. 中国儿童保健杂志, 2014, 22(1): 107. WANG W, ZHONG K, FA L, et al. Analysis of results of internal quality control for neonatal screening phenylalanine and thyrotropin stimulating hormone[J]. Chin J Child Health Care, 2014, 22(1): 107. |
| [9] |
GENTILE JK, TEN HOEDT AE, BOSCH AM. Psychosocial aspects of PKU:hidden disabilities-a review[J]. Mol Genet Metab, 2010, 99(Suppl 1): S64. |
| [10] |
章晓燕, 王薇, 赵海建, 等. 我国2015年新生儿遗传代谢病筛查指标切值的调查[J]. 临床检验杂志, 2016, 34(9): 706. ZHANG XY, WANG W, ZHAO HJ, et al. Investigation on the cut-off values of screening markers for neonatal inherited metabolic diseases in China, 2015[J]. Chin J Clin Lab Sci, 2016, 34(9): 706. |
| [11] |
胡晞江, 索庆丽, 陈琦, 等. 新生儿疾病筛查临界值选取与筛查效率[J]. 中国妇幼保健, 2008, 23(1): 48. HU XJ, SUO QL, CHEN Q, et al. Explore for cut-off point choosing and efficiency on newborn disease screening[J]. Mater Child Health Care China, 2008, 23(1): 48. DOI:10.3969/j.issn.1001-4411.2008.01.021 |
| [12] |
ELVERS LH, LOEBER JG, DHONDT JL, et al. First ISNS reference preparation for neonatal screening for thyrotropin, phenylalanine and 17 alpha-hydroxyprogesterone in blood spots[J]. J Inherit Metab Dis, 2007, 30(4): 609. DOI:10.1007/s10545-007-0622-y |
| [13] |
Centers for Disease Control and Prevention.2018 Quality Control Report[EB/OL].Newborn Screening Quality Assurance Program, 2018, 29(1): 1(2018-06-08)[2018-12-05].https://www.cdc.gov/labstandards/pdf/nsqap/nsqap_2018_qcset1_report.pdf
|
| [14] |
丛玉隆. 检验与临床诊断:质量管理和常规检验分册[M]. 北京: 人民军医出版社, 2006: 87. CONG YL. Laboratory Tests and Clinical Diagnosis:Quality Management and Routine Tests Fascicle[M]. Beijing: People's Militery Medical Press, 2006: 87. |
| [15] |
Centers for Disease Control and Prevention.2017 Quality Control Program Report[EB/OL].Newborn Screening Quality Assurance Program, 2017, 28(1 a): 1(2017-06)[2018-01-05].https://www.cdc.gov/labstandards/pdf/nsqap/nsqap_2017_qcset1_report.pdf
|
| [16] |
胡克兰. 荧光分析法在大样本新生儿苯丙酮尿症筛查中的应用分析[J]. 中国妇幼保健, 2015, 30(18): 3103. HU KL. The application of fluorescence method in neonatal screening for phenylketonuria in large populations of newborn infants[J]. Mater Child Health Care China, 2015, 30(18): 3103. |
| [17] |
田国力, 王燕敏, 周卓, 等. 全自动新生儿疾病筛查系统的性能评价[J]. 检验医学, 2017, 32(7): 633. TIAN GL, WANG YM, ZHOU Z, et al. Performance evaluation of automatic genetic screening processor for neonatal screening[J]. Lab Med, 2017, 32(7): 633. DOI:10.3969/j.issn.1673-8640.2017.07.018 |
| [18] |
de JESS VR, CHACE DH, LIM TH, et al. Comparison of amino acids and acylcarnitines assay methods used in newborn screening assays by tandemmass spectrometry[J]. Clin Chim Acta, 2010, 411(9-10): 684. DOI:10.1016/j.cca.2010.01.034 |
| [19] |
胡海利, 李卫东, 邵子瑜, 等. 串联质谱技术在新生儿遗传代谢病筛查中的应用[J]. 中国妇幼保健, 2017, 32(17): 4266. HU HL, LI WD, SHAO ZY, et al. Application of tandem mass spectrometry in screening of neonatal inherited metabolic diseases[J]. Mater Child Health Care China, 2017, 32(17): 4266. |
| [20] |
CEGLAREK U, MLLER P, STACH B, et al. Validation of the phenylalanine/tyrosine ratio determined by tandem mass spectrometry:sensitive newborn screening for phenylketonuria[J]. Clin Chem Lab Med, 2002, 40(7): 693. |
| [21] |
PEAT J, GARG U. Determination of phenylalanine and tyrosine by high performance liquid chromatography-tandem mass spectrometry[J]. Methods Mol Biol, 2016, 1378: 219. DOI:10.1007/978-1-4939-3182-8 |
 2019, Vol. 39
2019, Vol. 39 
