消栓肠溶胶囊是独家品种,由黄芪、当归、赤芍、地龙、川芎、桃仁和红花六味药材制得,具有补气、活血、通络功效,临床用于治疗缺血性中风气虚血瘀症及脑梗死[1-2]。方中黄芪具有利水消肿、生津养血、行滞通痹及托毒排脓等作用,主要化学成分为黄酮类和三萜皂苷,其中毛蕊异黄酮苷是具有代表性的黄酮类化合物[3-4];当归代表成分有藁本内酯,具有祛风、散寒、除湿和止痛功效[5-6];赤芍可以清热凉血、散瘀止痛,含有丰富的单萜类化合物,其中芍药苷占比较大[7-8];川芎主要药效成分包括阿魏酸、内酯类化合物、总生物碱、挥发油和酚性成分等,具有活血行气、祛风止痛功效[9-10];桃仁中含有苦杏仁苷,属于芳香族氰苷类化合物,为桃仁的主要药理成分,具有抗动脉粥样硬化、免疫抑制、免疫调节、抗肿瘤、抗炎等药理作用[11]。
消栓肠溶胶囊现收载于国家食品药品监督管理局国家药品标准中,质量标准对黄芪甲苷做了定量质控要求,其他成分质量方面研究未见文献报道。消栓肠溶胶囊成分复杂,采用单指标的成分分析方法难以对其进行综合评价。中药指纹图谱是1种可量化的、综合的监督手段,主要用于评价中药材及其制剂质量的真实性、稳定性和优良性[12-13]。本研究采用HPLC法,建立消栓肠溶胶囊指纹图谱,确定21个共有峰,通过与混合对照品比较,指认其中5个成分(苦杏仁苷、芍药苷、阿魏酸、毛蕊异黄酮苷和藁本内酯),并测定其含量,为系统评价和控制消栓肠溶胶囊质量提供参考依据。
1 仪器与试药e2695高效液相色谱仪(沃特世公司);BSA 124-S型电子天平(Sartorius公司);D24UV纯水/超纯水一体化系统(德国默克密理博公司);4020P超声波清洗机(JAC公司,功率500 W)。
对照品苦杏仁苷(批号110820-201506,含量93.4%)、芍药苷(批号110736-201741,含量95.7%)、阿魏酸(批号110773-201614,含量99.0%)、毛蕊异黄酮苷(批号111920-201505,含量97.1%)、藁本内酯(批号111737-201507,含量≥99.0%)均购自中国食品药品检定研究院;市售消栓肠溶胶囊12批(S1~S12),批号分别为20171002、20171003、20171101、20171203、20171205、20171210、20180102、20180106、20180305、20180306、20180501、20180503,标示生产厂家三门峡赛诺维制药有限公司。甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。
2 方法与结果 2.1 色谱条件色谱柱为Diamonsil C18(2)(4.6 mm× 250 mm,5 μm;填料:十八烷基硅烷键合硅胶);流动相为乙腈(A)- 0.1%磷酸水溶液(B),梯度洗脱(0~5 min,8%A;5~12 min,8%A→15%A;12~20 min,15%A→37%A;20~28 min,37%A;20~45 min,37%A→50%A;45~65 min,50%A→65%A);流速为1.0 mL·min-1;柱温35 ℃;进样量10 μL;检测波长为220 nm(0~30 min,检测苦杏仁苷和芍药苷)和310 nm(30~65 min,检测阿魏酸、毛蕊异黄酮苷和藁本内酯)。
2.2 溶液的制备 2.2.1 混合对照品溶液分别取苦杏仁苷、芍药苷、阿魏酸、毛蕊异黄酮苷和藁本内酯的对照品适量,精密称定,加甲醇制成含苦杏仁苷4.50 μg·mL-1、芍药苷42.33 μg·mL-1、阿魏酸46.17 μg·mL-1、毛蕊异黄酮苷7.33 μg·mL-1、藁本内酯24.50 μg·mL-1的混合对照品溶液,摇匀,滤过,取续滤液,即得。
2.2.2 供试品溶液取本品内容物适量,混匀,取细粉约0.5 g,精密称定,置具塞锥形瓶中,加人甲醇30 mL,称量,超声(功率500 W,频率40 kHz)处理30 min,放冷,再称量,用甲醇补足减失的量,摇匀,滤过,取续滤液,即得。
2.3 HPLC指纹图谱的建立 2.3.1 精密度试验取消栓肠溶胶囊供试品溶液(批号20171002),在“2.1”项下色谱条件下,连续进样5针,记录色谱图,以毛蕊异黄酮苷为参比峰,计算各共有峰相对峰面积的RSD均小于5.0%,相对保留时间的RSD均小于1.0%,表明仪器精密度良好。
2.3.2 稳定性试验取消栓肠溶胶囊供试品溶液(批号20171002),按“2.1”项下色谱条件,分别在0、4、8、12、16、24 h进样,记录色谱图,以毛蕊异黄酮苷为参比峰,计算各共有峰相对峰面积的RSD均小于5.0%,相对保留时间的RSD均小溶1.0%,表明供试品溶液在24 h内稳定。
2.3.3 重复性试验取同一批供试品(批号:20171002)6份,按“2.2.2”项下方法制备供试液,在“2.1”项下色谱条件下分析,记录色谱图,以毛蕊异黄酮苷为参比峰,计算各共有峰相对峰面积的RSD均小于5.0%,相对保留时间的RSD均小于1.0%,表明方法重复性良好。
2.3.4 指纹图谱的建立及相似度评价取12批(S1~S12)消栓肠溶胶囊,按照“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,记录色谱图。采用国家药典委员会推荐的《中药色谱指纹图谱相似度评价系统》(2012年版)软件进行分析,以S1号样品的图谱为参考图谱,采用多点校正全谱匹配生成指纹图谱共有模式(平均值法,R)。各批样品与对照图谱的相似度分别为0.997、0.999、0.999、0.997、0.999、0.996、0.999、0.998、0.997、0.998、0.999、0.999,均大于0.99。指纹图谱及其共有模式见图 1。
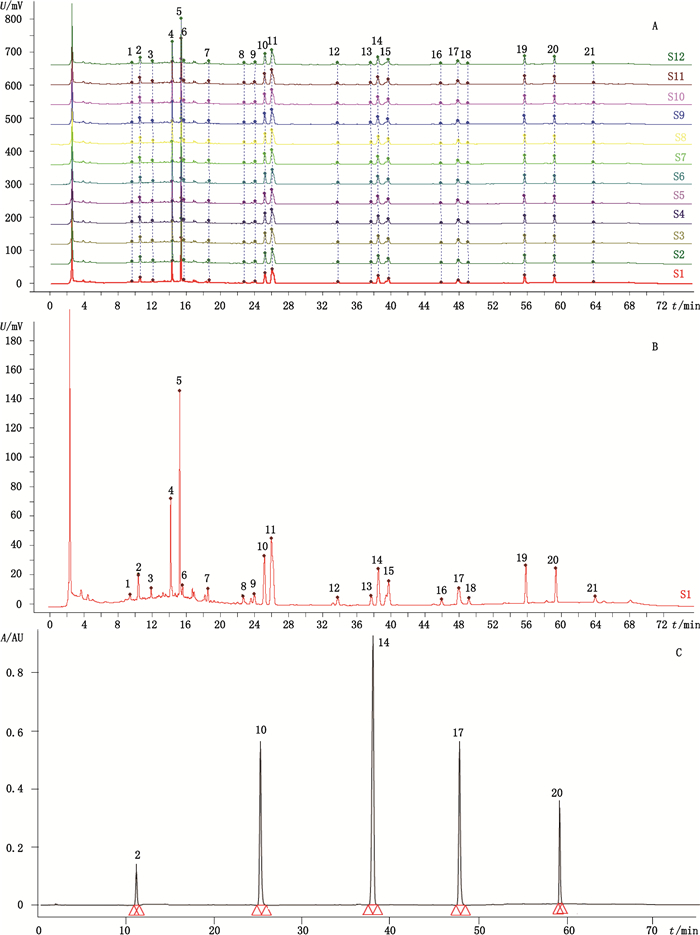
|
2.苦杏仁苷(amygdalin)10.芍药苷(paeoniflorin)14.阿魏酸(ferulic acid)17.毛蕊异黄酮苷(calycosin)20.藁本内酯(ligustilide) 图 1 12批消栓肠溶胶囊HPLC指纹图谱(A)、对照指纹图谱(B)和混合对照品色谱图(C) Fig.1 Fingerprints of 12 batches of Xiaoshuan enteric-coated caplsules(A), reference fingerprint(B) and chromatogram of mixed reference substances(C) |
利用相似度评价系统软件处理,12批指纹图谱中共检测到21个共有峰。与混合对照品比对,标定出5个色谱峰,分别是2号峰(苦杏仁苷)、10号峰(芍药苷)、14号峰(阿魏酸)、17号峰(毛蕊异黄酮苷)和20号峰(藁本内酯),其保留时间分别为7.91、25.923、38.57、47.63和58.83 min。其中17号峰峰形较好,前后无杂质峰干扰,分离完全,因此选作参考峰,计算其他共有峰相对峰面积,结果见表 1。
|
|
表 1 12批样品(S1~S12)中21个共有峰的相对峰面积 Tab.1 The relative peaks areas of 21 common chromatographic peaks of 12 samples(S1-S12) |
同“2.1”“2.2.1”“2.2.2”项下方法。
2.4.2 线性关系考察精密量取混合对照品溶液0.5、1、3、6、8、10 mL,分别置10 mL量瓶中,加甲醇稀释至刻度,配制成一系列浓度的混合对照品溶液,按“2.1”项下色谱条件测定分析,记录液相色谱图。以各组分色谱峰峰面积(Y)为纵坐标,各组分质量浓度(X,μg·mL-1)为横坐标,绘制标准曲线,计算各组分回归方程及相关系数,见表 2。
|
|
表 2 峰面积与浓度的线性关系 Tab.2 Linear relation between peak area and concentration |
取同一批样品[批号20171002(S1号样品)]的供试品溶液,在“2.1”项色谱条件下,连续进样6针,记录色谱图。结果苦杏仁苷、芍药苷、阿魏酸、毛蕊异黄酮苷和藁本内酯峰面积的RSD分别为0.5%、0.7%、0.2%、0.5%和0.4%,表明仪器精密度良好。
2.4.4 稳定性试验取同一批样品[批号为20171002(S1号样品)]的供试品溶液,按“2.1”项下色谱条件,分别于0、4、8、12、16、24 h进样,记录色谱图。结果苦杏仁苷、芍药苷、阿魏酸、毛蕊异黄酮苷和藁本内酯峰面积的RSD分别为1.2%、0.6%、0.5%、1.1%和1.3%,表明供试品溶液在24 h内稳定。
2.4.5 重复性试验取同一批样品[批号20171002(S1号样品)],按“2.2.2”项下方法平行制备6份供试溶液,按“2.1”项下色谱条件进行测定,记录色谱图。结果苦杏仁苷、芍药苷、阿魏酸、毛蕊异黄酮苷和藁本内酯的质量分数分别为0.37、2.65、2.77、0.55和1.56 mg·g-1,RSD分别为0.9%、0.6%、0.4%、0.8%和0.7%,表明本方法重复性良好。
2.4.6 加样回收率试验取同一批样品[批号20171002(S1号样品)]内容物0.25 g,精密称定,平行6份,分别加入含苦杏仁苷0.144 mg·mL-1、芍药苷1.250 mg·mL-1、阿魏酸1.421 mg·mL-1、毛蕊异黄酮苷0.208 mg·mL-1和藁本内酯0.688 mg·mL-1的混合对照品溶液1 mL,按“2.2.2”项下方法制备供试溶液,摇匀,滤过(0.22 μm微孔滤膜),取续滤液进行分析,记录色谱图,计算各组分加样回收率,结果见表 3。
|
|
表 3 消栓肠溶胶囊5个成分的加样回收率结果(n=6) Tab.3 Recoveries of five components in Xiaoshuan enteric-coated caplsules |
取消栓肠溶胶囊供试品溶液,按“2.1”项下色谱条件测定,按标准曲线法分别计算样品中苦杏仁甙、芍药苷、阿魏酸、毛蕊异黄酮苷和藁本内酯的含量,结果见表 4。
|
|
表 4 5个成分含量测定结果(mg·g-1,n=3) Tab.4 Determination of five components |
在流动相选择时,分别考察了甲醇-水、乙腈-0.1%甲酸水溶液及乙腈-0.1 mol·L-1磷酸水溶液系统。使用甲醇-水作为流动相时,指纹图谱中峰个数较少,且分离不完全;采用乙腈-0.1%甲酸水溶液时,指纹图谱峰个数能达到28个,但在图谱中黄芪的有效成分毛蕊异黄酮苷未被检测到,且其他峰的分离度和峰信号强度均不理想;采用乙腈-0.1%磷酸水溶液时,指纹图谱峰个数较多,且强度增强,前后峰分离较好,5个活性成分对称因子在1.01~1.12之间,故以此作为流动相。
色谱柱的选择在色谱条件优化过程中十分关键。笔者先后考察了Agilent ZORBAX Eclipse XDB C18(2)(4.6 mm×250 mm,5 μm)、Shim-pack GIST C18(4.6 mm×250 mm,5 μm)、Diamonsil C18(2)(4.6 mm× 250 mm,5 μm)、Thermo ODS(4.6 mm×250 mm,5 μm)4种色谱柱,试验过程中发现,4种色谱柱各有优缺点,指纹图谱研究要求色谱峰的数量和分离度均有较好表现,其中以Diamonsil C18(2)(4.6 mm×250 mm,5 μm)色谱柱最为理想,尤其在分离效果方面优势明显。
在选择检测波长时,笔者在200~400 nm波长段分别扫描5个成分对照品溶液,结果毛蕊异黄酮苷在230 nm与260 nm波长处有最大吸收,苦杏仁苷在210 nm处有最大吸收,芍药苷在230 nm波长处有最大吸收,阿魏酸在321 nm波长处有最大吸收,藁本内酯在334 nm波长处有最大吸收。结合相关文献[10, 14-15],使用仪器自身带有的固定波长变换程序功能,最终确定0~30 min波长设为220 nm,检测苦杏仁苷和芍药苷,30~65 min设为310 nm,检测阿魏酸、毛蕊异黄酮苷和藁本内酯。
本实验建立了消栓肠溶胶囊指纹图谱,能系统评价其质量,进行定性分析;同时又建立苦杏仁苷、芍药苷、阿魏酸、毛蕊异黄酮苷和藁本内酯含量测定方法,实现消栓肠溶胶囊定量分析。本实验方法准确、简捷、实用,同时具备定性和定量双重评价功能,为有效控制消栓肠溶胶囊质量提供了科学依据。
| [1] |
WS3-571(Z-67)-2005(Z)国家食品药品监督管理局药品标准[S].2005 WS3-571(Z-67)-2005(Z) The State Food and Drug Administration Drug Standard[S].2005 |
| [2] |
徐东勋, 伍雪英, 何佳, 等. 消栓肠溶胶囊对脑梗死急性期神经功能及PAF、ET、NO的影响[J]. 中药药理与临床, 2016, 32(3): 188. XU DX, WU XY, HE J, et al. Effects of Xiaoshuan enteric-coated caplsules on neurological function and PAF, ET, NO with acute cerebral infarction[J]. Pharmacol Clin Chin Mater Med, 2016, 32(3): 188. |
| [3] |
孙政华, 邵晶, 郭玫. 黄芪化学成分及药理作用研究进展[J]. 中医临床研究, 2015, 7(25): 22. SUN ZH, SHAO J, GUO M. A review on chemical components and pharmacological effects of Huangqi[J]. Clin J Chin Med, 2015, 7(25): 22. DOI:10.3969/j.issn.1674-7860.2015.25.009 |
| [4] |
梁瑾, 刘小花, 任远, 等. HPLC-DAD-ELSD法同时测定黄芪中5个成分的含量[J]. 药物分析杂志, 2013, 33(2): 210. LAING J, LIU XH, REN Y, et al. Simultaneous determination of five compounds in Radix Astragali by high-performance liquid chromatography coupled with diode arry and evaporative light scattering detectors[J]. Chin J Pharm Anal, 2013, 33(2): 210. |
| [5] |
温学逊, 牛研, 王书芳. 当归不同药用部位活性成分含量的HPLC分析方法及特征图谱研究[J]. 药物分析杂志, 2014, 34(2): 317. WEN XS, NIU Y, WANG SF. HPLC analysis and characteristic chromatograms of active components in different medicinal parts of Angelicae sinensis radix[J]. Chin J Pharm Anal, 2014, 34(2): 317. |
| [6] |
尹辉. 当归化学成分及药理活性研究进展[J]. 重庆科技学院学报(自然科学版), 2015, 17(1): 100. YIN H. The latest research progress on chemical composition and pharmacological action of angelica[J]. J Chongqing Univ Sci Technol(Nat Sci Ed), 2015, 17(1): 100. DOI:10.3969/j.issn.1673-1980.2015.01.026 |
| [7] |
陆小华, 马骁, 王建, 等. 赤芍的化学成分和药理作用研究进展[J]. 中草药, 2015, 46(4): 595. LU XH, MA X, WANG J, et al. Research progress on chemical constituents of Paeoniae Rubra Radix and their pharmacological effects[J]. Chin Tradit Herb Drugs, 2015, 46(4): 595. |
| [8] |
刘杰, 陈琳, 范彩荣, 等. 基于HPLC-DAD-Q-TOF-MS/MS的白芍和赤芍主要成分定性定量研究[J]. 中国中药杂志, 2015, 40(9): 1762. LIU J, CHEN L, FAN CR, et al. Qualitative and quantitative analysis of major constituents of Paeoniae Radix Alba and Paeoniae Radix Rubra by HPLC-DAD-Q-TOF-MS/MS[J]. China J Chin Mater Med, 2015, 40(9): 1762. |
| [9] |
张翠英, 章洪, 戚琼华. 川芎的有效成分及药理研究进展[J]. 辽宁中医杂志, 2014, 41(10): 2264. ZHANG CY, ZHANG H, QI QH. Advance on active ingredients and pharmacological action of Chuanxiong Rhizoma[J]. Liaoning J Tradit Chin Med, 2014, 41(10): 2264. |
| [10] |
田璐, 闫海霞, 傅欣彤, 等. 一测多评法同时测定川芎、当归饮片中多种化学成分的含量[J]. 药物分析杂志, 2014, 34(5): 848. TIAN L, YAN HX, FU XT, et al. Simultaneous determination of multiple components in decoction pieces of Chuanxiong Rhizoma and Angelicae Sinensis Radix by quantitative analysis of multi-components by single maker[J]. Chin J Pharm Anal, 2014, 34(5): 848. |
| [11] |
许筱凰, 李婷, 王一涛, 等. 桃仁的研究进展[J]. 中草药, 2015, 46(17): 2649. XU XH, LI T, WANG YT, et al. Research progress in Persicae Semen[J]. Chin Tradit Herb Drugs, 2015, 46(17): 2649. DOI:10.7501/j.issn.0253-2670.2015.17.023 |
| [12] |
李强, 杜思邈, 张忠亮, 等. 中药指纹图谱技术进展及未来发展方向展望[J]. 中草药, 2013, 44(22): 3095. LI Q, DU SM, ZHANG ZL, et al. Progress in fingerprint technology on Chinese materia medica and prospect of its future development[J]. Chin Tradit Herb Drugs, 2013, 44(22): 3095. |
| [13] |
孙国祥, 闫波, 侯志飞, 等. 中药色谱指纹图谱评价方法研究进展[J]. 中南药学, 2015, 13(7): 673. SUN GX, YAN B, HOU ZF, et al. Advances in evaluating chromatographic fingerprints of traditional Chinese medicine[J]. Central South Pharm, 2015, 13(7): 673. |
| [14] |
刘桂花, 邢建国, 何承辉, 等. 反相高效液相色谱法同时测定芪香胶囊中红景天苷、芍药苷及毛蕊异黄酮葡萄糖苷的含量[J]. 中国医院药学杂志, 2017, 37(15): 1440. LIU GH, XIN JG, HE CH, et al. Simultaneous determination of salidroside, paeoniflorin and calycosin-7-O-β-D-glucoside in Qixiang capsules by HPLC[J]. Chin Hosp Pharm J, 2017, 37(15): 1440. |
| [15] |
刘国红, 赵路, 吴纯伟, 等. HPLC法测定桂枝茯苓丸有效部位中苦杏仁苷、芍药苷的含量[J]. 广东药学院学报, 2015, 31(1): 50. LIU GH, ZHAO L, WU CW, et al. Determination of amygdali and paeoniflorin of the active fraction in Guizhi Fuling pills by HPLC[J]. J Guangdong Pharm Univ, 2015, 31(1): 50. DOI:10.3969/j.issn.1006-8783.2015.01.011 |
 2019, Vol. 39
2019, Vol. 39 