小儿退热合剂由金银花、连翘、栀子、柴胡等中药组成,可解毒利咽,疏风解表,用于小儿风热感冒所导致的咽喉肿痛、发热恶风[1]。小儿退热合剂收录于《中华人民共和国药典》2015年版(简称《中国药典》)。原小儿退热合剂的含量测定为1个或者2个成分的测定[2-6],《中国药典》规定以黄芩苷和京尼平苷的含量来控制制剂质量,但是此药为儿童用药,2个成分的测定不能全面控制该药的内在质量,因此,小儿退热合剂的检验标准亟待提高[7]。为保证儿童用药的安全有效,本文选取小儿退热合剂处方12味药材中的6味药材的8个指标成分,作为研究对象,包括金银花的主要有效成分为绿原酸,连翘的主要有效成分连翘苷,栀子的主要有效成分京尼平苷和绿原酸,牡丹皮的主要有效成分丹皮酚,黄芩的主要有效成分黄芩苷以及柴胡的主要有效成分柴胡皂苷A,涵盖了处方中的君药及臣药,建立了同一流动相条件下同时测定小儿退热合剂中多指标性成分含量的HPLC法,既提高了制剂的质量控制,又简化了日常操作,为完善其质量标准及制剂开发研究提供了参考依据,对于该药标准的修订具有重要意义。
1 仪器与材料岛津LC-20AT高效液相色谱仪,SPD-M20A二极管阵列检测器,SIL-20A自动进样器,岛津LC-solution工作站,MILLIPORE超纯水仪(Synergy185),KQ-250DE型数控超声波清洗器。
对照品京尼平苷酸(批号111828-201403)、京尼平苷(批号110749-201316)、绿原酸(批号110753-201415)、黄芩苷(批号110715-201318)、丹皮酚(批号110749-200916)、连翘苷(批号110821-201514)、柴胡皂苷A(批号110777-201510)均购自中国食品药品检定研究院,京尼平龙胆双糖苷(批号141120,纯度98%以上)购自成都普菲德生物技术有限公司;小儿退热合剂(广西某药业集团有限公司,批号:1501021、1504026、1506024)。乙腈(色谱纯,Fisher公司),水为超纯化水,其他试剂均为分析纯。
2 方法与结果 2.1 色谱条件及系统适应性试验色谱柱:DIKMA Platisil ODS色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱(0~20 min,10%A→16%A;20~30 min,16%A→40%A;30~50 min,40%A→80%A),流速为1 mL·min-1,柱温30℃,检测波长为:240 nm(京尼平苷酸、京尼平龙胆双糖苷、京尼平苷)、274 nm(绿原酸、黄芩苷、丹皮酚)和210 nm(连翘苷、柴胡皂苷A),进样20 μL,各待测组分分离度均大于1.5,理论塔板数均大于5 000。混合对照品、样品及各阴性对照溶液色谱图见图 1~3。
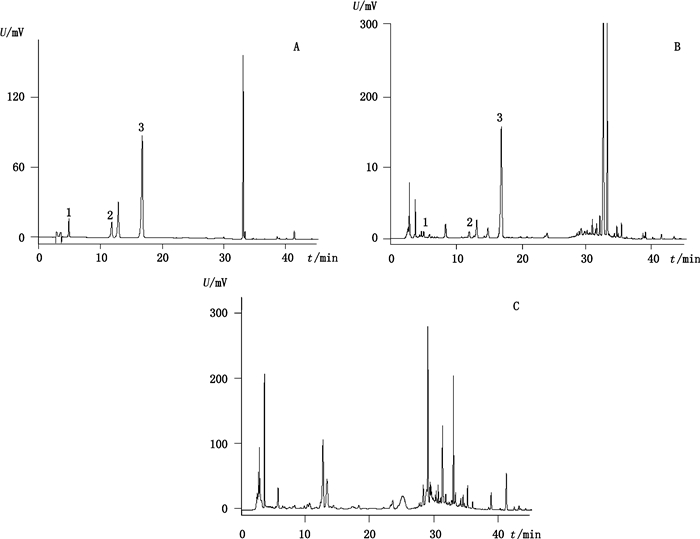
|
1.京尼平苷酸(geniposidic acid)2.京尼平龙胆双糖苷(genipin 1-gentiobioside)3.京尼平苷(geniposide) 图 1 混合对照品(A)、样品(B)、不含栀子的阴性样品(C)在240 nm处色谱图 Fig.1 HPLC chromatograms of mixed reference substances(A), sample(B) and negative sample without geniposide(C) at 240 nm |
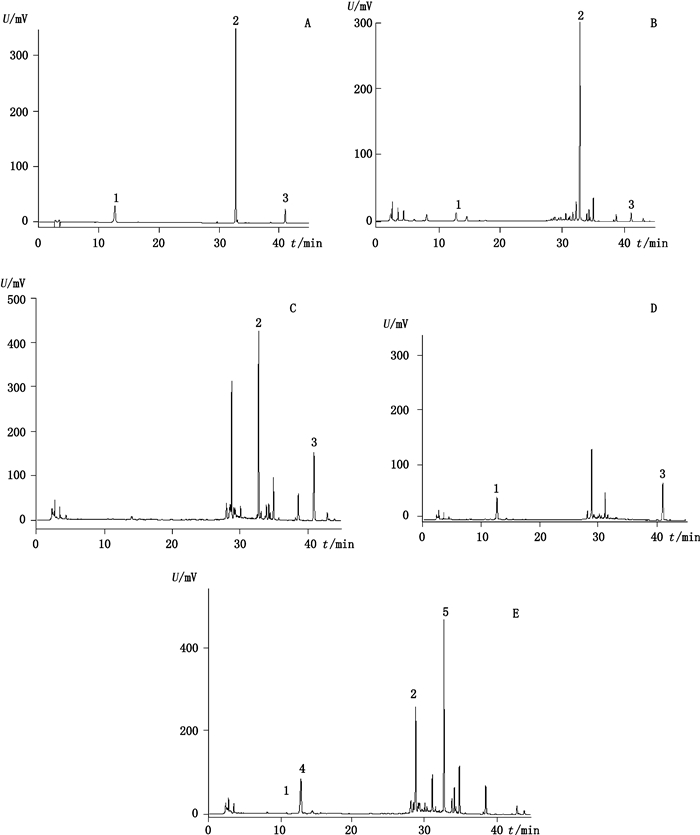
|
1.绿原酸(chlorogenic acid)2.黄芩苷(baicalin)3.丹皮酚(paeonol) 图 2 混合对照品(A)、样品(B)、不含栀子和金银花的阴性样品(C)、不含黄芩的阴性样品(D)、不含牡丹皮的阴性样品(E)在274 nm处色谱图 Fig.2 HPLC chromatograms of mixed reference substances(A), sample(B), negative sample without Common Gardenia Fruit and Japanese Honeysuckle Flower Bud(C), negative sample without Baikal Skullcap Root(D) and negative sample without Tree Peony Root-bark(E) at 274 nm |
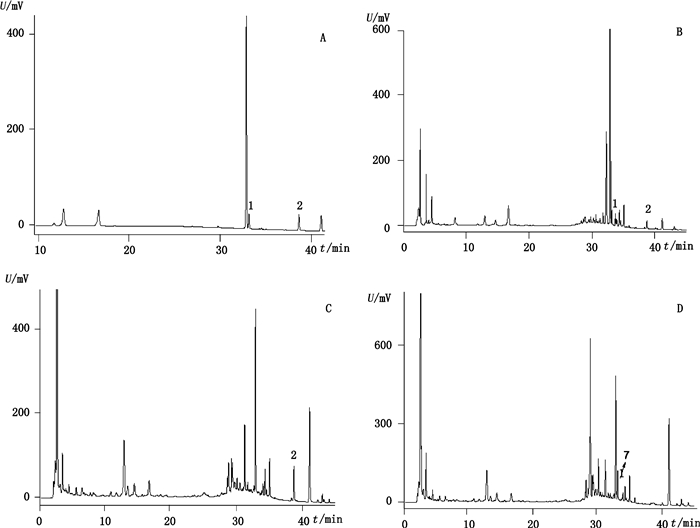
|
1.连翘苷(phillyroside)2.柴胡皂苷A(saikosaponin A) 图 3 混合对照品(A)、样品(B)、不含连翘的阴性样品(C)、不含柴胡的阴性样品(D)在210 nm处色谱图 Fig.3 HPLC chromatograms of mixed reference substances(A), sample(B), negative sample without Weeping Forsythia Fruit(C) and negative sample without Chinese Thorowax Root(D) at 210 nm |
分别精密称取对照品京尼平苷酸、丹皮酚、连翘苷于不同量瓶中,配制质量浓度分别为0.585、0.548、0.28 mg·mL-1的对照品储备液;精密称定京尼平龙胆双糖苷0.99 mg、京尼平苷4 mg、绿原酸0.82 mg、黄芩苷3.5 mg、柴胡皂苷A 3.1 mg,再分别量取上述3种对照品储备液1 mL,置于同一量瓶(50 mL)中,用甲醇稀释至刻度,配制成含京尼平苷酸0.011 7 mg·mL-1、京尼平龙胆双糖苷0.019 8 mg·mL-1、京尼平苷0.08 mg·mL-1、绿原酸0.016 4 mg·mL-1、黄芩苷0.07 mg·mL-1、丹皮酚0.011 mg·mL-1、连翘苷0.005 6 mg·mL-1、柴胡皂苷A0.062 mg·mL-1的混合对照品溶液。
2.2.2 供试品溶液取小儿退热合剂样品0.5 mL,置10 mL量瓶中,加50%甲醇水适量,超声(250 W,40 kHz)处理30 min,加50%甲醇水至刻度,摇匀,滤过,取续滤液,即得。
2.2.3 阴性对照溶液按处方分别制备缺少栀子、栀子和金银花、黄芩、牡丹皮、连翘、柴胡的阴性对照溶液。
2.4 线性关系考察精密量取“2.2.1”项下的混合对照品储备液1.0、2.0、4.0、6.0、8.0 mL,分置5个10 mL量瓶内,加甲醇定容至刻度,摇匀,即得系列标准溶液。分别进样测定,以峰面积A为纵坐标,各组分的质量浓度C(mg·mL-1)为横坐标进行线性回归,得京尼平苷酸、京尼平龙胆双糖苷、京尼平苷、绿原酸、黄芩苷、丹皮酚、连翘苷、柴胡皂苷A的线性回归方程,见表 1。
|
|
表 1 8个成分的回归方程测定结果 Tab.1 The measurement results of the regression equation of eight components |
取混合对照品溶液,按“2.1”项下色谱条件连续进样6次,测得混合对照品中京尼平苷酸、京尼平龙胆双糖苷、京尼平苷、绿原酸、黄芩苷、丹皮酚、连翘苷、柴胡皂苷A峰面积的RSD(n=6)分别为0.73%、0.61%、0.47%、0.62%、0.83%、0.65%、0.71%、0.75%。
2.6 稳定性试验取同一供试品溶液,室温放置,分别于0、2、4、6、12、24 h进行测定,测得京尼平苷酸、京尼平龙胆双糖苷、京尼平苷、绿原酸、黄芩苷、丹皮酚、连翘苷、柴胡皂苷A峰面积的RSD(n=6)分别为0.68%、0.63%、0.84%、0.78%、0.66%、0.69%、0.51%、0.57%,表明供试品溶液在常温下24 h内稳定。
2.7 重复性试验取小儿退热合剂样品,按“2.2”项下方法平行制备6份供试品溶液,以“2.1”项下色谱条件进行测定,按外标法计算各组分含量及其RSD。结果京尼平苷酸、京尼平龙胆双糖苷、京尼平苷、绿原酸、黄芩苷、丹皮酚、连翘苷、柴胡皂苷A含量的RSD(n=6)分别为1.1%、0.91%、1.0%、0.88%、0.94%、1.2%、0.94%、1.2%。
2.8 加样回收率试精密量取已知含量样品0.25 mL共9份,按8个成分含量的80%、100%、120%分别加入8个成分的对照品溶液,照“2. 2”项下方法操作,制备高、中、低3种质量浓度的供试溶液,每个质量浓度平行制备3份,进样20 μL进行测定,结果见表 2。
|
|
表 2 小儿退热合剂中8个成分的加样回收率(n=9) Tab.2 The ecovery rates of the eight compounds of Xiaoer Tuire mixture |
取一定量3批样品,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下进行分析,结果见表 3。
|
|
表 3 不同批次样品的含量测定(mg·mL-1,n=3) Tab.3 Determination of the content of different batches of samples |
首先以甲醇-水(20:80)、甲醇-磷酸-水(47:0.2:53)作为流动相[8-9],进行等度、梯度洗脱,结果发现几种指标成分的分离效果都不太好。又考察了乙腈-磷酸-水[10-12],等度洗脱,还是分离不好。采用梯度洗脱时发现,京尼平苷酸、京尼平龙胆双糖苷、京尼平苷、绿原酸这4个物质有机相比例很小的时候就可以很快出峰,而黄芩苷、丹皮酚、连翘苷、柴胡皂苷A有机相比例很高时才能较快出峰,所以,为了缩短分离时间,在梯度程序的后半段调高了有机相比例。黄芩苷和连翘苷虽然出峰时间较近,但是经过前期的梯度程序,最后得到的峰也符合分离要求,故洗脱程序20~30 min的梯度,主要为分离黄芩苷和连翘苷。
3.2 波长的选择通过二极管阵列检测器波长扫描得到京尼平苷酸、京尼平龙胆双糖苷、京尼平苷在240 nm处有最大吸收,丹皮酚、黄芩苷、绿原酸分别在274、278、327 nm有最大吸收,由于黄芩苷和绿原酸相对含量较高,在274 nm出峰符合分离要求。为了简化分离条件,丹皮酚、黄芩苷、绿原酸检测波长选择在274 nm。
3.3 提取条件的选择采用超声提取,比较了体积分数30%、50%、100%甲醇作为提取溶剂,对各成分的提取效果,结果发现,体积分数为50%的甲醇水溶液提取样品时,各指标成分含量最高,所以确定用50%的甲醇水溶液进行提取。考察了20、30、60 min不同的超声时间对提取率的影响,结果发现,超声30 min已经提取完全。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 544 ChP 2015.VolⅠ[S].2015: 544 |
| [2] |
范全民. HPLC测定小儿退热口服液中绿原酸与黄芩苷含量[J]. 现代中药研究与实践, 2011, 25(2): 72. FAN QM. Determination of chlorogenic acid and baicalin in Xiaoer Tuire Koufuye by HPLC[J]. Res Practic Chin Med, 2011, 25(2): 72. |
| [3] |
黄海燕, 钟建理, 钟名诚. HPLC法测定小儿退热口服液中丹皮酚的含量[J]. 中国药事, 2008, 22(5): 415. HUANG HY, ZHONG JL, ZHONG MC. Determination of paeonol in Xiaoer Tuire oral solution by HPLC[J]. Chin Pharm Aff, 2008, 22(5): 415. |
| [4] |
吴丽红, 储忠英, 刘惠军. HPLC同时测定小儿退热口服液中黄芩苷和丹皮酚的含量[J]. 中国药师, 2013, 16(12): 1853. WU LH, CHU ZY, LIU HJ. Determination of baicalin and paeonol in Xiaoer Tuire oral liquids by HPLC[J]. China Pharm, 2013, 16(12): 1853. |
| [5] |
聂聪珍. 高效液相色谱法测定小儿退热合剂中栀子苷的含量[J]. 中国医药指南, 2013, 11(14): 486. NIE CZ. Determination of geniposide in Xiaoer Tuire mixture by HPLC[J]. Guide China Med, 2013, 11(14): 486. DOI:10.3969/j.issn.1671-8194.2013.14.368 |
| [6] |
雷志英, 龚建平, 彭静. 高效液相色谱法同时测定小儿退热口服液中黄芩苷和连翘苷的含量[J]. 中南药学, 2010, 8(5): 359. LEI ZY, GONG JP, PENG J. Determination of baicalin and phillyrin in Xiaoer tuire oral liquid by HPLC[J]. Cent South Pharm, 2010, 8(5): 359. |
| [7] |
张小妹. 10批次小儿退烧口服液不符规定被召回[J]. 广西质量监督导报, 2016(1): 21. ZHANG XM. The tenth batch of Xiaoer Tuire Oral solution is recalled[J]. Guangxi Qual Supervis Guide Period, 2016(1): 21. DOI:10.3969/j.issn.1009-6310.2016.01.020 |
| [8] |
张琳, 汪轩, 邢婧, 等. HPLC-DAD同时测定左归丸药液中没食子酸、原儿茶酸、绿原酸、马钱苷、阿魏酸含量[J]. 药物分析杂志, 2016, 36(8): 237. ZHANG L, WANG X, XING J, et al. Simultaneous determination of gallic acid, protocatechuic acid, chlorogenic acid, loganin and ferulic acid of herb liquor of Zuogui pills by HPLC[J]. Chin J Pharm Anal, 2016, 36(8): 237. |
| [9] |
郝乘仪, 昌盛. 高效液相色谱法同时测定牛黄清宫丸中5种成分的含量[J]. 中国医院药学杂志, 2017, 37(1): 80. HAO CY, CHANG S. Simultaneous determination of five compounds in Niuhuang Qinggong pills by HPLC[J]. Chin J Hosp Pharm, 2017, 37(1): 80. |
| [10] |
龙厚宁, 印酬, 孟小夏, 等. HPLC同时测定炎热清软胶囊中栀子苷黄芩苷和汉黄芩苷的含量[J]. 中国实验方剂学杂志, 2016, 22(6): 34. LONG HN, YIN C, MENG XX, et al. Simultaneous detemination of geniposide, baicalin and wogonoside inYanreqing soft capsules by HPLC[J]. Chin J Exp Tradit Med Form, 2016, 22(6): 34. |
| [11] |
郭东晓, 林林, 汪冰, 等. HPLC波长切换法同时测定抗感颗粒中7个成分的含量[J]. 药物分析杂志, 2015, 35(10): 1796. GUO DX, LIN L, WANG B, et al. Simultaneous determination of the content of seven components in Kanggan granules by HPLC wavelength switching technology[J]. Chin J Pharm Anal, 2015, 35(10): 1796. |
| [12] |
周军, 张蕾, 张茉, 等. HPLC法同时测定香连化滞丸中7种成分的含量[J]. 中国药房, 2016, 27(6): 840. ZHOU J, ZHANG L, ZHANG M, et al. Contents determination of 7 ingredient in Xianglian Huazhi pills by HPLC[J]. J China Pharm, 2016, 27(6): 840. |
 2019, Vol. 39
2019, Vol. 39 