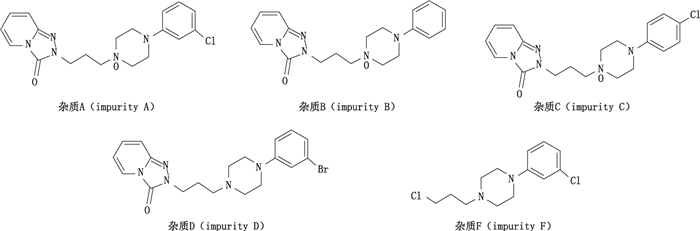
盐酸曲唑酮是1种5-羟色胺重摄取抑制剂,属于苯基哌嗪类化合物[1],作为1种非典型四环类抗抑郁药,具有中枢镇静作用,提高睡眠质量的功效[2]。盐酸曲唑酮杂质主要包括杂质A杂质、B杂质、C杂质、D杂质、杂质E及杂质F(结构式见图 1)。目前国内药典未收载盐酸曲唑酮有关物质项,美国药典(USP 40)和英国药典(BP 2018)均采用高效液相色谱法作为盐酸曲唑酮杂质的检测方法。化学对照品的定值通常采用质量平衡法,该方法从总含量中扣除水分、残留溶剂、灰分等的含量来确定标准物质的最终含量[3-4]。质量平衡法是1种间接的纯度测定方法,结果准确度影响因素有很多,例如色谱主峰与杂质峰的分离程度,色谱峰的响应因子等。见十年来,随着核磁共振定量(qNMR)技术的发展,其在药品标准制定、标准物质定值、药品质量控制等领域的应用日益广泛[5]。与传统定量方法相比,qNMR技术具有以下明显的特点:核磁共振信号强度直接与参与共振的原子核数目成正比[6],理论上只需结构和含量已知的化合物作为参考,不需要提供样品自身标准物质[7];对样品没有破坏性,操作较为简单,分析速度快等[8]。本文通过选择合适的内标物与氘代溶剂,探索合适的qNMR参数,建立盐酸曲唑酮杂质对照品的定量方法,并对方法进行考察,最后与质量平衡法结果进行比较。研究结果表明,该方法快速、准确、可信,为盐酸曲唑酮的质量控制及其杂质对照品的定值提供了新的方法。
|
图 1 5种盐酸曲唑酮杂质对照品的结构 Fig.1 The structures of five trazodone hydrochloride impurity reference substances |
Ascend-500型核磁共振波谱仪(Bruker公司);MSA 6.6S百万分之一电子天平(Sartoriuts公司)。
氘代二甲基亚砜(DMSO-d6)(Sigma-Aldrich,纯度99.9%,批号13I-163);氘代丙酮(acetone-d6)(Sigma-Aldrich,含量99.9%,批号MKCD3426);对照品对苯二甲酸二甲酯(DMT,含量99.9%,批号510052-201401)、盐酸曲唑酮杂质A(含量93.1%,批号510145-201701)、盐酸曲唑酮杂质B(含量99.7%,批号510146-201701)、盐酸曲唑酮杂质C(含量99.4%,批号510147-201701)、盐酸曲唑酮杂质D(含量99.6%,批号510148-201701)、盐酸曲唑酮杂质F(含量99.5%,批号510150-201701),中国食品药品检定研究院;对苯二酚(ACROS,99.5%,批号A0275012)。
2 方法 2.1 供试品溶液制备精密称取盐酸曲唑酮杂质A、B、C、D和F各约10 mg,分别加入DMT约6 mg及氘代试剂约0.5 mL(盐酸曲唑酮杂质A和F以DMSO-d6为溶剂,其余杂质以acetone-d6为溶剂),超声(150 W,80 kHz)使其完全溶解,混合后使用涡旋仪溶解,所得溶液转移至5 mm核磁管中备用。
2.2 核磁仪器参数设置采用90°脉冲,脉冲程序为noesyig1d,谱宽设置为10 000 MHz,采样次数32次,采样时间设置为3.28 s,采样点数为64 K,接收器增益设置为32;盐酸曲唑酮杂质A和F的驰豫延迟时间(D1)设置为20 s,盐酸曲唑酮杂质B、C和D的D1设置为30 s。
2.3 数据处理与qNMR计算将采集得到的氢谱进行傅里叶变换,然后对谱图进行基线校正和相位校正。对选定的内标定量峰和样品定量峰进行积分,每个峰5次,取积分面积的平均值,计算公式如下:
| $ P_{\mathrm{X}}=\frac{A_{\mathrm{x}} \times N_{\mathrm{std}} \times M_{\mathrm{X}} \times m_{\mathrm{std}}}{A_{\mathrm{std}} \times N_{\mathrm{x}} \times M_{\mathrm{std}} \times m} \times P_{\mathrm{std}} $ |
式中,Px为供试品含量;Ax为供试品定量峰积分面积;Nx为供试品定量峰包含质子数;Mx为供试品相对分子质量;m为供试品称样量;Astd为内标物峰积分面积;Nstd为内标物定量峰包含质子数;Mstd为内标物相对分子质量;mstd为内标物称样量,Pstd为内标物含量。
3 结果与讨论 3.1 溶剂与内标物的选择本研究将DMSO-d6与acetone-d6作为考察溶剂,内标物分别考察对苯二酚与DMT。核磁定量所用溶剂对样品和内标物要有好的溶解性。其中,盐酸曲唑酮杂质A和F在acetone-d6中难溶,在DMSO-d6中易溶,因此选择DMSO-d6作为溶剂。其余杂质对照品在acetone-d6中易溶,在DMSO-d6中微溶,所以选择acetone-d6作为溶剂。内标物定量峰要求与样品定量峰有良好的分离。对苯二酚定量峰与样品峰在δ 6.5左右有部分重合,DMT定量峰与杂质样品峰分离良好,因此选择DMT作为内标物。
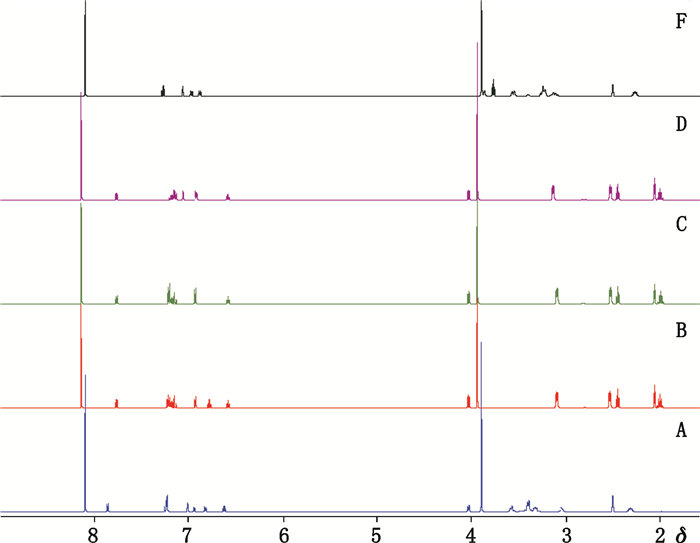
3.2 定量峰的选择一般要求内标物定量峰与样品定量峰有良好的分离,并优先选择偶合裂分较少的相邻质子峰[9]。内标物DMT选择δ 8.09/8.13处苯环质子峰作为定量峰,盐酸曲唑酮杂质A、B、C、D和F分别选择δ 7.85、δ 7.76、δ 7.76、δ 7.76和δ 7.27处的苯环单质子峰。见图 2。
|
图 2 盐酸曲唑酮杂质对照品A、B、C、D和F加入内标物后1H-NMR图谱 Fig.2 The 1H-NMR spectra of trazodone hydrochloride impurity reference substances standards A、B、C、D and F with internal standards |
影响核磁定量准确度的参数主要有D1和扫描次数[10],D1主要影响积分强度,扫描次数主要影响信噪比[11]。通常要求D1大于质子纵向弛豫时间(T1)的5倍[12],使质子在激发前有足够的时间恢复到平衡态,确保相应峰有足够的强度。采用反转恢复技术,测量内标物和样品相应峰在各自溶剂中的T1[13]。待测样品定量峰和内标DMT定量峰T1为1.599~5.561 s。具体值见表 1。因此,将盐酸曲唑酮杂质A和F的D1设置为20 s,盐酸曲唑酮杂质B、C和D的D1设置为30 s。通过测量内标物,盐酸曲唑酮杂质B、C、D和DMT在DMSO-d6和acetone-d6中的T1,发现溶剂对质子T1有一定的影响。在acetone-d6中DMT苯环质子的T1约为在DMSO-d6中的2倍,因此,在建立核磁定量方法,选择氘代溶剂的过程中,不仅要考虑溶解性和稳定性,而且要注意溶剂对质子T1的影响。通常扫描次数与峰信噪比的平方根成正比,增加扫描次数以获得足够高的信噪比[14];但扫描次数增加会延长实验时间。本实验选择扫描次数为32,在保证一定信噪比的前提下,减少实验时间。
|
|
表 1 盐酸曲唑酮杂质对照品和内标物定量峰在不同溶剂中的T1(s)值 Tab.1 The T1 values of quantitative peaks for trazodone hydrochloride impurity reference substances and internal standard in different solvents |
分别配制盐酸曲唑酮杂质A、B、C、D和F样品测试浓度50%~200%范围内的6份系列溶液,进行测定。以样品/内标称样量比值为横坐标,样品定量峰/内标定量峰面积比值测得量为纵坐标左图,进行线性回归,得到5个线性方程。见表 2。
|
|
表 2 线性回归方程 Tab.2 The linear regression equation |
分别称取盐酸曲唑酮杂质对照品约10 mg,DMT约6 mg。每种杂质对照品各6份,在相同核磁参数条件下连续进样。对每份样品所得图谱积分5次,将积分平均值带入公式计算,结果见表 3。重复性结果良好。
|
|
表 3 盐酸曲唑酮杂质对照品测量结果 Tab.3 The quantitative results of trazodone hydrochloride impurity reference substances |
分别取各杂质对照品的同一份供试品溶液,在室温下放置0、3、6、9、12 h,分别进行测定,计算各杂质对照品的含量,考察溶液稳定性。结果见表 4。表明供试品溶液在12 h内稳定。
|
|
表 4 盐酸曲唑酮杂质对照品qNMR稳定性考察结果 Tab.4 The stability results of trazodone hydrochloride impurity reference substances by qNMR |
根据质量平衡法,盐酸曲唑酮杂质对照品含量(%)=(100%-水分含量-残留溶剂含量-炽灼残渣含量)×HPLC含量。将盐酸曲唑酮杂质对照品分别按照高效液相方法测得HPLC纯度,采用库仑滴定仪对水分进行测定,采用气相色谱法测得残留溶剂含量,同时对炽灼残渣含量进行考察。得到的质量平衡法纯度与qNMR法结果基本一致。如表 5所示。
|
|
表 5 盐酸曲唑酮杂质对照品qNMR法与质量平衡法比较 Tab.5 The comparison of quantitative results of qNMR and mass balance method for trazodone hydrochloride impurity reference substances |
本文建立了盐酸曲唑酮杂质A、B、C、D和F的qNMR方法,并对该方法的线性和稳定性进行了考察。该方法准确度高,同时具有操作简单、快捷等优点,可作为质量平衡法定值的有益补充。
| [1] |
HARA M, FITTON A, MCTAVISH D. Trazodone:a review of its pharmacology, therapeutic use in depression and therapeutic potential in other disorders[J]. Drugs Aging, 1994, 4(4): 331. DOI:10.2165/00002512-199404040-00006 |
| [2] |
FAGIOLINI A, COMANDINI A, KASPER S, et al. Rediscovering trazodone for the treatment of major depressive disorder[J]. CNS Drugs, 2012, 26(12): 1033. DOI:10.1007/s40263-012-0010-5 |
| [3] |
陈桂良, 徐新元, 王依婷. 新药开发研究过程中药品标准物质的标定[J]. 上海计量测试, 2002, 29(2): 18. CHEN GL, XU XY, WANG YT. The determination of pharmaceutical reference materials during new drug development and research[J]. Shanghai Meas Test, 2002, 29(2): 18. DOI:10.3969/j.issn.1673-2235.2002.02.005 |
| [4] |
冯艳春, 刘书妤, 胡昌勤. 比阿培南标准物质的研制[J]. 中国抗生素杂志, 2010, 35(9): 679. FENG YC, LIU SY, HU CQ. Establishment of national reference standard of biapenem[J]. J Chin Antibiot, 2010, 35(9): 679. |
| [5] |
BHARTI SK, ROY R. Quantitative 1H NMR spectroscopy[J]. Trends Anal Chem, 2012, 35: 5. DOI:10.1016/j.trac.2012.02.007 |
| [6] |
张芬芬, 蒋孟虹, 沈文斌. 定量核磁共振(qNMR)技术及其在药学领域的应用进展[J]. 南京师范大学学报(工程技术版), 2014, 14(2): 8. ZHANG FF, JIANG MH, SHEN WB. Progress in quantitative nuclear magnetic resonance technology in pharmaceutical applications[J]. J Nanjing Norm Univ(Eng Technol Ed), 2014, 14(2): 8. DOI:10.3969/j.issn.1672-1292.2014.02.002 |
| [7] |
SIMMLER C, NAPOLITANO JG, MCALPINE JB, et al. Universal quantitative NMR analysis of complex natural samples[J]. Curr Opin Biotechnol, 2014, 25: 51. DOI:10.1016/j.copbio.2013.08.004 |
| [8] |
HOLZGRABE U. Quantitative NMR spectroscopy in pharmaceutical applications[J]. Prog Nucl Magn Reson Spectrosc, 2010, 57(2): 229. DOI:10.1016/j.pnmrs.2010.05.001 |
| [9] |
SHEN S, YAO J, SHI Y. Quantitative proton nuclear magnetic resonance for the structural and quantitative analysis of atropine sulfate[J]. J Pharm Biomed Anal, 2014, 89: 118. DOI:10.1016/j.jpba.2013.10.036 |
| [10] |
张琪, 朱洪波, 杨化新, 等. 核磁共振法定量影响因素探析[J]. 中国药品标准, 2014, 15(6): 405. ZHANG Q, ZHU HB, YANG HX, et al. Discussion on the factors influencing quantitative nuclear magnetic resonance determination[J]. Drug Stand China, 2014, 15(6): 405. |
| [11] |
MALZ F, JANCKE H. Validation of quantitative NMR[J]. J Pharm Biomed Anal, 2005, 38(5): 806. DOI:10.1016/j.jpba.2005.01.050 |
| [12] |
RIZZO V, PINCIROLI V. Quantitative NMR in synthetic and combinatorial chemistry[J]. J Pharm Biomed Anal, 2005, 38(5): 851. DOI:10.1016/j.jpba.2005.01.045 |
| [13] |
SOININEN P.Quantitative 1H NMR Spectroscopy Chemical and Biological Applications[EB/OL].(2008-10-10)[2015-10-28]. http://epublications.uef.fi/pub/urn_isbn_978-951-27-1093-5/urn_isbn_978-951-27-1093-5.pdf.Kuopio, Kuopio University Publications.2008: 1
|
| [14] |
HOLZGRABE U, DEUBNER R, SCHOOLLMAYER C, et al. Quantitative NMR spectroscopy-Application in drug analysis[J]. J Pharm Biomed Anal, 2005(38): 806. |
 2019, Vol. 39
2019, Vol. 39 
