庆大霉素于1963年被美国先令公司发现[1],1966年其硫酸盐应用于临床,1965年我国中科院福建微生物研究所分离得到产生菌,1969年我国研制成功并生产[2],目前我国为世界上主要生产及供应国。庆大霉素与硫酸结合为硫酸庆大霉素,抗菌谱广,抗菌作用强。其抗菌作用机理为与细菌核糖体30S亚单位结合,抑制细菌蛋白质的合成,妨碍初始复合物的合成,从而导致细菌死亡[3]。
硫酸庆大霉素片目前仅国内生产,包括素片、薄膜衣片及糖衣片,其口服吸收性差,在胃肠道中浓度较稳定而持久,主要以原型随粪便排出,但在肠道感染或肠粘膜屏障被破坏时,庆大霉素可通过肠粘膜吸收进入血液而出现全身不良反应[4]。此外,庆大霉素为发酵的氨基糖苷类抗生素,除含有4个主组分C1、C1a、C2a和C2外,还含有结构相似的小诺霉素、西索米星、加纳糖胺、2-脱氧琏霉胺等多种小组分[5],这些组分的抗菌活性和毒性各不相同[6],各C组分相对含量及小组分含量的变化均影响产品的质量,因此,对硫酸庆大霉素片进行C组分及有关物质的控制很有必要。
《中华人民共和国药典》(简称《中国药典》)2015年版采用微生物检定法测定硫酸庆大霉素片的含量[7],未对其有关物质进行控制。微生物检定法测定的是硫酸庆大霉素片的生物总效价,不能区分其C组分及相关杂质,更不能对各组分进行直接控制。《中国药典》[7]采用高效液相色谱蒸发光散射检测器测定庆大霉素原料与注射液的组分及有关物质,欧洲药典9.0版[8]、英国药典2017版[9]及美国药典40版[10]仅收载了离子色谱测定硫酸庆大霉素原料的方法,未收载硫酸庆大霉素片。庆大霉素属氨基糖苷类抗生素,无特征紫外吸收,不适合紫外检测。硫酸庆大霉素片含有淀粉、硬脂酸镁、蔗糖和糊精等众多辅料,采用蒸发光散射检测器检测时,易污染该检测器的喷雾嘴和漂移管,导致背景噪音增加,灵敏度降低,需要清洗检测器。本文在参考国外药典离子色谱法测定硫酸庆大霉素原料的基础上,建立了离子色谱测定硫酸庆大霉素片的C组分及有关物质的方法,并对11个企业共156批硫酸庆大霉素片进行了C组分及有关物质的测定。该方法准确,重复性好,灵敏度高,可为硫酸庆大霉素片的质量控制提供参考。
1 仪器与试药DIONEX ISC-5000+离子色谱仪(泵:ICS 5000 DP;进样器:DIONEX AS-AP;柱温箱:ICS 5000 DC;安培检测器:ICS 5000 ED;Chromeleon 6.8色谱工作站;Thermo公司),ThermoAcclaimTMAmG C18(4.6 mm×150 mm,3 μ m;填料:十八烷基硅烷键合硅胶;Thermo公司);Sartorius BP211D电子天平(Sartorius公司);Millpore去离子水发生装置(Merck Millipore公司);Orion Star pH计(Thermo公司)。
对照品硫酸庆大霉素(批号130635-201301,含量为C1 14.7%,C1a 15.3%,C2a 8.5%,C2 18.5%)、西索米星(批号130635-201301,含量56.0%)、小诺霉素(批号130342-201404,含量51.8%)均购自中国食品药品检定研究院;156批硫酸庆大霉素片分别来自11家企业,其中12批素片,27批薄膜衣片,117批糖衣片,规格均为40 mg;三氟乙酸、五氟丙酸及乙腈均为色谱纯,50%氢氧化钠溶液为优级纯,水为Mill-Q去离子水。
2 方法 2.1 色谱条件采用ThermoAcclaimTMAmG C18(4.6 mm×150 mm,3 μ m)色谱柱,流动相为0.7%三氟乙酸(含0.025%五氟丙酸,50%氢氧化钠4 mL,用50%氢氧化钠溶液调节pH至2.6)-乙腈(96.5:3.5),流速1.0 mL·min-1,柱后溶液为2%的氢氧化钠溶液,柱后流速为0.3 mL·min-1;脉冲安培电化学检测器,工作电极为金电极(直径3 mm),参比电极为Ag-AgCl复合电极,工作电位为四电位波形(T1:0~0.4 s,E1:0.1 V;T2:0.41~0.42 s,E2:-0.2 V;T3:0.43 s,E3:0.6 V;T4:0.44~0.50 s,E4:-0.1 V),检测池温度30 ℃,柱温35 ℃,进样量20 μ L。
2.2 溶液配制 2.2.1 系统适用性溶液分别精密称取庆大霉素对照品及西索米星对照品适量,加水溶解并稀释成含庆大霉素0.1 mg·mL-1和西索米星20.0 μg·mL-1的混合溶液,即得。
2.2.2 庆大霉素C组分测定对照品溶液:精密称取庆大霉素对照品适量,加水溶解并稀释成庆大霉素质量浓度为0.2 mg·mL-1的溶液,即得。
素片及薄膜衣片供试品溶液:取本品10片,精密称取研细后的细粉适量,加水溶解并稀释成庆大霉素质量浓度为0.2 mg·mL-1的溶液,即得。
糖衣片供试品溶液:取本品5片,全部研细后加水溶解并稀释成庆大霉素质量浓度为0.2 mg·mL-1的悬液,摇匀后静置,取上清液,即得。
2.2.3 有关物质对照品溶液:分别精密称取对照品西索米星及小诺霉素适量,加水溶解并稀释成含西索米星及小诺霉素质量浓度均为10.0 μg·mL-1的混合溶液,即得。
素片及薄膜衣片供试品溶液:精密称取本品研细后的细粉适量,加水溶解并稀释成庆大霉素质量浓度为1.0 mg·mL-1的溶液,即得。
糖衣片供试品溶液:取本品5片,全部研细后加水溶解并稀释成庆大霉素质量浓度为1.0 mg·mL-1的悬液,摇匀后静置,取上清液即得。
2.3 庆大霉素C组分绝对标示含量计算方法按外标法及下面公式计算各组分的绝对标示含量(%,u/u)。
素片及薄膜衣片:
| $ {C_{\rm{x}}}\left( \% \right) = \frac{{{A_供} \times {W_标} \times {V_2} \times {C_标} \times 1\;000 \times P \times {W_平}}}{{{A_标} \times {W_供} \times {V_1} \times L}} \times 100\% $ |
糖衣片:
| ${C_{\rm{x}}}\left( \% \right) = \frac{{{A_供} \times {W_标} \times {V_2} \times {C_标} \times 1\;000 \times P}}{{{A_标} \times {V_1} \times L}} \times 100\% $ |
式中,Cx为庆大霉素各组分的含量(%,u/u);A供及A标为供试品及对照品溶液各组分的峰面积;W供及W标为供试品及对照品的称样量(g);V1及V2为对照品及供试品溶液的稀释体积(mL);C标为对照品各组分的绝对含量(%)。P为每个组分的理论效价(u/mg);W平为供试品的平均片重(g);L为标示量(u)。
3 结果 3.1 系统适用性取“2.2.1”项下系统适用性溶液,照上述色谱条件进样20 μ L,记录色谱图,结果图中各组分出峰顺序依次为西索米星、庆大霉素C1a、庆大霉素C2、小诺霉素、庆大霉素C2a及庆大霉素C1(见图 1),各峰之间分离度均不小于1.5。
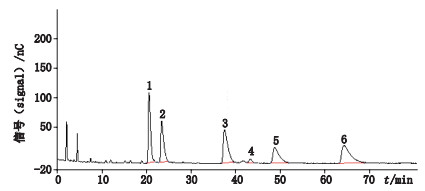
|
1.西索米星(sisomicin)2.庆大霉素C1a(gentamicin C1a)3.庆大霉素C2(gentamicin C2)4.小诺霉素(micronomicin)5.庆大霉素C2a(gentamicin C2a)6.庆大霉素C1(gentamicin C1) 图 1 庆大霉素系统适用性色谱图 Fig.1 Chromatograms of gentamicin system suitability |
精密量取空白溶液(水)20 μ L,注入离子色谱仪,记录色谱图。结果空白溶液对庆大霉素各C组分峰及有关物质峰均无干扰。
按处方比例分别称取硫酸庆大霉素素片、薄膜衣片、硫酸庆大霉素糖衣片辅料适量,按有关物质供试品溶液制备方法配制,得相当于庆大霉素浓度为1.0 mg·mL-1的辅料溶液,精密量取20 μ L注入离子色谱仪,结果空白辅料不干扰庆大霉素各C组分及有关物质的测定(见图 2)。
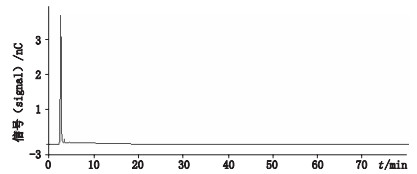
|
图 2 空白辅料色谱图 Fig.2 Chromatogram of blank excipient |
精密称取庆大霉素对照品0.021 70 g,置25 mL量瓶中,用水溶解并稀释至刻度,精密量取适量,配制成质量浓度分别为4.948、9.895、19.79、49.48、98.95、197.9、395.8、494.8 μg·mL-1的溶液,作为庆大霉素C组分的线性溶液。精密量取上述溶液20 μ L,分别注入离子色谱仪,记录色谱图。根据庆大霉素对照品各组分的绝对含量及上述线性溶液中庆大霉素的浓度,分别计算庆大霉素各C组分的绝对浓度C(μg·mL-1),并以此为横坐标,以峰面积A为纵坐标进行线性回归,得庆大霉素C1a、庆大霉素C2、庆大霉素C2a、庆大霉素C1的回归方程(n = 8)及线性浓度范围,庆大霉素各C组分线性关系均良好(见表 1)。
|
|
表 1 庆大霉素各C组分线性结果 Tab.1 Results of linearity tests for gentamicin C components |
精密称取西索米星对照品0.009 40 g,置50 mL量瓶中,用水溶解并稀释至刻度,精密量取适量,配制成质量浓度分别为2.632、5.264、10.53、26.32、52.64 μg·mL-1的溶液,作为西索米星的线性溶液。精密量取上述溶液20 μ L,分别注入离子色谱仪,记录色谱图,以西索米星的浓度C(μg·mL-1)为横坐标,峰面积A为纵坐标进行线性回归,得西索米星的回归方程:
| $ \mathit{A} = 2.863C-3.585\ \ \ \ \mathit{r}\ = 0.999 3 $ |
结果西索米星浓度在2.632~52.64 μg·mL-1范围内,与峰面积线性关系良好。
精密称取小诺霉素对照品0.009 68 g,置50 mL量瓶中,用水溶解后稀释至刻度,精密量取适量,配制成质量浓度分别为2.006、5.014、8.023、10.03、15.04、20.06、25.07 μg·mL-1的溶液,作为小诺霉素的线性溶液。精密量取上述溶液20 μ L,分别注入离子色谱仪,记录色谱图,以小诺霉素的浓度C(μg·mL-1)为横坐标,峰面积A为纵坐标进行线性回归,得小诺霉素的回归方程:
| $ A = 3.228 \mathrm{C}-3.194 \quad r = 0.9999 $ |
结果小诺霉素浓度在2.006~25.07 μg·mL-1范围内,与峰面积线性关系良好。
3.4 精密度试验 3.4.1 庆大霉素C组分取“2.2.2”项下的对照品溶液连续进样6次,结果庆大霉素C1a、庆大霉素C2、庆大霉素C2a及庆大霉素C1峰面积的RSD分别为0.56%、1.2%、0.57%、1.1%,表明该方法精密度良好。
3.4.2 有关物质取“2.2.3”项下的有关物质对照品溶液连续进样6次,结果西索米星峰面积RSD为1.7%,小诺霉素峰面积RSD为1.6%,表明该方法精密度良好。
3.5 重复性试验 3.5.1 庆大霉素C组分取同一批(批号2161220)供试品,按“2.2.2”项下方法制备供试品溶液共6份,分别进样20 μ L,记录色谱图,以庆大霉素对照品及“2.3”项下公式,按外标法计算出各C组分的绝对标示含量(%,u/u)。结果供试品溶液中庆大霉素C1a、庆大霉素C2、庆大霉素C2a、庆大霉素C1及总组分的含量分别为33.0%、25.9%、18.0%、18.5%及95.5%,RSD分别为0.53%、0.50%、1.7%、1.8%及0.80%,表明该方法重复性良好。
3.5.2 有关物质取同一批(批号2161220)供试品,按“2.2.3”项下方法制备供试品溶液共6份,分别进样20 μ L,记录色谱图。供试品溶液色谱图中西索米星峰及小诺霉素峰,分别用相应的西索米星对照品及小诺霉素对照品按外标法计算,除硫酸峰和辅料峰外,其他杂质以西索米星对照品按外标法计算含量。结果供试品溶液中西索米星、小诺霉素、其他最大单个杂质、其他杂质的含量分别为0.8%、2.6%、0.8%、2.7%,RSD分别为0.93%、1.8%、0.84%、1.5%,表明该方法重复性良好。
3.6 定量下限及检测下限 3.6.1 庆大霉素C组分逐级稀释“2.2.2”项下的庆大霉素对照品溶液,庆大霉素各C组分均按绝对浓度算,以信噪比(S/N)为10:1计,庆大霉素C1a、庆大霉素C2、庆大霉素C2a及庆大霉素C1的定量下限分别为0.02、0.03、0.02及0.02 μg;以信噪比(S/N)为3:1计,庆大霉素C1a、庆大霉素C2、庆大霉素C2a及庆大霉素C1的检测下限分别为0.01、0.02、0.01及0.01 μg。代表性图谱见图 3。

|
1.庆大霉素C1a(gentamicin C1a)2.庆大霉素C2(gentamicin C2) 图 3 庆大霉素C1a及庆大霉素C2组分定量下限色谱图 Fig.3 Chromatogram for limit of quantitation of gentamicin C1a and gentamicin C2 |
逐级稀释“2.2.3”项下的有关物质对照品溶液,以信噪比(S/N)为10:1计,西索米星及小诺霉素的定量下限分别为0.02 μg及0.03 μg;以信噪比(S/N)为3:1计,西索米星及小诺霉素的检测下限分别为0.01 μg及0.02 μg。代表性图谱见图 4。
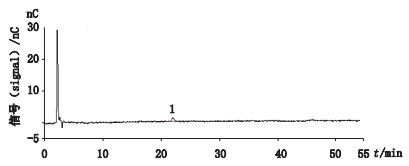
|
1.西索米星(sisomicin) 图 4 西索米星检测下限色谱图 Fig.4 Chromatogram for limit of detection of sisomicin |
按照硫酸庆大霉素片的处方配制其空白辅料溶液,根据硫酸庆大霉素片中庆大霉素与辅料的比例,精密称取硫酸庆大霉素对照品(共9份),加入上述适量的辅料溶液,分别配制高、中、低浓度的溶液,分别进样,按外标法计算回收率,结果庆大霉素C1a、庆大霉素C2、庆大霉素C2a及庆大霉素C1的平均回收率(n = 9)分别为99.5%、99.4%、99.5%及99.1%,见表 2。
|
|
表 2 庆大霉素C组分回收率试验结果(n = 3) Tab.2 The results of recovery for gentamicin C components |
按照硫酸庆大霉素片的处方配制其空白辅料溶液,精密称取西索米星对照品及小诺霉素对照品(共9份),加入适量的辅料溶液,分别配制高、中、低浓度的溶液,按外标法计算回收率,结果西索米星及小诺霉素的平均回收率(n = 9)分别为99.9%及99.8%,见表 3。
|
|
表 3 有关物质回收率试验结果(n = 3) Tab.3 Results of recovery for related substances |
取供试品(批号2161220),按“2.2.2”项下方法制备供试品溶液,按上述色谱条件于0~24 h内进样测定并记录色谱图,以庆大霉素各C组分为指标考察溶液稳定性。结果供试品溶液中庆大霉素C1a、庆大霉素C2、庆大霉素C2及庆大霉素C1峰面积的RSD分别为0.32%、0.36%、0.56%及0.31%,表明供试品溶液在24 h内稳定性良好。
3.8.2 有关物质取供试品(批号为2161220),按“2.2.3”项下方法制备供试品溶液,按上述色谱条件于0~24 h内进样测定并记录色谱图,以西索米星、小诺霉素、其他最大单个杂质及其他杂质总量为指标考察溶液稳定性。结果供试品溶液中西索米星、小诺霉素、其他最大单个杂质及其他杂质总量峰面积的RSD分别为1.2%、1.2%、1.7%及1.7%,表明供试品溶液在24 h内稳定性良好。
3.9 样品测定按“2.2.2”项下的方法制备对照品溶液及供试品溶液,对10家生产企业的156批次硫酸庆大霉素片进行庆大霉素C组分测定,以庆大霉素对照品及“2.3”项下公式按外标法计算供试品中庆大霉素各C组分的绝对标示含量(%,u/u)。结果156批样品中148批次样品的C1a为26.3%~37.1%,C2+C2a为41.8%~49.3%,C1为16.5%~22.2%,4个组分总含量为90.6%~105%。其余8批次样品的C1a为28.2%~33.4%,C2+C2a为33.0%~40.4%,C1为12.7%~16.2%,4个组分总含量为78.6%~85.0%,结果均较低,为企业采用不符合标准规定的原料所致。庆大霉素片C组分测定代表性结果及图谱见表 4及图 5。
|
|
表 4 硫酸庆大霉素片的C组分结果 Tab.4 The results of C components for gentamicin sulfate tables |
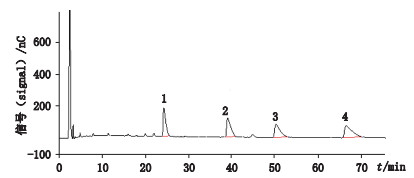
|
1.庆大霉素C1a(gentamicin C1a)2.庆大霉素C2(gentamicin C2)3.庆大霉素C2a(gentamicin C2a)4.庆大霉素C1(gentamicin C1) 图 5 硫酸庆大霉素片C组分测定色谱图(批号20161001) Fig.5 The chromatogram of gentamicin sulfate tables (lot No. 20161001) |
C组分结果表明,同一企业生产的硫酸庆大霉素片各C组分的相对含量、标示含量及总标示含量结果均比较接近,表明国内企业生产该品种的生产工艺比较稳定。而不同企业生产的样品C组分结果有一定差异,这与原料的来源不同有关。此外,156批次样品中,148批次样品离子色谱法测定的总标示含量结果与微生物检定法较接近,且整体低于微生物检定法的结果,原因为离子色谱法测定的是硫酸庆大霉素片4个C组分的总标示含量,而微生物检定法测定的是4个C组分及所有有关物质的综合活性,离子色谱法专属性更好。其余8批次样品离子色谱法测定的总标示含量结果明显低于微生物检定法结果,原因为该样品中C组分含量虽低,但西索米星等其他杂质较大,这些杂质对效价均有贡献,因此导致微生物检定法结果远大于离子色谱法。
有关物质测定方面,按“2.2.3”项下的方法制备对照品及供试品溶液,供试品溶液色谱图中西索米星峰及小诺霉素峰,分别用相应的西索米星对照品及小诺霉素对照品按外标法计算,除硫酸峰和辅料峰外,其他杂质以西索米星对照品按外标法计算含量。结果156批样品中148批次样品小诺霉素为1.8%~2.8%,西索米星为0.0%~1.5%,其他最大单杂为0.3%~0.9%,其他杂质总量为1.2%~4.2%。其余8批次样品(与C组分测定结果低的批号一致)小诺霉素为1.7%~2.2%,西索米星为4.0%~5.1%,其他最大单杂为3.0%~5.0%,其他杂质总量为13.5%~16.0%,结果均较高。庆大霉素片有关物质测定代表性结果及图谱见表 5及图 6。
|
|
表 5 硫酸庆大霉素片的有关物质结果 Tab.5 Results of related substances for gentamicin sulfate tables |
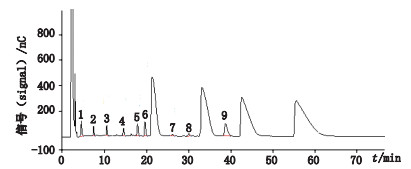
|
1-5,7-8.未知杂质(unknow impurities)6.西索米星(sisomicin)9.小诺霉素(micronomicin) 图 6 硫酸庆大霉素片有关物质测定色谱图(批号170102) Fig.6 The representative chromatogram of gentamicinsulfate tables (lot No.170102) |
有关物质结果表明,同一企业生产的样品有关物质结果比较接近,而不同企业生产的样品,小诺霉素含量差别不大,但西索米星、其他杂质总量均有一定差异;8批次有关物质较高的样品中,小诺霉素含量与其余148批次样品结果接近,但西索米星、其他最大单杂含量均明显较高。表明西索米星含量及杂质个数的增加均对有关物质结果贡献较大,应严格控制原料生产工艺以控制西索米星的含量,减少杂质个数,提高该产品的质量。
4 讨论 4.1 工作电位工作电位的选择对电极的适用及待测组分的灵敏度均有影响。目前用于氨基糖苷类抗生素的电位波形主要为三电位波形及四电位波形,波形的不同可影响检测灵敏度、重复性、背景噪声、信号响应及信号稳定性。三电位波形采用3种不同的工作电位即E1、E2及E3,其中E1为工作电位,E2为清洗正电位,E3为清洗负电位。硫酸庆大霉素因在工作电极表面发生氧化反应而产生电流变化可被检测,但其反应产物会沉淀于电极的表面从而抑制被测物质进一步氧化以干扰测定。三电位波形最初是为避免氧化反应的产物毒化电极表面而使用的,但该波形中使用较高的正电位来氧化清洗电极,过度的清洗降低了电极的使用寿命,同时更容易污染及腐蚀电极,因此使用三电位波形时为获得较高的灵敏度需要经常打磨电极[11]。四电位波形是后期发展的,其使用较负的还原清洗电位清除工作电极表面的氧化物及污染物,可减少电极的损耗,延长电极的使用寿命,增加电极的稳定性,具有较高的灵敏度及耐用性,四电位波形将会逐渐取代三电位波形,成为分析氨基糖苷类抗生素的主要检测波形[12]。
4.2 色谱柱耐用性本方法中所用的流动相pH为2.6,乙腈的比例为3.5%,应采用耐酸及较亲水性的色谱柱。我们考察了ThermoAcclaimTMAmG C18(4.6 mm×150 mm,3 μ m)、SHISEIDO CAPCELL PAK C18(4.6 mm×250 mm,5 μ m)、TSKgelODS-80Ts QA(4.6 mm×250 mm,5 μ m)及Apollo C18(4.6 mm×250 mm,5 μ m)色谱柱,结果ThermoAcclaimTMAmG C18(4.6 mm×150 mm,3 μ m)色谱柱在分离度、保留时间及耐用性方面均较好。
4.3 流动相中乙腈的比例考察了乙腈的比例为4.5%、4.0%、3.5%、3.0%、2.5%时对硫酸庆大霉素片中C组分及各杂质分离的影响。结果随着乙腈比例的减少,各色谱峰的保留时间及分离度均增加,但乙腈比例太低时,各色谱峰的保留时间太长,综合保留时间与分离度结果,选择乙腈的比例为3.5%。
4.4 小结本文建立的离子色谱脉冲安培电化学检测器法可准确测定硫酸庆大霉素片的4个C组分(庆大霉素C1a、庆大霉素C2、庆大霉素C2a、庆大霉素C1)及有关物质含量。该方法操作简单、重复性好、灵敏度高,可为硫酸庆大霉素片的质量控制提供有价值的参考。
| [1] |
WEINSTEIN M, LUEDEMANN G, ODEN E, et al. Gentamicin, a new broad-spectrum antibiotic complex[J]. Antimicrob Agents Chemother, 1963, 161: 1. |
| [2] |
刘英, 王立萍. 庆大霉素质量标准变迁对庆大霉素质量的影响[J]. 药物分析杂志, 2014, 34(2): 207. LIU Y, WANG LP. The influence of change in gentamicin quality standardon gentamicin quality[J]. Chin J Pharm Anal, 2014, 34(2): 207. |
| [3] |
SATOKO Y, DOMINIQUE F, JOSEPH DP. Structural origins of gentamicin antibiotic action[J]. EMBO J, 1998, 17(22): 6437. DOI:10.1093/emboj/17.22.6437 |
| [4] |
潘洪秀, 王惠娟, 季方如. 小儿口服庆大霉素片引起的耳聋1列[J]. 中国药物应用与监测, 2007, 5(4): 43. PAN HX, WANG HJ, JI FR. A case of deafness caused by oral gentamicin tables in children[J]. Chin J Drug Appl Mon, 2007, 5(4): 43. DOI:10.3969/j.issn.1672-8157.2007.04.016 |
| [5] |
BERDY J, PAUNCZ KJ, VAJNA ZM, et al. Metabolites of gentamicin-producing micromonospora species.Ⅰ.Isolation and identification of metabolites[J]. J Antibiot, 1977, 30(1): 945. |
| [6] |
MASAMICHI K, MASAYUKI U, MICHIHIKO S. Differing effects on the inner ear of three gentamicin compounds:GM-C1, -C2 and -C1a[J]. Acta Otolaryngol, 2003, 123(8): 916. DOI:10.1080/00016480310000593a |
| [7] |
中华人民共和国药典2015年版.二部[S].2015: 1326 ChP 2015.Vol Ⅱ[S].2015: 1326 |
| [8] |
EP 9.0.Vol Ⅱ[S].2017: 2753
|
| [9] |
BP2017.VolⅠ[S].2017: 1098
|
| [10] |
USP 40-NF35.VolⅡ[S].2017: 4391
|
| [11] |
XI LL, WUG F, ZHU Y. Analysis of etimicin sulfate by liquid chromatography with pulsed amperometricdetection[J]. J Chromatogr A, 2006, 1115(1-2): 202. DOI:10.1016/j.chroma.2006.02.093 |
| [12] |
SHRUTI C, GEERT V, JOS H, et al. Compatative study on the analytical performance of different detectors for the liquid chromatographic analysis of tobramycin[J]. J Pharm Biomed Anal, 2010, 53(2): 151. DOI:10.1016/j.jpba.2010.02.032 |
 2019, Vol. 39
2019, Vol. 39 
