《中华人民共和国药典》(简称《中国药典》)2015年版通则1105非无菌产品微生物限度检查:微生物计数法,其在结果判断中指出若因沙氏葡萄糖琼脂培养基上生长的细菌使霉菌和酵母菌计数结果不符合微生物限度要求,可采用含抗生素的沙氏葡萄糖琼脂培养基或其他选择性培养基进行霉菌和酵母菌总数测定[1]144。孟加拉红培养基常用于化妆品的霉菌和酵母菌计数[2],其组分与沙氏葡萄糖琼脂培养基比较,除了缓冲剂、微量元素、凝固剂和供微生物生长必须的碳源、氮源及能源,其中每1 L还含有0.1 g氯霉素和0.033 g孟加拉红。氯霉素为广谱抗生素,可以抑制细菌的生长;孟加拉红为选择性抑菌剂,其不但可以抑制细菌生长,还能减缓霉菌因生长过快导致的菌落蔓延。而沙氏葡萄糖琼脂培养基没有选择性,细菌同样可以生长,如果大量细菌、霉菌和酵母菌同时在沙氏葡萄糖琼脂培养基上生长,则无法排除细菌干扰,导致霉菌和酵母菌计数不准确。根据《中国药典》2015年版通则9201药品微生物检验替代方法验证指导原则[1]385,本试验对孟加拉红培养基代替沙氏葡萄糖琼脂的方法进行验证。
1 试验材料 1.1 菌株金黄色葡萄球菌[CMCC(B)26 003]、铜绿假单胞菌[CMCC(B)10 104]、枯草芽孢杆菌[CMCC(B)63 501]、白色念珠菌[CMCC(F)98 001]、黑曲霉[CMCC(F)98 003]均由中国食品药品检定研究院提供。菌液制备:取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌的新鲜培养物适量,用pH 7.0无菌氯化钠-蛋白胨缓冲液制成适宜浓度的菌悬液;取黑曲霉的新鲜培养物适量,加入含0.05%吐温80的pH 7.0无菌氯化钠-蛋白胨缓冲液5 mL,将孢子洗脱。吸出孢子悬液至无菌试管中,用上述缓冲液制成适宜浓度的黑曲霉孢子悬液。
1.2 培养基及材料孟加拉红培养基(广东环凯微生物科技有限公司,批号3104590,简称1号),孟加拉红培养基(北京三药科技开发公司,批号1707032,简称2号),pH 7.0氯化钠蛋白胨缓冲液(广东环凯微生物科技有限公司,批号3104781),沙氏葡萄糖琼脂培养基(北京三药科技开发公司,批号1702244,简称SDA)。
1.3 仪器设备BHC-1300ⅡA2型生物安全柜(苏州安泰空气技术有限公司),SPX-150型生化培养箱(慧科电子有限公司)。
2 方法与结果 2.1 专属性制备金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌高浓度的菌液,预期菌液浓度在104~103 cfu·mL-1之间(金黄色葡萄球菌3次平行试验浓度分别为80 000、95 000、73 000 cfu·mL-1;铜绿假单胞菌3次平行试验浓度分别为43 000、55 000、68 000 cfu·mL-1;枯草芽孢杆菌3次平行试验浓度分别为52 000、65 000、69 000 cfu·mL-1)。制备白色念珠菌菌液和黑曲霉孢子悬液,预期菌液浓度在102~103 cfu·mL-1之间(白色念珠菌3次平行试验浓度分别为260、350、750 cfu·mL-1;黑曲霉3次平行试验浓度分别为670、500、280 cfu·mL-1)。取上述5种菌液0.1 mL,分别涂布接种于孟加拉红琼脂平板上,于25 ℃培养2 d。平行试验3次。结果高浓度的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌在孟加拉红培养基上均不生长;白色念珠菌和黑曲霉在孟加拉红培养基上生长良好。表明孟加拉红培养基对霉菌和酵母菌具有专属性。
2.2 准确度分别制备预期浓度为200 cfu·mL-1的白色念珠菌菌液和预期浓度为100 cfu·mL-1黑曲霉孢子悬液。分别取白色念珠菌菌液(0.1、0.3、0.5、0.7、0.9 mL)加入培养皿中,每个体积平行制备10个培养皿;分别取黑曲霉孢子悬液(0.1、0.3、0.5、0.7、0.9 mL)加入培养皿中,每个体积平行制备10个培养皿;其中5个倾注孟加拉红培养基,另外5个倾注沙氏葡萄糖琼脂,于25 ℃培养2 d。平行试验3次。取3次试验的平均值计算回收率(替代方法/药典方法)来评价替代方法的准确度。结果见表 1。回收率均大于70%,满足药典要求。
|
|
表 1 准确度验证结果 Tab.1 Verification result of accuracy |
分别制备预期浓度为5 000 cfu·mL-1金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌菌液。取上述3种菌液等量混合制成混合菌液(混合菌液的预期浓度为5 000 cfu·mL-1);制备预期浓度为200 cfu·mL-1的白色念珠菌菌液和预期浓度为100 cfu·mL-1的黑曲霉孢子悬液。分别取白色念珠菌菌液(0.2、0.4、0.6、0.8、1.0 mL)和黑曲霉孢子悬液(0.2、0.4、0.6、0.8、1.0 mL)加入培养皿中,每个浓度制备10个平皿。在各个平皿中精密加入1.0 mL的混合菌液,准确注入15 mL孟加拉红培养基,混合均匀,于25 ℃培养2 d。平行试验3次。取3次试验平均值计算RSD,结果见表 2。根据《中国药典》对不同含菌浓度下RSD的规定(< 10 cfu·皿-1,RSD应 < 35%;10~30 cfu·皿-1,RSD应 < 25%;30~300 cfu·皿-1,RSD应 < 15%),使用替代培养基对霉菌和酵母菌进行计数的精密度达到药典要求。
|
|
表 2 精密度验证结果 Tab.2 Verification results for precision |
分别制备预期浓度为50 cfu·mL-1的白色念珠菌菌液和黑曲孢子悬菌液。分别取白色念珠菌菌液(0.2、0.4、0.6、0.8、1.0 mL)和黑曲霉孢子悬液(0.2、0.4、0.6、0.8、1.0 mL)加入培养皿中,每个体积平行制备10个平皿。然后在其中5个平皿中各加入孟加拉红培养基15 mL;在另外5个平皿中各加入沙氏葡萄糖琼脂培养基(SDA)15 mL,于25 ℃培养2 d。平行试验3次,3次试验的平均菌落数见表 3,对表 3数据进行t检验分析,结果见表 4。
|
|
表 3 定量下限结果(cfu) Tab.3 Results of quantitation limit |
|
|
表 4 定量下限均值检验表 Tab.4 Table of the mean values quantitation limit |
由表 3、4可得,白色念珠菌组的T值为2.449,P值为0.07 > 0.05,可以认为2种培养基对白色念珠菌的计数结果无显著差异,符合药典要求。黑曲霉组的T值为-1.500,P值为0.208 > 0.05,可以认为2种培养基对黑曲霉的计数结果无显著差异,符合药典要求。
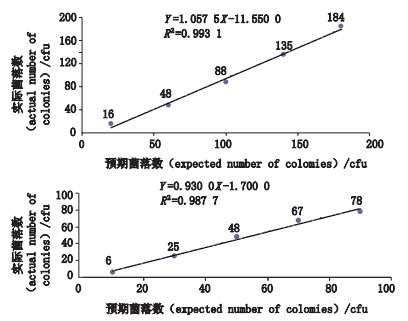
2.5 线性分别制备预期浓度为200 cfu·mL-1的白色念珠菌菌液和预期浓度为100 cfu·mL-1黑曲霉孢子悬液,分别取白色念珠菌菌液(0.1、0.3、0.5、0.7、0.9 mL)和黑曲霉孢子悬液(0.1、0.3、0.5、0.7、0.9 mL)加入培养皿中,每个体积制备5个平皿。在各个平皿中注入孟加拉红培养基15 mL,混合均匀,于25 ℃培养2 d。平行试验3次。取3次试验的平均值进行线性回归分析,结果见图 1。2种验证菌的相关系数均高于0.95,满足药典对替代方法的要求。
|
图 1 孟加拉红白色念珠菌(A)和黑曲霉(B)回归曲线 Fig.1 Linear regressions of Candida albicans (A) and Aspergillus niger (B) of rose Bengal |
《中国药典》没有要求对替代方法定量检验的检测下限进行验证,但经过多次试验得出在90 mm的平板上能够准确计数的白色念珠菌菌落数在200 cfu以内,黑曲霉菌落数在100 cfu以内。当菌液浓度达到5 cfu·mL-1以下时计数结果与理论浓度的比值无法达到70%,这与测定方法的关系不大,主要是由于菌落计数服从泊松分布造成的[3]。
2.7 重现性参照“2.3”项精密度验证试验方法,第1次试验采用1号孟加拉红培养基和SDA培养基;第2次试验采用2号孟加拉红培养基和SDA培养基。培养计数后计算RSD,结果见表 5,对表 5数据进行t检验分析,结果见表 6。
|
|
表 5 重现性验证结果RSD(%) Tab.5 Verification results for reproducibility of RSD |
|
|
表 6 重现性均值检验表 Tab.6 Table for test of mean values of reproducibility |
白色念珠菌(1号孟加拉红培养基)与白色念珠菌(2号孟加拉红培养基)、白色念珠菌(SDA1)、白色念珠菌(SDA2)的均值差对应的P值均大于0.05,说明4个均值之间均无显著性差异;黑曲霉(1号孟加拉红培养基)与黑曲霉(2号孟加拉红培养基)、黑曲霉(SDA1)、黑曲霉(SDA2)的均值差对应的P值均大于0.05,说明4个均值之间均无显著性差异;由不同人员,使用不同厂家的孟加拉红培养基对霉菌和酵母菌计数,并与药典方法进行比较,2次试验结果无显著性差异,重现性符合药典要求。
3 讨论霉菌、酵母菌在培养40~48 h生长达到峰值,后期由于霉菌菌丝蔓延和覆盖,不利于2种菌落的观察及点计,应及时观察并记录培养至第5 d的结果[4]。25 ℃的培养温度下,48 h时白色念珠菌已经较大,且黑曲霉菌丝还没有蔓延,孢子尚未长出,适宜观察。培养时间为5 d的霉菌计数大于或等于培养时间为3 d的霉菌计数,延长培养时间更有利药品霉菌数据的准确性[5],所以选择适宜的观察及计数时间可以减小计数结果的误差。白色念珠菌在孟加拉红培养基上呈淡粉红色,黑曲霉在孟加拉红培养基上菌落中心可被染成浅红色,两者在孟加拉红培养基上都较SDA容易计数。由于加入的孟加拉红培养基体积与氯霉素含量相关,理论上应当加入相等体积的孟加拉红培养基才能得到较好的精密度。在重现性验证的2次试验中都用了同一份混合菌液,由于取样时间不同,混合菌落总数发生了改变,这一方法参数的改变没有影响检验结果,此替代方法的耐用性也被看作符合药典要求。
国内外目前对霉菌、酵母菌的检测方法除了平板计数法外,还有干片培养法、荧光分析法、微生物活性测定法、近红外光谱检测法和高光谱成像检测法等[6]。各种方法各有所长,但是平板计数法仍然是最简便耐用的方法。孟加拉红琼脂培养基是市售的成品培养基,方便易得,避免了抗生素加入时混合不均等问题。在霉菌和酵母菌的培养基中还可以考虑加入0.15%表面活性剂吐温20[7]、用L型涂布棒接种[8]以及正置培养[9]等来优化方法。此外GB/T 27025-2008《检测和校准实验室能力的通用要求》[10]和CNAS-CL01-A001:2018《检测和校准实验室能力认可准则在微生物检测领域的应用说明》[11]均提出应对测量结果进行适当的不确定度评估。实际检测中还应建立合适的不确定度评估方法,以便更客观科学地判定实验结果。
| [1] |
中华人民共和国药典2015年版.四部[S].2015: 144,385 ChP 2015.Vol Ⅳ[S].2015: 114,385 |
| [2] |
化妆品安全技术规范2015年版[S].2016: 483 Safety Technical Specification for Cosmetics, 2015[S].2016: 483 |
| [3] |
王知坚, 李珏. 厄多司坦胶囊菌落计数替代方法的验证[J]. 药物分析杂志, 2011, 31(1): 2146. WANG ZJ, LI Y. Validation of alternative bacterial count method of erdosteine capsules[J]. Chin J Pharm Anal, 2011, 31(1): 2146. |
| [4] |
马群飞. GB 4789.15-2016《食品安全国家标准-食品微生物学检验霉菌和酵母计数》标准解读[J]. 中国卫生标准管理, 2018, 9(5): 1. MA QF. Interpretation for GB 4789.15-2016 national food safety standard-food microbiological examination-enumeration of moulds and yeasts[J]. China Health Stand Manage, 2018, 9(5): 1. DOI:10.3969/j.issn.1674-9316.2018.05.001 |
| [5] |
吴美华. 对中国药典微生物限度霉菌和指示菌检查的探索[J]. 海峡药学, 2005, 17(2): 81. WU MH. A study on the examination of microbial limit mould and indicator bacteria in Chinese Pharmacopoeia[J]. Strait Pharm J, 2005, 17(2): 81. DOI:10.3969/j.issn.1006-3765.2005.02.043 |
| [6] |
周玉庭, 任佳丽, 张紫莺. 粮食中霉菌污染检测方法现状及发展趋势[J]. 食品安全质量检测学报, 2016, 7(1): 244. ZHOU YT, REN JL, ZHANG ZY. Current situation and development trends of detection methods for mold contamination in grains[J]. J Food Saf Qual, 2016, 7(1): 244. |
| [7] |
邵敏, 赵然, 周鹤峰. 霉菌检测培养基改良实验研究[J]. 食品工业科技, 2010, 20(2): 331. SHAO M, ZHAO R, ZHOU HF. Study on the improvement of medium for mold inspection[J]. Sci Technol Food Ind, 2010, 20(2): 331. |
| [8] |
明儒成, 封新平. 食品中酵母菌计数检验方法的改进[J]. 中国卫生检验杂志, 2007, 17(3): 478. MING RC, FENG XP. Research on method of counting and testing yeast in food[J]. Chin J Health Lab Technol, 2007, 17(3): 478. DOI:10.3969/j.issn.1004-8685.2007.03.043 |
| [9] |
梁美丹, 肖剑, 易云婷. 食品微生物能力验证霉菌酵母菌计数[J]. 轻工科技, 2015, 7(7): 5. LIAN MD, XIAO J, YI YT. The ability of food microorganism to verify the count of mold yeast[J]. Light Ind Sci Technol, 2015, 7(7): 5. |
| [10] |
GB/T 27025-2008检测和校准实验室能力的通用要求[S].2008 GB/T 27025-2008 General Requirements for the Competence of Testing and Calibration Laboratories[S].2008 |
| [11] |
CNAS-CL01-A001: 2018检测和校准实验室能力认可准则在微生物检测领域的应用说明[S].2018 CNAS-CL01-A001: 2018 Application of Test and Calibration Laboratory Competency Accreditation Criteria in Microbial Testing[S].2018 |
 2019, Vol. 39
2019, Vol. 39 