槲皮素与芦丁为黄酮醇类化合物的代表性成分,广泛存在于锦葵科、杜仲科、藤黄科、菊科、豆科、忍冬科等植物中,现代药理实验证明,槲皮素与芦丁均具有扩张周围血管、冠状血管,使血流量增加,发挥降血压作用[1-3]。以槲皮素与芦丁为主要成分的中药广泛用于临床,《中华人民共和国药典》(以下简称《中国药典》)2015年版一部收载的药材与饮片有黄蜀葵花、槐花、杜仲、连翘、雪莲花、金银花等数十种,含有这些药材的中成药屡见不鲜。因此,有效鉴别药材、饮片、中成药中的槲皮素与芦丁成分具有重要意义。《中国药典》2015年版一部以薄层色谱(TLC)作为主要鉴别方法[4],可初步分离不同成分,但需要显色剂及随行对照品进行检视,操作烦琐,污染环境,成本较高,且专属性较低,无法获得被分离的各化学组分的分子结构信息。常规拉曼(Raman)光谱灵敏度较低[5],不能直接与TLC联用,而表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)可使普通拉曼信号增加104~106倍[6-7],故薄层色谱-表面增强拉曼光谱(TLC-SERS)联用技术将是获取混合物中各成分结构信息的发展方向。
本文采用拉曼微测技术[8-9],研究并建立了槲皮素、芦丁的TLC-SERS法,并以二维TLC为样品的分离手段,将TLC-SERS成功地用于黄蜀葵花、槐花中槲皮素与芦丁的鉴别,专属性强,灵敏度高,安全环保,操作简便。
1 仪器与试药 1.1 仪器DXRxi显微拉曼成像光谱仪(Thermo Fisher Scientific,USA),激发波长780、532 nm;NXR傅里叶变换拉曼光谱仪(Thermo Fisher Scientific,USA),激发波长1 064 nm;H1650-W台式微量高速离心机(长沙湘仪离心机仪器有限公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司);SLR控温型红外线加热电磁力搅拌器(Wiggens,GER);Nano-ZS90纳米粒度仪(Malvern Instruments Ltd.,UK);XS105DU十万分之一分析天平(Mettler-Toledo,CH);层析缸(上海化科实验器材有限公司,10 cm×10 cm);铝制薄层板GF254(Merck公司,GER,10 cm×10 cm);定量毛细管(天津思利达色谱技术公司,2 μL);WFH-203型台式三用紫外分析仪(杭州汇尔仪器设备有限公司)。
1.2 试药槲皮素对照品(批号100081-200406,纯度97.8%)、芦丁对照品(批号100080-200306,纯度98.2%)均购自中国食品药品检定研究院;硝酸银、柠檬酸三钠(天津科密欧化学试剂有限公司)及其他试剂(天津市光复精细化工研究所)均为分析纯,实验用水为娃哈哈纯净水;黄蜀葵花与槐花药材、饮片、中成药均购自齐齐哈尔永德堂大药房,按《中国药典》2015年版一部检验,符合规定。
2 实验方法 2.1 溶液的制备 2.1.1 对照品溶液分别称取芦丁、槲皮素的对照品适量,加入甲醇后超声溶解,分别制成1 mg·mL-1的溶液,即得。
2.1.2 样品溶液黄蜀葵花样品溶液:取黄蜀葵花药材(饮片、中成药)研磨过80目筛的粉末1 g,加0.18%盐酸乙醇溶液20 mL,置水浴上加热回流1 h,趁热滤过,滤液浓缩至5 mL,即得;槐花样品溶液:取槐花药材(饮片、中成药)研磨过80目筛的粉末0.2 g,加甲醇5 mL,密塞,振摇10 min,滤过,取滤液,即得。
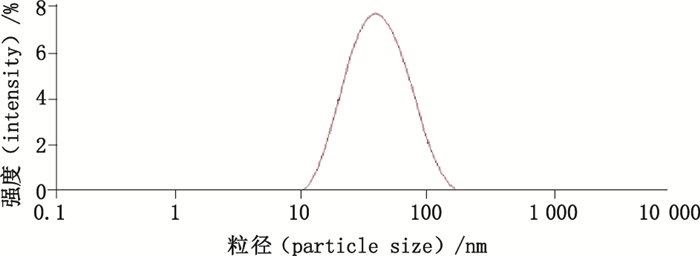
2.2 银溶胶混悬液的制备称取硝酸银85 mg,置500 mL纯净水中,超声溶解,并置于磁力搅拌器上加热至沸,加入1%柠檬酸钠溶液12 mL,保持沸腾30 min,冷却至室温,取混悬液4 mL,4 000 r·min-1离心5 min后除去2 mL上清液,超声混匀,即得银溶胶混悬液,银溶胶粒径分布如图 1所示。
|
图 1 银溶胶粒径分布图 Fig.1 Distribution plot of silver colloid size |
照薄层色谱法(《中国药典》2015年版附录ⅣB),取槲皮素、芦丁对照品溶液各2 μL,分别点于硅胶GF254薄层板上,分别用乙酸乙酯-甲酸-水(8:1:1)与甲苯-乙酸乙酯-甲酸(5:4:1)为展开剂[4],展开,展距为8 cm,取出,晾干,置日光与紫外光灯(254 nm)下检视定位,见图 2。分别于定位处滴加银溶胶5 μL,在阴湿状态下,将TLC板置于拉曼光谱仪显微镜下,采用拉曼微测技术,分别以532、780和1 064 nm激光对待测斑点进行扫描,获得二维平面分布像图,然后,将激光束置于待测成分与银基体表面结合点上,扫描获得相应的SERS。

|
1.槲皮素(quercetin)2.芦丁(rutin) 图 2 对照品的TLC图谱 Fig.2 TLC of reference standards |
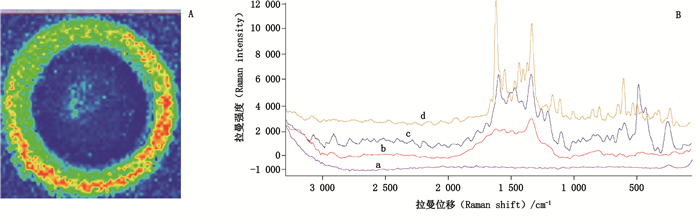
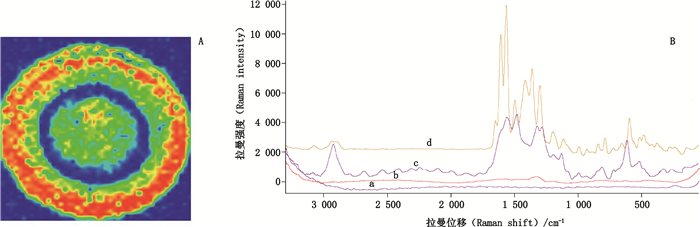
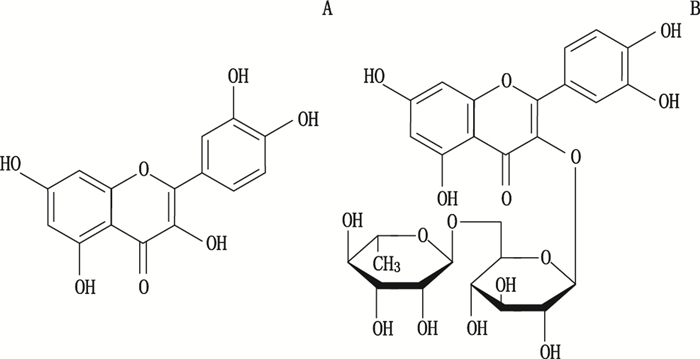
选择波长为780 nm的激发光,参照“2.3”项下方法操作,获得二维平面分布像图,见图 3-A、图 4-A,红色区域为槲皮素、芦丁分子吸附在银基体表面密集处,并在此处将激光束定位于样品与银基底表面结合点上,扫描获得相应的SERS。同法,分别对TLC空白处、未加银溶胶斑点处及对照品粉末进行检测,并得到相关拉曼信息,见图 3-B、图 4-B与表 1。芦丁与槲皮素二者结构差异在于3位取代基是苷元还是苷,见图 5,所以它们的拉曼光谱的差异可能源于3位取代基的分子振动极化率的不同;从图 3-B、图 4-B中的a可见,硅胶GF254薄层板信号不会产生干扰。槲皮素与芦丁TLC-SERS(图 3-B、图 4-B的c)特征峰较其同一检测点拉曼光谱(图 3-B、图 4-B的b)明显增强,与其相应粉末正常拉曼光谱(图 3-B、图 4-B的d)比较,谱带位置相近,但SERS谱带变宽,相对强度发生明显改变,信号表示为强度很强(very strong,简写vs)、强(strong,简写s);一般(common,简写m)、弱(weak,简写w)、很弱(very weak,简写vw)。槲皮素在2 925 w(2 925 vw)cm-1、1 617 vs(1 599 s)cm-1、1 336 s(1 338 s)cm-1、1 107 w(1209 m)cm-1、600 m(589 w)cm-1处,TLC-SERS与粉末拉曼光谱存在共有峰,分别来源于母核=CH伸缩振动、C=C伸缩振动、=CH变形振动、C-C伸缩振动及各种取代苯的特征谱带;芦丁在2 935 w(2 918 s)cm-1、1 609 vs(1 592 s)cm-1、1 303 s(1 286 s)cm-1、997 w(1 015 w)cm-1、599 m(617 m)cm-1处TLC-SERS与粉末拉曼光谱存在共有峰,分别来源于母核与芸香糖引起的=CH、-CH伸缩振动叠加峰、母核C=C伸缩振动、芸香糖-CH面内扭转、芸香糖C-C伸缩振动,以及各种取代苯的特征谱带。上述现象符合SERS的基本特征,说明槲皮素与芦丁TLC-SERS在灵敏度明显提高的基础上,具有较高的专属性,能够用于微量槲皮素与芦丁的鉴别。
|
a.空白薄层板滴加银溶胶(blank TLC dropped with silver colloids)b.槲皮素斑点(quercetin spot)c.槲皮素斑点滴加银溶胶(quercetin spot dropped with silver colloids)d.槲皮素对照品(reference standard of quercetin) 图 3 槲皮素二维平面分布像图(A)与TLC-SERS图谱(B) Fig.3 Two-dimensional plane distribution image of quercetin(A) and TLC-SERS chrotogram(B) |
|
a.空白薄层板滴加银溶胶(blank TLC dropped with silver colloids)b.芦丁斑点(rutin spot)c.芦丁斑点滴加银溶胶(rutin spot dropped with silver colloids)d.芦丁对照品(reference standard of rutin) 图 4 芦丁二维平面分布像图(A)与TLC-SERS图谱(B) Fig.4 Two-dimensional plane distribution image of rutin(A) and TLC-SERS chrotogram(B) |
|
图 5 槲皮素(A)与芦丁(B)化学结构 Fig.5 The chemical structures of quercetin(A) and rutin(B) |
|
|
表 1 槲皮素与芦丁的Raman及SERS光谱信息(cm-1) Tab.1 Ramanand SERS spectral information of quercetin and rutin |
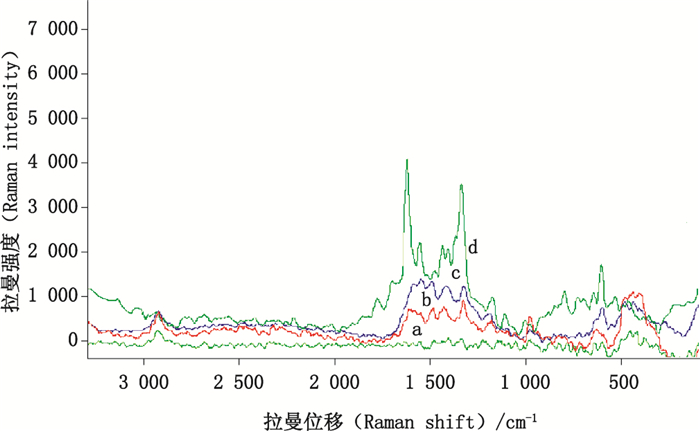
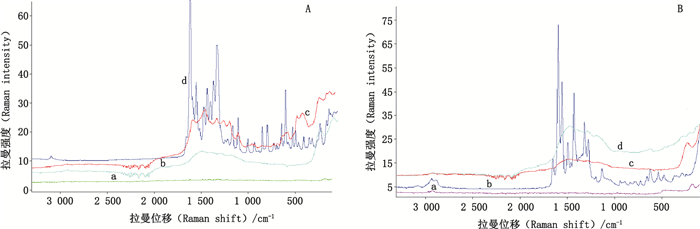
按照上述方法,在532 nm波长激发光及1 064 nm波长激发光条件下进行检测,结果如图 6、7所示。
|
a.空白薄层板滴加银溶胶(blank TLC dropped with silver colloids)b.槲皮素斑点(quercetin spot)c.槲皮素斑点滴加银溶胶(quercetin spot dropped with silver colloids)d.槲皮素对照品(reference standard of quercetin) 图 6 槲皮素在532 nm波长处的TLC-SERS光谱 Fig.6 The TLC-SERS of quercetin at 532 nm |
|
A:a.槲皮素斑点(quercetin spot)b.空白薄层板滴加银溶胶(blank TLC dropped with silver colloids)c.槲皮素斑点滴加银溶胶(quercetin spot dropped with silver colloids)d.槲皮素对照品(reference substance of quercetin) B:a.芦丁斑点(rutin spot)b.芦丁对照品粉末(reference substance of rutin)c.芦丁斑点滴加银溶胶(rutin spot dropped with silver colloids)d.空白薄层板滴加银溶胶(blank TLC dropped with silver colloids) 图 7 槲皮素与芦丁傅里叶变换TLC-SERS光谱 Fig.7 The Fourier transform TLC-SERS of quercetin and rutin |
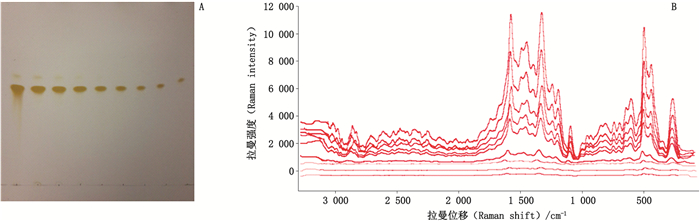
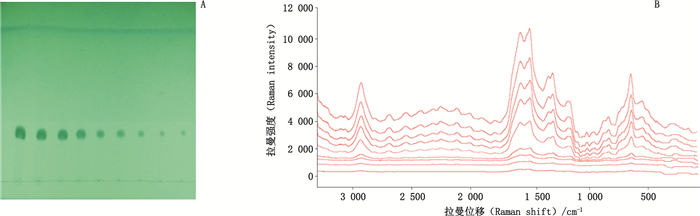
分别取不同浓度的槲皮素与芦丁对照品溶液,参照“2.3”项下方法操作,结果见图 8、9。根据信噪比(S/N)=3:1得到槲皮素与芦丁检测下限均为1 mg·mL-1,对应的TLC点样沉积量均为2 μg。
|
A.TLC B.TLC-SERS 图 8 槲皮素检测下限的考察 Fig.8 Investigation of the detection limit of quercetin |
|
A.TLC B.TLC-SERS 图 9 芦丁检测下限的考察 Fig.9 Investigation of the detection limit of rutin |
分别取槲皮素与芦丁的对照品溶液,参照“2.3”项下方法操作,在成像图圆周处选择红色区域中吸附在银基体表面活位上的分子进行拉曼检测,在同一点检测5次,5组特征峰强度与拉曼位移的RSD均小于1.0%。
3.2.3 重复性试验分别取槲皮素与芦丁的对照品溶液,参照“2.3”项下方法操作,在成像图圆周处选择红色区域中吸附在银基体表面活位上的分子进行拉曼检测,分别在5个点各检测1次,5组特征峰强度与拉曼位移的RSD均小于1.0%,见图 10。
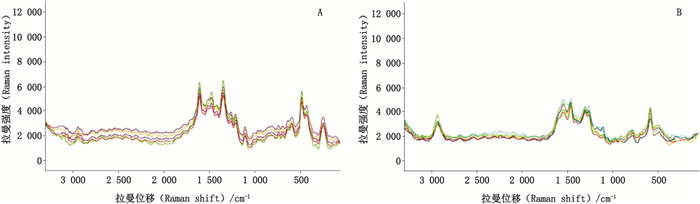
|
A.槲皮素(quercetin)B.芦丁(rutin) 图 10 重复性试验结果 Fig.10 Results of reproducibility test |
取槲皮素对照品溶液2 μL与黄蜀葵花样品溶液1 μL,分别点于硅胶GF254薄层板上,以甲苯-乙酸乙酯-甲酸(5:4:1)为展开剂,展开,展距为8 cm,晾干,至日光与紫外灯(254 nm)下检视,定位,调转展开方向进行二次即二位展开,展距8 cm,至日光与紫外灯(254 nm)下检视,定位,在对照品相应的位置上,样品显相同的TLC-SERS,二者相似度为0.97。同法得黄蜀葵花饮片与中成药的TLC-SERS,见图 11。
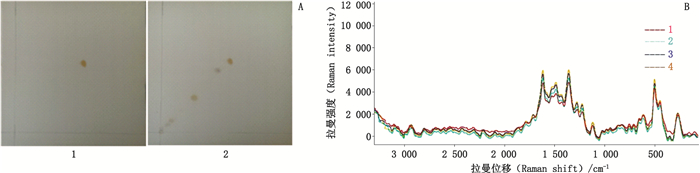
|
A:TLC 1.槲皮素对照品(quercetin reference substance)2.黄蜀葵花样品(Abelmoschi Corolla sample) B:SERS 1.槲皮素对照品斑点(spot of quercetin reference substance)2.对照品斑点重复试验(reproducibility test of reference substance spot)3.黄蜀葵花样品比移值相同斑点(spots with same Rf value in Abelmoschi Corolla sample)4.样品比移值相同斑点重复试验(reproducibility test of spots with same Rf value in Abelmoschi Corolla) 图 11 黄蜀葵花中槲皮素成分检测 Fig.11 Detection of quercetin in Abelmoschi Corolla |
取芦丁对照品溶液2 μL与槐花样品溶液0.5 μL,分别点于硅胶GF254薄层板上,以乙酸乙酯-甲酸-水(8:1:1)展开,展距为8 cm,晾干,至日光与紫外灯(254 nm)下检视,定位,调转展开方向进行二次即二位展开,展距8 cm,至日光与紫外灯(254 nm)下检视,定位,在对照品色谱相应的位置上,样品显相同的TLC-SERS,二者相似度为0.98。同法得槐花饮片与中成药的TLC-SERS,见图 12。
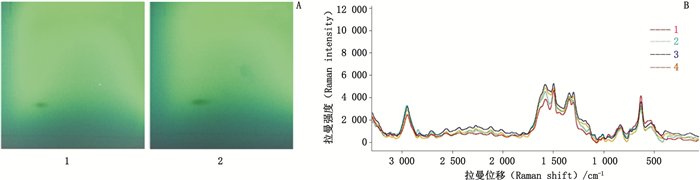
|
A:TLC 1.芦丁对照品(rutin reference substance)2.槐花样品(Sophorae Flos sample) B:SERS 1.芦丁对照品斑点(spot of rutin reference substance)2.对照品斑点重复试验(reproducibility test of reference substance spot)3.槐花样品比移值相同斑点(spots with same Rf value in Sophorae Flos)4.样品比移值相同斑点重复试验(reproducibility test of spots with same Rf value in Sophorae Flos) 图 12 槐花中芦丁成分检测 Fig.12 Detection of rutin in Sophorae Flos |
本实验采用柠檬酸三钠还原硝酸银制备的银溶胶[10-12]作为表面增强剂。
4.1.1 反应条件将加热至沸腾的150 mL硝酸银溶液倒入至250 mL的烧杯中,并置于加热的磁力搅拌器上持续加热,以较快的速度滴加柠檬酸三钠溶液(10 mL),持续加热搅拌,实验中发现红外线加热器设定超过15档位,磁力搅拌器转速600 r·min-1时会引起反应速度过快,形成银镜效应,所以转速设定为500 r·min-1;红外线加热器设定为13档位,通过柠檬酸三钠溶液在1、5、10 min内全部加入,对银溶胶的粒径进行考察,确定加入时间5 min。
4.1.2 稳定性将制备的银溶胶在室温下避光保存,通过稳定性考察发现,制备后3 d内银溶胶的增强作用基本不变,3~7 d银溶胶由于氧化作用[13],颜色由灰色逐渐变成黑灰色,增强作用逐渐减弱[13-15]。
4.2 TLC-SERS 4.2.1 SERS的增强机理本实验以银溶胶作为表面增强剂,金属银原子核外有空轨道,槲皮素与芦丁分子中氧原子含有孤对电子,容易吸附于银溶胶微粒活位,金属表面上的局域场增强会使分子的激发速率增加;同时,金属颗粒的极化偶极子与分子的极化偶极子的相同位分量的耦合作用,会使分子激发态的发射速率增大,导致拉曼散射增强幅度较大,形成SERS。
4.2.2 SERS的解析利用SERS技术对吸附分子进行鉴别,首先要知道分子常规拉曼光谱的归属,然后将SERS与其比较,通常SERS谱带位置与常规拉曼光谱差别不大,但谱带增宽,强度增大104~106倍,灵敏度显著提高,可用于化合物痕量鉴别。
4.2.3 TLC色谱条件在《中国药典》2015年版一部给出的色谱条件基础上,对黄蜀葵花与槐花鉴别进行了3项改进:一是采用二维TLC作为黄蜀葵花与槐花的分离手段,提高待测成分与相邻成分的分离度,避免滴加银溶胶时,边缘与其他成分相遇,影响SERS;二是因为需要分别对样品中的槲皮素与芦丁进行原位SERS检测,二者在365 nm波长下不产生荧光,故以硅胶GF254薄层板替代了原来的硅胶G薄层板,分别在日光与254 nm波长项下定位后进行SERS检测;三是因为铝合金板与玻璃板中硅胶的厚度不同将导致载药量不同,故对点样量进行了调整。
4.3 拉曼微测技术本实验用拉曼光谱仪器中,在外光路系统的样品池前安装了一常规光学显微镜,样品用量可少到10-12~10-15g级,显微镜可将激光聚焦于仅为3 μm的面积上。这样可获得某一特定频率下扫描后的痕量成分二维平面分布情况(图 3-A),根据此处的宏观图像,可将激光束的扫描范围缩减致样品与银基体表面结合的密集处,从而快速准确地定位于样品与银基体表面活位结合点上,并获得该点的SERS(图 3-B)。拉曼普通检测技术,是在没有二维平面宏观图像指引的情况下,对样品与银基体表面活位结合点进行盲目搜寻检测,费时费力,重复性差。故拉曼微测技术更适于TLC-SERS的检测。
| [1] |
张志琴, 朱双雪. 槲皮素的药理活性与临床应用研究进展[J]. 药学研究, 2013, 32(7): 400. ZHANG ZQ, ZHU SX. Research progress on pharmacological activities and clinical application of quercetin[J]. Pharm Res, 2013, 32(7): 400. |
| [2] |
林静. 芦丁的临床药理特点[J]. 中国临床药理学杂志, 2009, 25(3): 256. LIN J. Clinical pharmaceutical special of rutin[J]. Chin J Clin Pharmacol, 2009, 25(3): 256. DOI:10.3969/j.issn.1001-6821.2009.03.019 |
| [3] |
延玺, 刘会青, 邹永青, 等. 黄酮类化合物生理活性及合成研究进展[J]. 有机化学, 2008, 28(9): 1534. YAN X, LIU HQ, ZOU YQ, et al. Physiological activities and research advance in synthesis of flavonoids[J]. Chin J Org Chem, 2008, 28(9): 1534. |
| [4] |
中华人民共和国药典2015年版.一部[S].2015: 354 ChP 2015.VolⅠ[S].2015: 354 |
| [5] |
张雁, 尹利辉, 冯芳. 拉曼光谱分析法的应用介绍[J]. 药物分析杂志, 2009, 29(7): 1236. ZHANG Y, YIN LH, FENG F. Introduct the application of Raman scattering method[J]. Chin J Pharm Anal, 2009, 29(7): 1236. |
| [6] |
朱自莹, 顾仁敖, 陆天虹. 拉曼光谱在化学中的应用[M]. 沈阳: 东北大学出版社, 1998: 71. ZHU ZY, GU RA, LU TH. Apply of Raman Spectroscopy in Chemistry[M]. Shenyang: Press of Northeast University, 1998: 71. |
| [7] |
JOHN RF, KAZUO N, CHRIS WB. Introductory Raman Spectroscopy[M]. New York: Academic Press, 2002: 211.
|
| [8] |
苏松柏, 张永萍, 张丽丽, 等. 拉曼光谱在中药质量控制中的应用[J]. 中国实验方剂学杂志, 2011, 17(8): 284. SU SB, ZHANG YP, ZHANG LL, et al. Review on Raman spectroscopy application in quality control of traditional Chinese medicine[J]. Chin J Exp Tradit Med Form, 2011, 17(8): 284. DOI:10.3969/j.issn.1005-9903.2011.08.085 |
| [9] |
王玉, 李忠红, 张正行, 等. 拉曼光谱在药物分析中的应用[J]. 药学学报, 2004, 39(9): 764. WANG Y, LI ZH, ZHANG ZX, et al. Applications of Raman spectroscopy in pharmaceutical analysis[J]. Acta Pharm Sin, 2004, 39(9): 764. DOI:10.3321/j.issn:0513-4870.2004.09.022 |
| [10] |
贾宝申, 哈斯乌力吉, 林翔, 等. 表面增强拉曼光谱活性基底的制备及其应用研究[J]. 食品安全质量检测学报, 2014, 5(5): 1490. JIA BS, HASI WLJ, LIN X, et al. Preparation of Raman surface-enhanced scattering substrate and its application[J]. J Food Safe Qual, 2014, 5(5): 1490. |
| [11] |
SANCI R, VOLKAN M. Surface-enhanced Raman scattering(SERS)studies on silver nanorod substrates[J]. Sens Actuators B, 2009, 139(1): 150. DOI:10.1016/j.snb.2008.10.033 |
| [12] |
方芳.纳米银溶胶的制备优化及TLC-Dynamic SERS方法研究[D].上海: 第二军医大学, 2016 FANG F.Preparation and Optimization of Silver Colloids and the Study of TLC-Dynamic Method[D].Shanghai: The Second Military Medical University, 2016 |
| [13] |
李秀明, 李金阳, 刘新兰. 纳米银溶胶稳定性的考察及其对表面增强拉曼光谱检测的影响[J]. 药物分析杂志, 2013, 33(6): 1048. LI XM, LI JY, LIU XL. Stability of nano silver particles and the influence on surface-enhanced Raman spectroscopic detection[J]. Chin J Pharm Anal, 2013, 33(6): 1048. |
| [14] |
ZHENG J, HE LL. Surface-enhanced Raman spectroscopy for the chemical analysis of food[J]. Compr Rev Food Sci Food Saf, 2014, 13(3): 317. DOI:10.1111/crf3.2014.13.issue-3 |
| [15] |
SCHLUCKER S. Surface-enhanced Raman spectroscopy:conceptsand chemical applications[J]. Angew Chem Int Ed, 2014, 53(19): 4756. DOI:10.1002/anie.201205748 |
 2019, Vol. 39
2019, Vol. 39 
