2. 威海市食品药品检验检测中心, 威海 264200;
3. 天津科伦药物研究有限公司, 天津 300457
2. Weihai Center for Food and Drug Control and Test, Weihai 264200, China;
3. Tianjin Kelun Medicine Research Co., Ltd., Tianjin 300457, China
二陈丸由陈皮、制半夏、茯苓及甘草4味传统中药组成,具有燥湿化痰及理气和胃之功效,可用于痰湿停滞导致的咳嗽痰多、胸脘胀闷、恶心呕吐[1]。现代药理学研究显示,二陈丸具有镇咳、平喘、祛痰、止呕、保肝、抗病毒以及免疫调节等多种药理作用[2]。研究表明,陈皮中的柚皮苷、橙皮苷等黄酮类成分可促进肠蠕动及胃排空,从而达到止呕的作用,且辛弗林等生物碱类成分具有松弛支气管平滑肌的作用[3];甘草中的甘草酸具有显著的抗炎、抗病毒作用[4],甘草苷具有止咳、祛痰等药理作用[5-6];茯苓酸为茯苓的主要活性成分之一,具有显著的抗炎活性[7];β-谷甾醇为半夏及甘草的共有成分,具有明显的止咳、平喘、祛痰等药理作用[8-9]。二陈丸现行质量标准收载于2015年版《中华人民共和国药典》一部中,其含量测定项仅以橙皮苷为指标成分进行研究[1],且文献报道也均为单指标成分质量控制[10-12],本品化学成分较为复杂,单指标成分控制难以保证中药复方制剂的多靶点、多途径的整体疗效,也制约了二陈丸的市场拓展。
电雾式检测器(CAD)是近年来迅速发展的一种新型高灵敏度检测器,与传统的紫外二极管阵列及蒸发光散射检测器相比,具有检测灵敏及重复性好等优势[13]。本实验建立HPLC-CAD法同时测定二陈丸中柚皮苷、橙皮苷、甘草苷、甘草酸、辛弗林、茯苓酸及β-谷甾醇7个活性成分的含量,实现了该品种的多成分质量控制,操作简便,准确度高,为二陈丸质量标准规范化研究提供理论依据。
1 仪器与试药Thermo Ultimate 3000高效液相色谱仪-L9838二极管阵列检测器-Corona Veo电雾式检测器(Thermo Fisher公司);Thermo Hypersil ODS色谱柱(250 mm×4.6 mm,5 μm;Thermo Fisher公司);KQ-400DB型超声波清洗器(昆山市超声仪器有限公司);SQP型千分之一天平、CPA225D型十万分之一天平、MSE型百万分之一天平(Sartorius公司)。
对照品柚皮苷(批号110722-201714,供含量测定用)、橙皮苷(批号110827-201703,供含量测定用)、甘草苷(批号111610-201607,供含量测定用)、辛弗林(批号110727-201809,供含量测定用)、β-谷甾醇(批号111327-201712,含量以98%计),中国食品药品检定研究院;对照品甘草酸(批号458980010,含量以98%计),比利时Acros公司;茯苓酸对照品(批号161200-92-9,含量以98%计),上海同田生物技术股份有限公司。
二陈丸(北京同仁堂制药有限公司,共6批,批号分别为3080124、2080743、4080125、4082012、7081315、9082022;兰州佛慈制药股份有限公司,共3批,批号分别为20171119、20171227、20180221);陈皮、制半夏、茯苓及甘草药材经威海市食品药品检验检测中心邢晔忠副主任药师鉴定,分别为芸香科植物橘Citrus reticulate Blanco的干燥成熟果皮、天南星科植物半夏Pinellia ternata(Thunb.)Breit.的干燥块茎、多孔菌科植物茯苓(Poria cocos(Schw).Wolf)的干燥菌核以及豆科植物甘草(Glycyrrhiza uralensis Fisch.)的干燥根和根茎。
乙酸乙酯(分析纯)和甲醇(分析纯),天津康科德科技有限公司;甲醇(HPLC级)、甲酸(LC-MS级)和甲酸铵(LC-MS级),Fisher试剂公司;水为自制超纯水。
2 方法与结果 2.1 色谱条件色谱柱:Thermo Hypersil ODS(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-10 mmol·L-1甲酸铵(甲酸调pH至5.0)(B),梯度洗脱(0~5 min,10%A;5~25 min,10%A→35%A;25~35 min,35%A→40%A;35~40 min,40%A→60%A;40~45 min,60%A→75%A);流速:0.8 mL·min-1;柱温:30 ℃;CAD雾化器温度:35 ℃;进样量:20 μL。
2.2 溶液制备 2.2.1 混合对照品溶液精密称取柚皮苷、甘草苷、辛弗林及β-谷甾醇的对照品适量,分别置于10 mL量瓶中,加甲醇溶解并稀释至刻度,分别制成含柚皮苷、甘草苷、辛弗林及β-谷甾醇分别为0.41、0.59、0.18、0.19 mg·mL-1的对照品储备液;分别精密称取橙皮苷、甘草酸及茯苓酸的对照品适量,置于同一10 mL量瓶中,精密加入柚皮苷、甘草苷、辛弗林及β-谷甾醇的对照品储备液各1.0 mL,加甲醇稀释至刻度,摇匀,制成含柚皮苷、橙皮苷、甘草苷、甘草酸、辛弗林、茯苓酸及β-谷甾醇质量浓度分别为0.041、0.598、0.059、0.241、0.018、0.402及0.019 mg·mL-1的混合对照品母液;精密移取混合对照品母液1.0 mL,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,制成每1 mL含柚皮苷0.004 1 mg,橙皮苷0.059 8 mg,甘草苷0.005 9 mg,甘草酸0.024 1 mg,辛弗林0.001 8 mg,茯苓酸0.040 2 mg及β-谷甾醇0.001 9 mg的混合对照品溶液。
2.2.2 供试品溶液取本品适量并研细,取约1 g,精密称定,置索氏提取器中,加乙酸乙酯约100 mL,加热回流2 h,滤过,滤液浓缩至干,残渣加甲醇约20 mL使分散溶解,转移至100 mL量瓶中;药渣挥干,加甲醇约70 mL继续加热回流6 h,放冷,将提取液转移至上述100 mL量瓶中,加甲醇至刻度,摇匀,精密量取5 mL,置10 mL量瓶中,加甲醇至刻度,摇匀,过滤,取续滤液,即得。
2.2.3 阴性样品溶液按制剂处方工艺分别制备不含陈皮、制半夏、茯苓及甘草的4种阴性样品,按供试品溶液制备方法操作,分别得缺陈皮,缺半夏,缺茯苓及缺甘草的阴性样品溶液。
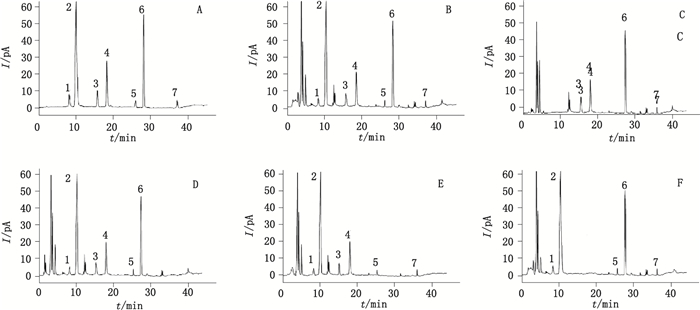
2.3 系统适用性试验分别取混合对照品溶液、供试品溶液及缺陈皮,缺半夏,缺茯苓、缺甘草的阴性样品溶液,按“2.1”项下色谱条件进样测定,记录色谱图,典型图谱见图 1。结果柚皮苷、橙皮苷、甘草苷、甘草酸、辛弗林、茯苓酸及β-谷甾醇与其他组分色谱峰的分离度均不低于1.5,理论塔板数均不低于8 000,阴性样品图谱显示其他成分对待测成分的测定均无干扰。
|
1.柚皮苷(naringin)2.橙皮苷(hesperidin)3.甘草苷(liquiritin)4.甘草酸(glycyrrhizic acid)5.辛弗林(synephrine)6.茯苓酸(pachymic acid)7.β-谷甾醇(β-sitosterol) 图 1 混合对照品溶液(A)、供试品溶液(B)及缺陈皮阴性样品(C)、缺制半夏阴性样品(D)、缺茯苓阴性样品(E)、缺甘草阴性样品(F)HPLC色谱图 Fig.1 HPLC chromatograms of mixed reference standards (A), sample(B), negative sample without Citri Reticulatae Pericarpium (C), negative sample without Pinelliae Rhizoma (D), negative sample without Poria (E) and without Glycyrrhizae Radix et Rhizoma (F) |
精密量取“2.2.1”项下方法配制的混合对照品母液1.0 mL,分别置5、10、25、50及100 mL量瓶中,加甲醇稀释至刻度,摇匀,得5种不同浓度的线性系列溶液,按“2.1”项下色谱条件进样测定各峰面积,以进样浓度X(μg·mL-1)为横坐标,峰面积Y为纵坐标,进行线性回归,得各成分的回归方程及线性范围,见表 1。
|
|
表 1 7个活性成分的线型方程、相关系数和线性范围(n=5) Tab.1 Regression equations, correlation coefficients and linear ranges of seven active components |
取“2.2.1”项下配制的混合对照品溶液连续进样6针,记录各色谱峰峰面积,结果柚皮苷、橙皮苷、甘草苷、甘草酸、辛弗林、茯苓酸及β-谷甾醇峰面积的RSD分别为1.6%、1.2%、1.4%、1.8%、0.91%、1.4%和1.9%,表明进样精密度良好。
2.6 重复性试验取批号为3080124的样品适量,按“2..2.2”项下方法平行制备6份供试品溶液,分别进样分析,以外标法计算样品中柚皮苷、橙皮苷、甘草苷、甘草酸、辛弗林、茯苓酸及β-谷甾醇的平均含量分别为0.71、12.01、1.19、4.50、0.26、8.04及0.26 mg·g-1,RSD分别为2.2%、1.7%、2.0%、1.7%、1.4%、1.8%和1.9%。结果表明方法重复性良好。
2.7 稳定性试验取批号为3080124的供试品溶液,分别于室温下放置0、2、4、6、12、24及48 h后进样分析,记录各时间点峰面积,计算柚皮苷、橙皮苷、甘草苷、甘草酸、辛弗林、茯苓酸及β-谷甾醇峰面积的RSD分别为1.8%、1.4%、1.3%、2.0%、1.3%、1.7%和1.9%。结果显示供试品溶液在室温下48 h内稳定。
2.8 加样回收率试验取已知含量的二陈丸样品(批号3080124,柚皮苷、橙皮苷、甘草苷、甘草酸、辛弗林、茯苓酸及β-谷甾醇的含量分别为0.71、12.01、1.19、4.50、0.26、8.04及0.26 mg·g-1)6份,每份约0.5 g,精密称定,置索氏提取器中,分别加入柚皮苷(0.361 mg·mL-1)、橙皮苷(5.908 mg·mL-1)、甘草苷(0.606 mg·mL-1)、甘草酸(2.208 mg·mL-1)、辛弗林(0.126 mg·mL-1)、茯苓酸(3.925 mg·mL-1)及β-谷甾醇(0.120 mg·mL-1)的对照品溶液各1 mL,按“2.2.2”项下方法制成供试溶液,进样分析,计算7个成分的平均加样回收率及RSD,结果见表 2,表明方法的准确性良好。
|
|
表 2 二陈丸中7个成分的加样回收率 Tab.2 Recovery of seven constituents in Erchen pills |
取各批次的二陈丸样品各适量,研成细粉,分别按“2.2.2”项下方法制备供试品溶液,进样测定,以外标法计算样品中7个活性成分的含量,结果见表 3。
|
|
表 3 二陈丸中7个活性成分的含量测定结果(mg·g-1) Tab.3 Contents of seven active components in Erchen pills |
2015年版《中华人民共和国药典》二陈丸的含量测定是以醋酸水-甲醇等度洗脱,实际应用中发现除橙皮苷外,其他6个成分在该条件下均难以实现基线分离,且峰形拖尾。本实验考察了甲醇-10 mmol·L-1甲酸铵、乙腈-10 mmol·L-1甲酸铵、甲醇-10 mmol·L-1乙酸铵以及乙腈-10 mmol·L-1乙酸铵等几种不同的流动相体系,结果显示甲醇-10 mmol·L-1甲酸铵系统下各成分分离度较佳,并考察采用甲酸分别调节至不同pH,结果显示pH为5.0时基线平稳,各色谱峰对称性及理论塔板数均为最佳。
3.2 供试品溶液制备方法的选择首先以乙酸乙酯为溶剂,旨在提取极性相对较弱的β-谷甾醇,经对加热回流时间1、2及3 h进行考察,结果显示2 h后其含量不再增加,说明2 h可提取完全;其次以甲醇为溶剂,对其他6个成分进行提取,经对加热回流时间4、6及8 h进行考察,结果显示6 h后各成分含量均不再增加,说明6 h可提取完全。
3.3 检测器的选择取各成分对照品溶液,采用DAD检测器进行全波长扫描,发现柚皮苷与橙皮苷的最大吸收波长为284 nm,甘草苷、辛弗林最大吸收为276 nm,甘草酸、茯苓酸及β-谷甾醇最大吸收分别为254、242及210 nm,不同成分紫外光谱各不相同,最大吸收波长差异较大,传统的HPLC-UV法难以实现同时测定。将以上各波长下样品的DAD图谱与CAD检测图谱进行比较,发现CAD检测器获得的色谱峰个数显著多于DAD图谱,且灵敏度高,基线更平稳,故选择CAD检测器进行各成分的含量测定研究。
3.4 检测结果分析结果显示,柚皮苷、橙皮苷等7个成分为不同厂家不同批次二陈丸的共有成分,橙皮苷含量均符合2015年版《中华人民共和国药典》标准(10.0 mg·g-1)[1]。各批次样品中各成分含量差异均较小,说明药品质量稳定。各批次样品中7个成分的含量由高至低均依次为橙皮苷、茯苓酸、甘草酸、甘草苷、柚皮苷、辛弗林、β-谷甾醇(辛弗林与β-谷甾醇含量接近)。将橙皮苷的CAD检测结果与文献报道的紫外检测器检测结果[12]相比较,橙皮苷含量基本一致,说明CAD法检测结果准确、可靠。
本实验建立了HPLC-CAD法同时测定二陈丸中柚皮苷、橙皮苷、甘草苷、甘草酸、辛弗林、茯苓酸及β-谷甾醇7个活性成分的分析方法,并且实现了处方中陈皮、制半夏、茯苓及甘草4种药味主要化学成分的全覆盖,方法简便、准确,重复性好,为二陈丸的质量研究提供了更加全面的方法。后续实验中将采用所建立的方法对更多批次样品进行分析检测与数据积累,以期进一步完善二陈丸的质量标准。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 438 ChP 2015.Vol Ⅰ[S].2015: 438 |
| [2] |
陈锐. 二陈丸临床应用解析[J]. 中国社区医师, 2012(41): 10. CHEN R. Analysis of clinical application of Erchen pills[J]. Chin Commun Doct, 2012(41): 10. |
| [3] |
许姗姗, 许浚, 张笑敏, 等. 常用中药陈皮、枳实和枳壳的研究进展及质量标志物的预测分析[J]. 中草药, 2018, 49(1): 35. XU SS, XU J, ZHANG XM, et al. Research progress on Citri Reticulatae Pericarpium, Aurantii Fructus Immaturus, and Aurantii Fructus and Q-marker predictive analysis[J]. Chin Tradit Herb Drugs, 2018, 49(1): 35. |
| [4] |
冯月, 吴文夫, 魏建华, 等. 甘草酸及甘草苷的提取纯化方法和药理作用研究进展[J]. 人参研究, 2012(3): 46. FENG Y, WU WF, WEI JH, et al. The extraction and purification methods and pharmacological research progress of glycyrrhizic acid and liquiritin[J]. Ginseng Res, 2012(3): 46. DOI:10.3969/j.issn.1671-1521.2012.03.014 |
| [5] |
CONG J, LIN B. Separation of Liquirin by simulated moving bed chromatography[J]. J Chromatogr A, 2007, 1145(1): 190. |
| [6] |
SUN YX, TANG Y, WU AL, et al. Neuroprotective effect of liquiritin against focal cerebral ischemia/reperfusionin mice via its antioxidant and anti apoptosis properities[J]. J Asian Net Prod Res, 2010, 12(12): 1051. DOI:10.1080/10286020.2010.535520 |
| [7] |
黄斯, 潘雨薇, 蓝海, 等. 茯苓酸药理学研究进展[J]. 中成药, 2015, 37(12): 2719. HUANG S, PAN YW, LAN H, et al. Progress in pharmacological studies of pachymic acid[J]. Chin Tradit Pat Med, 2015, 37(12): 2719. |
| [8] |
畅行若, 徐清河, 朱大元, 等. 甘草新木脂素的分离与化学结构[J]. 药学学报, 1983, 18(1): 45. CHANG XR, XU QH, ZHU DY, et al. The isolation and structural elucidation of liconeolignan from G.uralensis[J]. Acta Pharm Sin, 1983, 18(1): 45. |
| [9] |
张小斌. 不同产地半夏中β-谷甾醇含量比较[J]. 山西农业科学, 2008(2): 81. ZHANG XB. Comparison of the content of β-sitosterol in Pinellia ternata from different habitats[J]. J Shanxi Agric Sci, 2008(2): 81. |
| [10] |
胡蓓莉, 张艺, 李琴韵, 等. GC测定二陈丸中柠檬烯的含量[J]. 中成药, 2004, 26(6): 460. HU BL, ZHANG Y, LI QY, et al. Determination of limonene in Erchen pills by GC[J]. Chin Tradit Pat Med, 2004, 26(6): 460. DOI:10.3969/j.issn.1001-1528.2004.06.011 |
| [11] |
王宏磊, 郭书好, 徐石海, 等. TLCS法测定二陈丸中的β-谷甾醇[J]. 暨南大学学报(自然科学版), 2004, 25(1): 79. WANG HL, GUO SH, XU SH, et al. Determination of β-sitosterol in Erchen pills by TLCS[J]. J Jinan Univ(Nat Sci), 2004, 25(1): 79. |
| [12] |
胡小刚, 郭书好, 何康明, 等. 反相高效液相色谱法测定二陈丸中橙皮苷的含量[J]. 药物分析杂志, 2001, 21(4): 283. HU XG, GUO SH, HE KM, et al. RP-HPLC determination of hesperidin in Erchen pills[J]. Chin J Pharm Anal, 2001, 21(4): 283. |
| [13] |
刘路, 高旋, 杨永健. HPLC-电雾式检测器的应用[J]. 中国医药工业杂志, 2012, 43(3): 227. LIU L, GAO X, YANG YJ. Application of HPLC-charged aerosol detection[J]. Chin J Pharm, 2012, 43(3): 227. DOI:10.3969/j.issn.1001-8255.2012.03.019 |
 2019, Vol. 39
2019, Vol. 39 