衣原体是一类在真核细胞内寄生、有独特发育周期,能通过细菌滤器的原核生物型微生物[1]。肺炎衣原体于1986年首次被发现,在全世界范围内分布,通过气溶胶在人群传播,主要引起各种呼吸系统感染[2]。另外,肺炎衣原体的感染还可能与哮喘、冠心病及动脉粥样硬化的发病、慢性阻塞性肺疾病的急性发作和恶化有关[3-4]。目前,肺炎衣原体已是继肺炎链球菌和流感嗜血杆菌之后引起社区获得性肺炎的主要病原体[5-6]。由于肺炎衣原体感染临床症状的多变性,单纯依靠临床症状或影像学不能明确诊断,因此,实验室诊断学具有重要作用[7]。通过在国家食品药品监督管理总局网上的查询,目前有8种国内外企业生产的酶联免疫方法(ELISA)的肺炎衣原体IgG抗体检测试剂盒(以下简称CP-IgG试剂盒)取得了注册证,尚有3种进口试剂盒尚未取得注册证,在国内以科研用途购买和使用。本研究在样本筛选的基础上,通过多家单位的协作标定和实验验证,建立了适用于ELISA方法的肺炎衣原体IgG抗体检测试剂用国家参考品,用于该类试剂盒的质量评价。
1 材料与仪器 1.1 材料原料血浆由山西康宝生物制品股份有限公司、华兰生物工程股份有限公司、深圳市卫光生物制品股份有限公司提供。
1.2 试剂盒CP-IgG试剂盒(酶联免疫法)分别购自北京现代高达生物技术有限责任公司(批号201507002)、欧蒙医学诊断(中国)有限公司(批号E150504AE)、珠海丽珠试剂股份有限公司(批号2015100208)、北京荣志海达生物科技有限公司(批号191-T0778000)、深圳安群生物工程有限公司(批号20150925)、美国美德声科学技术公司(批号123MF1-4)、北京贝尔生物工程有限公司(批号20151201)、德国维润赛润公司(批号SKF.AV)、MIKROGEN DIAGNOSTIK公司(批号CHLPG-106),RecomLine Chlamydia IgG印迹法试剂盒购自MIKROGEN DIAGNOSTIK(批号LCY071502)。
2 方法与结果 2.1 试验方法 2.1.1 样本初筛选择5种国产和进口的CP-IgG试剂盒,筛选约600份血浆小样,根据试剂盒说明书的结果判断方法和A值的分布情况,确定候选组盘样本,进行样本确认。
2.1.2 样本确认将初筛的候选样本,选择9种试剂盒再次进行检测,同时用免疫印迹法试剂盒进行了样本确认,最终选定10份阴性参考品、10份阳性参考品、1份低检测下限参考品和1份重复性参考品作为组盘样本,根据实验情况调整了检测下限样本的稀释方法,应用1份抗体确证阴性的样本连续倍比稀释并组成L1-L5共5份样本,其中L1-L4为原倍浓度和1:2、1:4、1:8稀释度,L5为阴性样本;第2轮验证选定的阴性参考品、阳性参考品和重复性参考品不变,分装和保存样本,确定质量标准。
2.1.3 协作标定将组盘的参考品和验证方案发送至5家试剂生产厂家和实验室进行验证,以确认样本选择的科学性和考核指标设立的合理性。
2.1.4 均匀性和稳定性检验参照国家计量技术规范中有关均匀性检验的要求,随机抽取3套参考品进行均匀性检验;随机抽取3套参考品模拟用户使用习惯和运输条件,分别进行4、37 ℃保存条件下的稳定性检验和-20 ℃条件下反复冻融的稳定性检验。
2.2 结果 2.2.1 样本初筛根据试剂盒说明书中规定的临界值(cut-off值)判定实验结果阴阳性,同时考虑阴性样本和阳性样本吸收度A值强弱的分布情况,从约600份样本中筛选出不同强弱程度的13份候选阴性参考品、13份候选阳性参考品(样本编号见表 1)、1份候选检测下限样本(R31)和2份候选重复性样本(R24、R48),R31号样本为强阳性样本,R24号和R48号样本为中等强度阳性样本,R24的A值稍高,随后选择9种试剂盒进行样本确认。
|
|
表 1 9种试剂盒对阴性样本和阳性样本的检验结果 Tab.1 Test results of negative and positive samples by 9 ELISA kits |
9种试剂盒的检测结果发现,除试剂盒E与其他试剂盒检测结果一致性较差外,其余各试剂盒对样本检测结果的一致性较好(表 1);检测下限采用高浓度样本倍比稀释至1:16检测,其中D试剂的检测能力最弱(检测下限 < 1:4),A、C、G3种试剂检测能力较强(检测下限 > 1:16);除A试剂孔间重复性较差(9%~12%)外,其他试剂孔间重复性较好(均 < 7%)。结合免疫印迹试验结果(图 1),阴性样本27号,含较多弱显色的杂带;阳性样本中R13条带强度不够,ELISA检测中结果一致性差,均从组盘样本中删除。同时根据不同试剂盒的cut-off值考虑组盘的阴性样本和阳性样本中,样本A值的分布均体现不同的强弱,兼顾各试剂检测结果的一致性,最终选定10份阴性样本(P1027、P1620、36、56、65、162、207、274、293、245)、10份阳性样本(R1、R19、R20、R25、R33、R40、R42、R46、R48)、1份检测下限样本(R31)和1份重复性样本(R24)作为组盘样本,P1529作为检测下限样本的稀释液。

|
图 1 候选样本的免疫印迹法试验结果 Fig.1 The immunoblotting results of candidate samples |
对确定组盘的样本,再次用5种CP-IgG试剂盒检验,其中检测下限参考品(R31)用已知阴性样本(P1529)做1:2、1:4、1:8稀释,与原倍浓度及稀释用阴性样本共同组成5份检测下限参考品,拟定参考品考核指标。阴性参考品符合率:10份,编号N01~N10,至少应有9份样本检测为阴性;阳性参考品符合率:10份,编号P01~P10,至少应有9份样本检测为阳性;检测下限参考品符合率:5份,编号L01~L05,L01~L03应为阳性,L04可为阳性或阴性,L05应为阴性;重复性参考品符合率:1份,编号为R,连续检测10次,要求均为阳性,且RSD应不大于10.0%。5种试剂盒检测结果显示,除1种试剂重复性略高于标准规定外,其余指标均能满足要求。
2.2.4 均匀性检验对抽取的3套参考品进行全项目检验,3次检验结果各样品均符合要求,对3次测定中重复性样本检测结果进行方差分析,F=2.246,P=0.123,按0.05的显著性水平,3组测定结果没有显著性差异,均匀性较好。
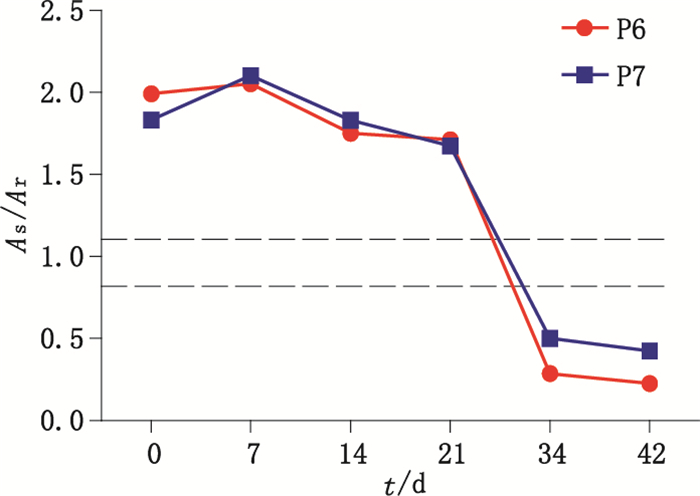
2.2.5 稳定性检验 2.2.5.1 4 ℃保存随机抽取1套参考品,在4 ℃冰箱放置并分别在7、14、21、34、42 d用CP-IgG试剂盒检测全部组盘国家参考品,记录结果,与0 d结果作为比对。10份阴性参考品及5份检测下限参考品不同时间的检验结果均无显著性差异;对重复性参考品的检测结果显示,除第34天结果与第0天结果无显著性差异(P > 0.05)外,其余各组均与第0天结果有显著差异(P < 0.05),但其A值与标准品的比值均不影响结果的判断;对阳性参考品中的P6和P7 2份样本6次检测数据进行分析(图 2),放置34 d后,样本A值与标准品A值的比值(简称比值)与放置0 d比有显著性差异(P < 0.05),且结果判断由阳性变为阴性,其余8份阳性参考品不同时间的检验结果无显著性差异。
|
图 2 2份阳性参考品4 ℃保存的稳定性分析 Fig.2 The stability analysis of 2 positive samples kept at 4 ℃ |
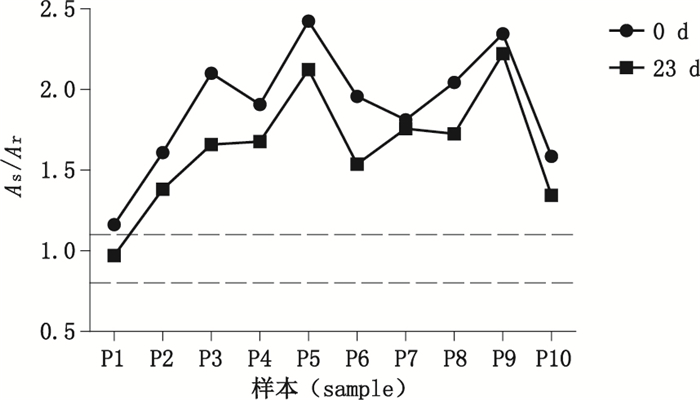
随机抽取1份参考品,在37 ℃孵箱放置并分别在3、7、14、23 d用CP-IgG试剂盒检测全部组盘国家参考品,记录结果,与0 d结果比对分析发现,随着加热时间的延长,各样本比值总体呈现缓慢下降趋势,10份阳性参考品第23天结果与第0天结果T检验结果有显著性差异(P < 0.05),P01样本在第14天和第23天的结果判断出现差异(比值< 1.1,样本由阳性判断变为临界判断)。
|
图 3 10份阳性参考品37 ℃保存的稳定性分析 Fig.3 The stability analysis of 10 positive samples kept at 37 ℃ |
随机抽取1套参考品,在-20 ℃冰箱放置并分别于14、21、26、34 d复融检测全部组盘国家参考品,记录结果,与0 d结果进行比对,考察冻融多次的稳定性,在-20 ℃保存1个月时间的情况下,4次冻融各样本的A值无显著性差异(P > 0.05)。
3 讨论体外诊断试剂标准物质是实现临床检验标准化的主要工具[8],同时,国家参考品的制备和标定对于诊断试剂的质量控制至关重要[9-11]。本研究通过对血浆样本的筛选,建立了用于评价ELISA方法的肺炎衣原体IgG抗体检测试剂盒的国家参考盘。由于目前尚无国际组织或其他地区、国家发布相应的参考品供参考,因此,在血浆样本的筛选过程中,尽可能使用了多种在我国临床检验和科研实验室中使用率较高的CP-IgG试剂盒。对参考盘的多次验证结果分析发现,有个别生产厂家的试剂盒对参考盘中样本的检测结果与其他厂家试剂盒的结果差别较大,如样本确认中使用的试剂盒E。这可能由产品原料、工艺等造成,也可能是企业内部质控盘样本的选择存在问题,因此结合多家试验结果及免疫印迹试验结果,未采纳试剂盒E的结果。参考盘制备过程中,通过免疫印迹试验结果确认样本的阳性或阴性,同时考虑样本A值的分布强弱,阳性参考品中有较弱的样本入选,阴性参考品中有较强的样本入选,兼顾各家试剂检测一致性,最终选定10份阴性样本作为阴性参考品,10份阳性样本作为阳性参考品,1份检测下限样本和1份重复性样本。参考盘中各样本均为血浆基质,与临床预期样本类型一致,有效地避免了基质效应的影响[12]。
根据标准物质的研制要求[13-14],本研究对分装后参考盘的均匀性和稳定性进行了验证。均匀性检验中,随机抽取的3份参考品的全项目检验结果无显著性差异,参考盘的均匀性满足要求。4 ℃条件下的稳定性结果显示,随着放置时间的延长,重复性样本的A值与标准品A值的比值(以下简称比值)虽有下降但均不影响结果的判断。阳性参考品中的P06和P07 2份样本在放置34 d后,样本比值与放置0 d相比有显著性差异(P≤0.05),且结果判断由阳性变为阴性,因此该参考品在4 ℃环境下放置超过1个月的时间会影响参考品的性能,不建议在此温度下长期保存。37 ℃条件下的稳定性结果显示,随着加热时间的延长,各样本比值总体呈现缓慢下降趋势,10份阳性参考品第23天结果与第0天结果T检验结果有显著性差异(P < 0.05),P1样本在第14天和第23天时结果判断出现差异,表明该参考品长期高温放置稳定性下降,应避免高温存放;冻融稳定性结果显示,-20 ℃条件下保存参考盘的稳定性较好,多次冻融虽对参考盘全项检测结果的影响不大,但目测有个别样品冻融后出现悬浮的絮状物,影响样品的取用,因此建议将该参考品保存在-20 ℃及以下的温度环境中[15],但不建议多次反复冻融。
4 结论本研究制备并标定了肺炎衣原体IgG抗体国家参考品,为该类产品的评价提供统一的尺度,有助于我国该类试剂盒生产企业对其相关产品进行质量控制,对试剂盒的注册和上市后监管提供科学有力的保证。
| [1] |
陈学勤, 钱利生. 衣原体主要外膜蛋白的研究进展[J]. 生物技术通讯, 2006, 17(3): 433. CHEN XQ, QIAN LS. Research progressof chlamydia major outer membrane protein[J]. Lett Biotechnol, 2006, 17(3): 433. DOI:10.3969/j.issn.1009-0002.2006.03.038 |
| [2] |
徐莉, 王唯, 李希辉. 急性呼吸道感染患儿肺炎支原体和衣原体感染检测分析[J]. 中国病原生物学杂志, 2017, 12(9): 893. XU L, WANG W, LI XH. Characteristics of the distribution of infections with Mycoplasma pneumoniae and Chlamydia pneumoniae in children with an acute respiratory tract infection and the clinical significance of etiological monitoring[J]. J Pathogen Biol, 2017, 12(9): 893. |
| [3] |
党强, 仝建, 周小果. 肺炎衣原体感染与哮喘急性发作的相关性研究[J]. 中华医院感染学杂志, 2015, 25(4): 794. DANG Q, TONG J, ZHOU XG. Correlative study of chlamydia pneumoniae infections and asthma exacerbations[J]. Chin J Nosocomiol, 2015, 25(4): 794. |
| [4] |
周吕蒙, 肖严, 李忠梅. 肺炎衣原体血清学检测在急性冠状动脉综合征患者中的应用研究[J]. 国际检验医学杂志, 2015, 36(8): 1080. ZHOU LM, XIAO Y, LI ZM. Clinical application of serological detection of Chlamydia pneumonia in patients with acute coronary syndrome[J]. Int J Lab Med, 2015, 36(8): 1080. DOI:10.3969/j.issn.1673-4130.2015.08.029 |
| [5] |
魏田力, 李静宜, 吴赵永. 成人呼吸道感染患者肺炎衣原体感染分析[J]. 临床和实验医学杂志, 2017, 16(16): 1627. WEI TL, LI JY, WU ZY. Infection analysis of chlamydia pneumonia in adult patients with respiratory tract infection[J]. J Clin Exp Med, 2017, 16(16): 1627. DOI:10.3969/j.issn.1671-4695.2017.16.019 |
| [6] |
刘怡雯, 黄晶, 何贵元, 等. 联合检测肺炎支原体和肺炎衣原体在社区获得性肺炎患者中的临床意义[J]. 国际检验医学杂志, 2013, 34(17): 2254. LIU YW, HUANG J, HE GY, et al. The clinical role of mycoplasma pneumoniae and chlamydia pneumoniae detection in patients with community-acquired pneumonia[J]. Int J Lab Med, 2013, 34(17): 2254. DOI:10.3969/j.issn.1673-4130.2013.17.020 |
| [7] |
刘丽君, 凌继祖, 赵福林. 急性呼吸道感染患儿肺炎支原体和肺炎衣原体病原学特征分析[J]. 中国病原生物学杂志, 2017, 12(2): 174. LIU LJ, LING JZ, ZHAO FL. Analysis of the etiological characteristics of Mycoplasma pneumoniae and Chlamydia pneumoniae in children with an acute respiratory infection and an examination of their clinical significance[J]. J Pathogen Biol, 2017, 12(2): 174. |
| [8] |
GB/T 21415-2008/ISO 17511: 2003体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性[S].2008 GB/T 21415-2008/ISO 17511: 2003 In vitro Diagnostic Medical Devices—Measurement of Quantities in Biological Samples—Metrological Traceability of Values Assigned to Calibrators and Control Materials[S].2008 |
| [9] |
宋爱京, 许四宏, 李秀华, 等. HIV抗体确认试剂国家参考品的建立[J]. 中国生物制品学杂志, 2007, 20(3): 209. SONG AJ, XU SH, LI XH, et al. Establishment of national reference for confirmation reagent of HIV antibody[J]. Chin J Biol, 2007, 20(3): 209. DOI:10.3969/j.issn.1004-5503.2007.03.018 |
| [10] |
刘艳, 王玉梅, 黄颖, 等. 甲胎蛋白定量标记免疫分析试剂盒行业标准的实验验证[J]. 药物分析杂志, 2012, 32(5): 899. LIU Y, WANG YM, HUANG Y, et al. Experimental verification of the industry standard for alpha-fetoprotein quantitative labelling immunoassay kit[J]. Chin J Pharm Anal, 2012, 32(5): 899. |
| [11] |
田亚宾, 周海卫, 刘东来, 等. 水痘带状疱疹病毒IgG抗体检测试剂国家参考品的研制[J]. 中国生物制品学杂志, 2017, 30(4): 408. TIAN YB, ZHOU HW, LIU DL, et al. Development of national reference for detection kit of IgG antibody against varicella-zoster virus[J]. Chin J Biol, 2017, 30(4): 408. |
| [12] |
王玉梅, 刘艳, 孙楠, 等. 免疫测定用甲胎蛋白国家标准品的制备与定值[J]. 中国药事, 2014, 28(8): 843. WANG YM, LIU Y, SUN N, et al. Preparation and calibration of national standard material of alpha fetoprotein for immunoassay[J]. Chin Pharm Aff, 2014, 28(8): 843. |
| [13] |
全浩, 韩永志. 标准物质及其应用技术[M]. 第2版. 北京: 中国标准出版社, 2003: 22. QUAN H, HAN YZ. Reference Material and Its Application Technology[M]. 2 nd Ed. Beijing: Standards Press of China, 2003: 22. |
| [14] |
全国标准物质管理委员会. 标准物质的研制、管理与应用[M]. 北京: 中国计量出版社, 2010: 43. National Administrative Committee for CRM's. Development of Reference Materials:Management and Applicantion[M]. Beijing: Metrology Press of China, 2010: 43. |
| [15] |
于晓斐, 张明岩, 杨丹. 温度和湿度对高通量ELISA系统检测人免疫缺陷病毒抗体的S/CO值的影响[J]. 哈尔滨医科大学学报, 2017, 51(1): 61. YU XF, ZHANG MY, YANG D. Effect of temperature and humidity on detection of the S / CO value of anti-HIV by high-throughput ELISA system[J]. J Harbin Med Univ, 2017, 51(1): 61. DOI:10.3969/j.issn.1000-1905.2017.01.015 |
 2019, Vol. 39
2019, Vol. 39 
