随着人类平均寿命的延长,癌症对人类的威胁日益突出。癌是起源于上皮组织的恶性肿瘤,具有细胞分化和增殖异常、生长失去控制、浸润性和转移性等生物学特征,发生过程复杂,分为致癌、促癌、演进3个过程,主要由生活习惯、环境污染与职业性、天然及生物因素等外源性和遗传因素、免疫因素、内分泌因素等内源性引起,主要有胃癌、肺癌、肝癌、大肠癌、乳腺癌、白血病、淋巴癌、鼻咽癌等,其中胃癌、肝癌最为常见。复生康胶囊由喜树果、蒲葵子、莪术、柴胡、绞股蓝等8味中药材加工而成,可活血化瘀、健脾消积,具有增强胃癌、肝癌的放疗、化疗疗效,增强机体免疫功能,改善肝癌患者临床症状等作用。方中喜树果具有抗癌、散结、破血化瘀等作用,主要含有喜树碱、羟基喜树碱、喜树次碱、长春苷内酰胺等成分,其中喜树碱、羟基喜树碱具有较强的抗癌活性;蒲葵子为棕榈科植物蒲葵的干燥成熟果实,具有有败毒抗癌、消瘀止血的作用,主要含有鞣质、酚类、黄酮类等化学成分,其中荭草苷、异荭草苷、牡荆苷和异牡荆苷为其黄酮类主要成分;莪术具有行气破血、消积止痛的作用,主要含有挥发油类、姜黄素等成分,莪术二酮、莪术醇、吉马酮等为其挥发油类主要成分,莪术二酮和吉马酮抗肿瘤生理活性显著,莪术醇为莪术抗癌、抗病毒、抗菌等作用的有效成分。复生康胶囊现行质量标准为国家食品药品监督管理局药品标准[WS-10199(ZD-0199)-2002-2012Z][1],其仅对喜树果所含喜树碱进行了定量测定研究,黄瑞松等[2]采用高效液相色谱法对该制剂中喜树碱进行定量测定及方法学验证,颜栋林等[3]对该制剂中微生物限度检查法方法验证,未检索到对该制剂多成分同时测定的文献报道。中成药复方制剂所含组分复杂,其临床疗效往往是多个成分协同作用的结果,单一成分难以全面地控制药品质量的稳定性和临床疗效的一致性,多指标成分控制已成为中成药复方制剂质量评价的发展趋势,一测多评法不仅普遍应用于同类成分的同时测定,用于不同类成分的测定也逐步得以应用[4-5]。为全面有效地控制复生康胶囊的产品质量,本文以牡荆苷为内标物,建立了牡荆苷与羟喜树碱、喜树碱、荭草苷、异荭草苷、异牡荆苷、莪术二酮和莪术醇之间的相对校正因子,利用相对校正因子计算复生康胶囊中羟喜树碱、喜树碱、荭草苷、异荭草苷、异牡荆苷、莪术二酮和莪术醇的含量,并与外标法所得出结果进行对比,验证所建一测多评法的可行性和准确性。实验结果表明,本文所建立方法检测操作便捷,数据准确,重复性好, 为复生康胶囊的全面质量控制提供了数据支持。
1 仪器与试药 1.1 仪器Waters 2695型高效液相色谱仪(美国Waters公司);CPA225D型千万分之一电子天平(北京赛多利斯仪器有限公司);KQ-300E型数控超声波清洗器(昆山舒美超声仪器有限公司)。
1.2 试药对照品羟喜树碱(100526-201702,含量97.6%)、喜树碱(100532-200401,含量100.0%)、荭草苷(111777-201302,含量97.9%)、异荭草苷(111974-201401,含量94.0%)、牡荆苷(111687-201603,含量95.7%)、莪术二酮(111800-201302,含量99.8%)、莪术醇(100185-201007,含量99.9%)来源于中国食品药品检定研究院;异牡荆苷对照品(29702-25-8,含量98.0%)来源于上海纯优生物科技有限公司;复生康胶囊(规格:每粒装0.38 g,批号160907、161103、170312)来源于广西昌弘制药有限公司;甲醇、乙腈为色谱纯,其他试剂为分析纯。
2 方法与结果 2.1 色谱条件采用Hypersil ODS(4.6 mm×250 mm,5 μm)色谱柱;流动相A为甲醇-乙腈(2:1),流动相B为0.05%冰醋酸溶液,梯度洗脱(0~12 min,21.0%A;12~23 min,21.0%A→35.0%A;23~46 min,35.0%A→52.0%A;46~58 min,52.0%A→60.0%A;58~65 min,60.0%A→21.0%A);0~23 min时在254 nm[6-8]波长下检测羟喜树碱和喜树碱,23~46 min在340 nm[9]波长下检测荭草苷、异荭草苷、牡荆苷和异牡荆苷,46~65 min时在214 nm[10-11]波长下检测莪术二酮和莪术醇;体积流量0.9 mL·min-1;柱温25 ℃;进样量10 µL。
2.2 溶液的制备 2.2.1 混合对照品溶液分别精密称取对照品羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇各适量,用甲醇制成质量浓度分别为0.538、0.776、0.292、0.354、0.238、0.370、0.418、0.346 mg·mL-1的单成分对照品储备溶液。再依次精密吸取各单成分对照品储备溶液2.5、2.5、2.5、2.5、2.5、1.0、2.5、2.5 mL,置同一50 mL量瓶中,用甲醇稀释至刻度,制成羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇质量浓度为26.9、38.8、14.6、17.7、11.9、7.4、20.9、17.3 µg·mL-1的混合对照品溶液。
2.2.2 供试品溶液取复生康胶囊适量,倾出内容物,研细,取约5.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称量,超声(功率300 W,频率40 kHz)提取60 min,放冷,称量,用甲醇补足减失的量,摇匀,过滤,续滤液作为复生康胶囊供试品溶液。
2.2.3 阴性样品溶液按复生康胶囊质量标准项下的处方和制法,分别制备缺喜树果样品、缺蒲葵子样品和缺莪术样品,再按照“2.2.2”项下复生康胶囊供试品溶液制备方法分别制备成喜树果阴性样品溶液、蒲葵子阴性样品溶液和莪术阴性样品溶液。
2.3 方法学考察 2.3.1 系统适用性与专属性试验精密吸取混合对照品溶液、复生康胶囊供试品溶液、喜树果阴性样品溶液、蒲葵子阴性样品溶液和莪术阴性样品溶液各适量,依法进样检测,结果见图 1。阴性样品对测定无干扰,所测色谱峰羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇与其相邻色谱峰均能达到有效分离,理论塔板数按照所测各色谱峰计均大于3 500,分离度均大于1.5。
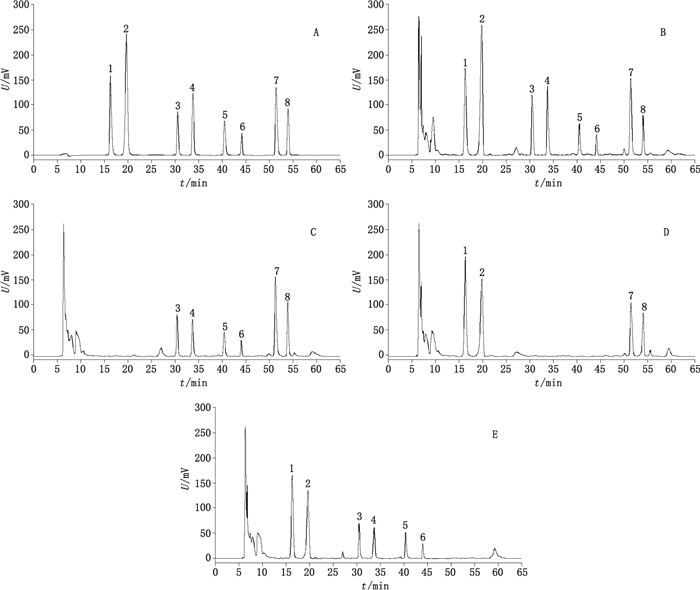
|
1. 羟喜树碱(hydroxycamptothecin) 2. 喜树碱(camptothecine) 3. 荭草苷(orientin) 4. 异荭草苷(isoorientin) 5. 牡荆苷(vitexin) 6. 异牡荆苷(isovitexin) 7. 莪术二酮(curdione) 8. 莪术醇(curcumol) 图 1 混合对照品溶液(A)、复生康胶囊供试品溶液(B)、喜树果阴性样品溶液(C)、蒲葵子阴性样品溶液(D)和莪术阴性样品溶液(E)HPLC色谱图 Fig.1 HPLC chromatograms of mixed reference substances(A), sample solution of Fushengkang capsules(B), sample solution lack of Camptotheca acuminata Decne fruit(C), sample solution lack of Fructus Livistonae(D) and sample solution lack of Curcumae Rhizoma(E) |
分别精密吸取“2.2.1”项下各单成分对照品储备溶液2.5 mL,置于同一20 mL量瓶中,摇匀,作为混对照品溶液Ⅰ,再依次精密吸取混对照品溶液Ⅰ各适量,依次用甲醇稀释2、5、10、20、25倍,制成混对照品溶液Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ,依次精密吸取混对照品溶液Ⅵ、Ⅴ、Ⅳ、Ⅲ、Ⅱ和Ⅰ各适量,依法进样,测定羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇的峰面积,以所测各成分质量浓度X为横坐标,羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇的峰面积Y为纵坐标,绘制标准曲线,得回归方程,结果见表 1。
|
|
表 1 回归方程和线性范围 Tab.1 Regression equations and linear ranges |
取“2.2.1”项下的混合对照品溶液,依法连续进样6次,记录羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇的峰面积,结果所测8个成分峰面积的RSD分别为0.75%、0.59%、1.2%、1.2%、1.4%、0.44%、1.2%和1.3%。
2.3.4 重复性试验取同一批次复生康胶囊样品6份,按照“2.2.2”项下方法制备供试品溶液,依法进样测定,记录羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇的峰面积,计算羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇含量及RSD,结果所测8个成分平均含量分别为0.273、0.411、0.167、0.184、0.107、0.084、0.225、0.148 mg·g-1,RSD分别为1.0%、0.92%、1.4%、1.6%、0.63%、0.72%、1.2%和1.5%。
2.3.5 稳定性试验取同一批次复生康胶囊样品的同一份供试品溶液,分别于室温下放置0、2、4、8、16、24 h进样检测,记录羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇的峰面积,结果峰面积的RSD分别为0.89%、0.75%、1.1%、1.2%、0.38%、1.5%、0.22%和1.3%,复生康胶囊供试品溶液室温下24 h内稳定。
2.3.6 加样回收率试验取已知含量的复生康胶囊适量,倾出内容物,研成细粉,取6份,每份约2.5 g,精密称定,置具塞锥形瓶中,依次精密加入0.679 mg·mL-1羟喜树碱对照品溶液、1.041 mg·mL-1喜树碱对照品溶液、0.416 mg·mL-1荭草苷对照品溶液、0.459 mg·mL-1异荭草苷对照品溶液、0.273 mg·mL-1牡荆苷对照品溶液、0.216 mg·mL-1异牡荆苷对照品溶液、0.561 mg·mL-1莪术二酮对照品溶液和0.367 mg·mL-1莪术醇对照品溶液各1.0 mL,再按照“2.2.2”项下复生康胶囊供试品溶液制备方法制备加样供试品溶液,依法进样测定,结果所测成分羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇的平均加样回收率及RSD分别为99.1%(0.91%)、100.1%(0.67%)、97.9%(1.2%)、98.2%(1.4%)、97.5%(0.97%)、97.0%(1.4%)、98.9%(0.89%)和98.1%(1.3%)。
2.4 相对校正因子的建立精密吸取“2.3.2”项下混合对照品溶液Ⅵ、Ⅴ、Ⅳ、Ⅲ、Ⅱ和Ⅰ各适量,依法进样测定羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇的峰面积,以牡荆苷为内标物,按照相对校正因子计算公式ƒk/s=ƒk/ƒs=(WkAs)/(WsAk)(式中Wk为内标物牡荆苷的质量浓度,Ak为内标物牡荆苷峰面积,Ws为羟喜树碱、喜树碱、荭草苷、异荭草苷、异牡荆苷、莪术二酮和莪术醇的质量浓度,As为羟喜树碱、喜树碱、荭草苷、异荭草苷、异牡荆苷、莪术二酮和莪术醇的峰面积),分别计算牡荆苷与羟喜树碱、喜树碱、荭草苷、异荭草苷、异牡荆苷、莪术二酮和莪术醇的相对校正因子,结果见表 2。
|
|
表 2 以牡荆苷为内标物的相对校正因子 Tab.2 RCFs with vitexin as internal standard |
取“2.2.1”项下制备的混合对照品溶液分别进样测定,考察Waters 2695型高效液相色谱仪、岛津LC-2010A型高效液相色谱仪和Hypersil ODS色谱柱、Shim-pack gist C18色谱柱、Waters symmetry C18色谱柱对相对校正因子的影响,结果见表 3。试验结果表明,不同仪器和不同色谱柱对所测成分羟喜树碱、喜树碱、荭草苷、异荭草苷、异牡荆苷、莪术二酮和莪术醇的相对校正因子无显著影响。
|
|
表 3 各因素对相对校正因子的影响 Tab.3 Effects of various factors on relative correction factors |
实现中成药复方制剂中多成分含量测定的一测多评法,前提是对待测定成分色谱峰准确定位,本文以牡荆苷为内标物,采用相对保留值法对所测各成分进行定位,分别考察Waters 2695型高效液相色谱仪、岛津LC-2010A型高效液相色谱仪和Hypersil ODS C18色谱柱、Shim-pack gist C18色谱柱、Waters symmetry色谱柱条件下所测成分羟喜树碱、喜树碱、荭草苷、异荭草苷、异牡荆苷、莪术二酮和莪术醇与内标物牡荆苷的相对保留值。实验结果表明不同仪器、不同色谱柱条件下所测各成分间的相对保留值无明显差异,结果见表 4。
|
|
表 4 各因素对相对保留值的影响 Tab.4 Effects of various factors on relative retention values |
取3个批次(批号160907、161103、170312)的复生康胶囊,按照“2.2.2”项下方法制备供试品溶液,依法进样测定,记录所测各成分羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇的峰面积,用外标法测定所测各成分含量,再与一测多评法计算所得结果进行比较,用相对平均偏差(RAD)评价2种方法含量测定结果的差异,结果见表 5,外标法和一测多评法所测各成分含量结果无明显差异,RAD < 2%,表明本文所建立的方法准确性良好。
|
|
表 5 含量测定结果(mg·g-1) Tab.5 Results of content determination |
在供试品处理方法的摸索中,分别对复生康胶囊供试品溶液的提取溶剂(甲醇[7, 9, 12]、50%甲醇、75%乙醇[6, 8])、提取方式(超声提取[7-8]、加热回流提取[6])和提取时间(30 min、60 min、90 min)进行对比考察,以所测8个组分羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇的提取效率为指标,最终确定复生康胶囊供试品溶液的制备方法为甲醇超声提取60 min。
在流动相选择的摸索过程中,首先分别考察了乙腈-水[6, 10-11]、甲醇-水[7-8, 12]、甲醇-乙腈(2:1)与水流动相体系,以复生康胶囊中所测成分羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇的分离效果为指标,结果甲醇-乙腈(2:1)与水流动相体系综合指标优于乙腈-水、甲醇-水流动相体系,但莪术二酮和莪术醇分离效果欠佳,喜树碱色谱峰存在拖尾现象;在此试验基础上,对比考察了甲醇-乙腈(2:1)与0.1%磷酸溶液、甲醇-乙腈(2:1)与0.1%冰醋酸溶液、甲醇-乙腈(2:1)与0.05%冰醋酸溶液[7]流动相体系,最终确定以甲醇-乙腈(2:1)与0.05%冰醋酸溶液为流动相,按照“2.1”项下色谱条件对复生康胶囊中羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇同时进行测定。
本文采用一测多评法同时测定复生康胶囊中羟喜树碱、喜树碱、荭草苷、异荭草苷、牡荆苷、异牡荆苷、莪术二酮和莪术醇8个组分的含量,方法操作便捷、准确性高、重复性好,为复生康胶囊质量标准和质量控制提供有力的数据支持。
| [1] |
WS-10199(ZD-0199)-2002-2012Z国家食品药品监督管理局药品标准[S].2012 WS-10199(ZD-0199)-2002-2012Z Drug Standards of China Food and Drug Administration[S].2012 |
| [2] |
黄瑞松, 叶云峰, 苏青, 等. 复生康胶囊质量标准的研究[J]. 中草药, 2003, 34(8): 698. HUANG RS, YE YF, SU Q, et al. Studies on quality standard of Fushengkang capsules[J]. Chin Tradit Herb Drugs, 2003, 34(8): 698. DOI:10.3321/j.issn:0253-2670.2003.08.014 |
| [3] |
颜栋林, 李萍, 兰茜. 复生康胶囊微生物限度检查法方法验证[J]. 长春中医药大学学报, 2010, 26(1): 131. YAN DL, LI P, LAN Q. Microbial limit test method verification of Fushengkang capsule[J]. J Changchun Univ Tradit Chin Med, 2010, 26(1): 131. |
| [4] |
逄瑜, 孙磊, 金红宇, 等. 替代对照品法在中药多指标含量测定中的应用与技术要求探讨[J]. 药物分析杂志, 2013, 33(1): 169. PANG Y, SUN L, JIN HY, et al. Discussion on application and technical requirements of substitute reference substance method for simultaneous determination of multi-components in traditional Chinese medicine[J]. Chin J Pharm Anal, 2013, 33(1): 169. |
| [5] |
文乾映, 龙芳, 杨华, 等. 中药质量控制中一测多评法的应用进展[J]. 中国药房, 2014, 25(23): 2185. WEN QY, LONG F, YANG H, et al. Advance in quality control for traditional Chinese medicines by QAMS[J]. China Pharm, 2014, 25(23): 2185. DOI:10.6039/j.issn.1001-0408.2014.23.28 |
| [6] |
黄晓舞, 白林, 张莉. HPLC法测定喜树果中喜树碱和羟基喜树碱的含量[J]. 科学技术与工程, 2005, 5(12): 809. HUANG XW, BAI L, ZHANG L. HPLC determination of camptothecine and 10-hydroxycamptothecine in Common Camptotheca fruit[J]. Sci Technol Engin, 2005, 5(12): 809. DOI:10.3969/j.issn.1671-1815.2005.12.014 |
| [7] |
刘文哲, 秦海燕, 索志荣. 喜树果中喜树碱和10-轻基喜树碱的HPLC分析[J]. 药物分析杂志, 2005, 25(2): 168. LIU WZ, QING HY, SUO ZR. HPLC analysis of camptothecine and10-hydroxycamptothecine in fruit of Camptotheca Acuminata Decne[J]. Chin J Pharm Anal, 2005, 25(2): 168. |
| [8] |
隆林, 罗朝凤, 李天先, 等. 喜树果质量标准修定研究[J]. 现代食品, 2017, 3(15): 87. LONG L, LUO CF, LI TX, et al. Study on quality standard revision of Camptotheca Acuminata Decne[J]. Mod Food, 2017, 3(15): 87. |
| [9] |
陈艳, 姚宏, 李少光, 等. HPLC法测定蒲葵药材中6种组分含量[J]. 药物分析杂志, 2011, 31(4): 645. CHEN Y, YAO H, LI SG, et al. HPLC determination of the six components in Livistona Chinensis[J]. Chin J Pharm Anal, 2011, 31(4): 645. |
| [10] |
毛春芹, 陆兔林, 姜国非, 等. HPLC法测定不同主产地莪术饮片中莪术二酮, 莪术醇, 吉马酮和β-榄香烯[J]. 中草药, 2013, 44(3): 305. MAO CQ, LU TL, JIANG GF, et al. Determination of curdione, curcumol, germacrone, and β-elemene in processed Curcumae Rhizoma from different habitats[J]. Chin Tradit Herb Drugs, 2013, 44(3): 305. |
| [11] |
姜国非, 陆兔林, 毛春芹, 等. 不同产地醋莪术饮片中莪术二酮, 莪术醇, 吉马酮和β-榄香烯含量的比较[J]. 中国中药杂志, 2010, 35(21): 2834. JIANG GF, LU TL, MAO CQ, et al. Comparison of content of curdione, curcumol, germacrone and β-elemene in different varieties of vinegar backed Rhizoma Curcuma[J]. China J Chin Mater Med, 2010, 35(21): 2834. |
| [12] |
何欢, 马双成, 田颂九, 等. HPLC测定莪术油及其注射液中6种成分的含量[J]. 中国中药杂志, 2010, 35(5): 593. HE H, MA SC, TIAN SJ, et al. Simultaneous determination by HPLC of 6 components in zedoary turmeric oil and its related injections with replacement method of chemical reference substance[J]. China J Chin Mater Med, 2010, 35(5): 593. |
 2019, Vol. 39
2019, Vol. 39 