抗生素类药物在治疗人类及动物的感染性疾病中发挥了重要作用,但抗生素滥用会造成严重不良后果。研究发现,人类长期使用含有抗生素残留的食品或药品,抗生素可在体内蓄积,导致人体肠道菌群失调,引起易感个体出现过敏和变态反应,或者使细菌耐药性增加等,危害人体健康[1-2],因此,应严格控制食品、药品中残留的抗生素。《中华人民共和国药典》(简称《中国药典》)2015年版三部凡例中规定:生物制品生产过程中应尽量避免使用抗生素;必须使用时,应选择安全性风险相对较低的抗生素,使用抗生素的种类不得超过1种,且产品的后续工艺应保证可有效去除制品中的抗生素,去除工艺应经验证;生产过程中使用抗生素时,成品检定中应检测抗生素残留量,并规定残留量限值[3]。
卡那霉素属氨基糖苷类抗生素,是生物技术药物筛选和生产中常用的一种抗生素,具有神经毒性和肾脏毒性,损害第8对脑神经,导致前庭和耳蜗损伤,肾毒性主要表现为近端身曲管损伤,出现蛋白尿、血尿、肾功能减退等[4-5]。《中国药典》收录的抗生素残留量检查采用传统的微生物检测法,该法特异性较差,容易受到非抗生素抑菌剂的影响[6]。本文以注射用重组人促血小板生成素模拟肽-Fc融合蛋白(简称TMP-Fc)制品为例,采用直接竞争ELISA,建立了定量限更低、更灵敏便捷的卡那霉素含量测定方法。
依据药品审评中心2005年12月《生物制品质量控制分析方法验证技术审评一般原则》[7],对该方法的专属性、重复性、精密度和准确度进行验证,证明该方法能较好地应用于注射用TMP-Fc产品的卡那霉素残留检测,在药物研制和大规模生产中进行有效的质量控制。
1 材料 1.1 样品注射用TMP-Fc成品(D140115)及空白溶液(即辅液)为北京泰德制药股份有限公司提供。
1.2 仪器与试剂酶标仪(Epoch)购自美国Bio-tek;卡那霉素残留ELISA检测试剂盒购自北京中检维康技术有限公司,其中包括5个浓度的卡那霉素标准品;卡那霉素标准品(批号130556)购自中国食品药品检定研究院;氨苄青霉素(批号15L040005)为VWR公司产品;盐酸四环素(批号1975C044)为Amresco产品。
2 方法与结果 2.1 卡那霉素含量标准曲线建立试剂盒中提供的卡那霉素标准品质量浓度分别为0、0.2、0.5、1.0、3.0 ng·mL-1,每个稀释度做2个平行复孔;按照试剂盒说明书,加入标准品溶液75 μL至相应的稀释微孔板中,然后每孔加入卡那酶标抗原75 μL。将多道移液器调至100 μL,每孔混匀5次后,吸取混合溶液100 μL,加至包被有抗体的酶标微孔板中,37℃避光孵育30 min;倒出孔内液体,将微孔板倒置在吸水纸上拍打以保证完全除去孔中的液体,然后每孔加入稀释好的洗涤液250 μL洗涤4次,洗板时每次间隔20 s,用吸水纸拍干;每孔加入显色底物100 μL,室温避光温育10 min;每孔加入反应终止液50μL,振荡混匀;用酶标仪在450 nm处测定吸光度,参比波长630 nm。将A450-A630的数据输入Ridasoft Win分析软件中进行计算,以卡那霉素标准品浓度为横坐标,百分吸光度值为纵坐标,采用spline拟合方式进行处理:卡那霉素含量在0.2~3.0 ng·mL-1之间用此方法检测线性良好,标准品实测值与理论值RSD小于1.0%,且2个平行复孔间RSD小于10%(相对标准偏差(RSD)=标准偏差(SD)/算术平均值×100%),见图 1和表 1。本方法定量下限依据试剂盒中的规定,最低检测限度为0.2ng·mL-1,低于此浓度的样品卡那霉素含量判定为阴性。
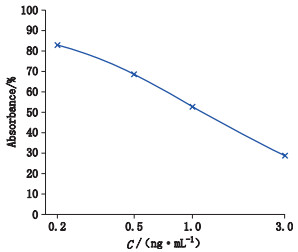
|
图 1 卡那霉素含量标准曲线 Fig.1 Standard curve of kanamycin content |
|
|
表 1 卡那霉素含量标准曲线数据 Tab.1 Standard curve data of kanamycin content |
为了解分析方法的合理性,应首先考虑专属性研究。用该方法对1.0 ng·mL-1的卡那霉素标准品(批号130556)溶液进行3次测定,阳性率为100%;对1.0 ng·mL-1的氨苄青霉素、盐酸四环素溶液进行3次测定,检测结果均为阴性。
TMP-Fc成品中含有一定浓度的辅料,应考察辅料成分对卡那霉素检测是否产生干扰。用超纯水配制不含有TMP-Fc蛋白的空白辅液,将此空白溶液作为样品进行3次测定,检测结果与标准曲线中0 ng·mL-1接近,对样品检测无干扰。
上述结果表明,本方法和试剂盒具有较好的专属性。
2.3 TMP-Fc成品中卡那霉素残留量及重复性验证用试剂盒中提供的稀释缓冲液将TMP-Fc成品复溶并稀释5/10倍,稀释5倍的样品与1.0 ng·mL-1标准品等体积混合作为供试品,各个样品按照试剂盒说明书进行3次平行检测,每次2个复孔,用酶标仪在450 nm/630 nm处测定吸光度,将A450-A630的数据输入Ridasoft Win分析软件中进行计算,与标准曲线比较再乘以其对应稀释倍数,即为样品中卡那霉素含量。
TMP-Fc成品吸光度值超出最低检测限,平行3次测定结果(卡那霉素浓度ng·mL-1(RSD%)为0.14(7.1%)、0.03(5.3%)、0.04(5.6%)。卡那霉素残留量的检测结果均小于0.2 ng·mL-1,即TMP-Fc成品卡那霉素残留量判定为阴性。
由于TMP-Fc成品卡那霉素残留为阴性,采用加标样品评价该方法的重复性。加标样品平行3次测定,结果卡那霉素浓度分别为0.44、0.55、0.46 ng·mL-1,RSD分别为8.4%、2.7%、4.2%。复孔RSD均小于10%,复孔平行性良好。3次平行实验RSD为12.1%,此方法重复性较好。
2.4 TMP-Fc成品中卡那霉素残留量、中间精密度及准确度验证将复溶后稀释5倍的TMP-Fc成品分别等体积加入0.5、1.0、2.0、6.0ng·mL-1卡那霉素标准品溶液,用酶标仪于450 nm/630 nm双波长进行测定,所得数据A450-A630用Ridasoft Win软件进行分析,与标准曲线比较再乘以其对应稀释倍数,即为样品中卡那霉素含量。回收率计算公式:回收率=(加标样品测定值-样品测定值)/加标样品理论值×100%,因TMP-Fc成品测定值低于检测限,计算回收率时忽略不计。
以0.25、0.5、1.0、3.0 ng·mL-1卡那霉素加标样品进行板间精密度分析,检测结果见表 2。板内复孔RSD在1.3%~8.7%之间,均小于10%,复孔平行性良好。3次测定的板间RSD在12.7%~17.6%之间,均低于20%,说明本方法具有较理想的中间精密度。4个不同浓度的加标样品进行3次重复测定,计算得到本实验的回收率在101.3%~106.4%之间,表明该方法具有较好的准确度。
|
|
表 2 TMP-Fc成品中卡那霉素残留量、中间精密度及回收率测定 Tab.2 Determination of Kanamycin Residues, Intermediate Precision and Recovery in TMP-Fc Products |
抗生素残留量的检测常用3种方法:微生物学方法、免疫分析法和理化法。微生物学方法[8-10]因灵敏度不高,容易受到菌种敏感性、培养基配方、pH等因素干扰,而且不能区分具体是哪一种抗生素,使用受到限制;理化法如高效液相色谱蒸发光散射法(HPLC-ELSD)[11]和毛细管区带电泳[12],由于设备昂贵,要求高,程序复杂等,使应用受到限制;免疫分析方法在灵敏度、特异性、快速性、高通量等方面具有较大优势,得到广泛应用。
ELISA是当前应用最广、发展最快的免疫分析方法,自1971年首次建立以来,经过40余年的发展,现已成为药物残留中最重要的分析技术之一[13]。与其他方法相比较,ELISA具有以下优点:较高特异性和灵敏度;检测范围[6, 14]在ng甚至pg水平,属于超微量分析技术;结果准确,重现性好,方法操作简便且可进行大样本量分析。
已有文献[6]报道采用间接竞争ELISA方法检测卡那霉素残留量,其定量下限为0.5 ng·mL-1。本文采用直接竞争ELISA方法检测重组生物制品中的卡那霉素残留量,试剂盒定量下限为0.2 ng·mL-1,该方法较间接ELISA法更为便捷。
依据《生物制品质量控制分析方法验证技术审评一般原则》[7],对直接竞争ELISA方法进行验证:该方法专属性良好,不受其他抗生素干扰;灵敏度高,在0.2~3.0 ng·mL-1范围内spline拟合良好,且平行复孔间RSD小于10%;精密度良好,重复性RSD小于15%,中间精密度RSD低于20%;准确度良好,加标回收率在80%~120%之间。
运用ELISA法对重组技术制品的原液、成品进行卡那霉素残留量检测,可以引入回收率、专属性等对反应体系及干扰因素进行评价;该方法灵敏度高,操作便捷,可以有效节省检测时间,并进行样品批量检测,适用于重组技术制品研发及生产过程中卡那霉素残留量检测。
| [1] |
李周敏, 方惠群, 许丹科. 牛奶中残留抗生素免疫检测方法研究进展[J]. 生物技术通报, 2012(11): 66. LI ZM, FANG HQ, XU DK. Immunoassay methods for antibiotic residues in milk[J]. Biotechnol Bull, 2012(11): 66. |
| [2] |
张远, 王永强, 李万民, 等. 动物性食品中抗生素残留的危害及防控[J]. 广西农业科学, 2006, 37(1): 97. ZHANG Y, WANG YQ, LI WM, et al. Harm and control of antibiotic residues in animal-derived food[J]. J Guangxi Agric, 2006, 37(1): 97. DOI:10.3969/j.issn.2095-1191.2006.01.034 |
| [3] |
中华人民共和国药典2015年版.三部[S]. 2015: 凡例十六 ChP 2015. Vol Ⅲ[S]. 2015: General Notices Sixteen |
| [4] |
俞淑静. 氨基糖苷类抗生素耳毒性的防治[J]. 中国药物滥用防治杂志, 2002(1): 14. YU SJ. Prevention of ototoxicity of aminoglycosides[J]. Chin Mag Drug Abuse Prev Treat, 2002(1): 14. DOI:10.3969/j.issn.1006-902X.2002.01.006 |
| [5] |
李明阳, 李勇, 崔芬芳, 等. 氨基糖苷类抗生素肾毒性及生物标志物的研究进展[J]. 中国抗生素杂志, 2014, 2(39): 85. LI MY, LI Y, CUI FF, et al. Nephrotoxicity of aminoglycosides and biomarkers for early detection[J]. Chin J Antibiot, 2014, 2(39): 85. |
| [6] |
王兰, 毕华, 饶春明. 应用ELISA测定睫状神经营养因子中卡那霉素残留量[J]. 药物分析杂志, 2011, 31(6): 1064. WANG L, BI H, RAO CM. Determination of residual kanamycin in ciliaryneurotrophic factor by ELISA[J]. Chin J Pharm Anal, 2011, 31(6): 1064. |
| [7] |
药品审评中心.生物制品质量控制分析方法验证技术审评一般原则[S]. 2005 Center for Drug Evaluation. General Evaluation Principles of BiologicsQuality Control Methods Validation[S]. 2005 |
| [8] |
王志强, 胡国媛, 李志勇, 等. 微生物抑制法快速检测鲜奶中多种抗生素残留[J]. 中国食品卫生杂志, 2008, 20(2): 139. WANG ZQ, HU GY, LI ZY, et al. Determination of antibiotics residues in raw milk by microbial inhibition method[J]. Chin J Food Hyg, 2008, 20(2): 139. DOI:10.3969/j.issn.1004-8456.2008.02.011 |
| [9] |
MÉNDEZ-VILAS A. Microbial Pathogens and Strategies for Combating Them:Science, Techonology and Education[M]. Badajoz, Spain: Formatex, 2013: 359.
|
| [10] |
TSAI CE, KONDO F. Improved agar diffusion method for detecting residual antimicrobial agents[J]. J Food Prot, 2001, 64(3): 361. DOI:10.4315/0362-028X-64.3.361 |
| [11] |
MEGOULAS NC, KOUPPARIS MA. Direct determination of kanamycin in raw materials, veterinary formulation and culture media using a novel liquid chromatography-evaporative light scattering method[J]. Anal Chim Acta, 2005, 1(547): 64. |
| [12] |
YU CZ, HE YZ, FU GN, et al. Determination of kanamycin A, amikacin and tobramycin residues in milk by capillary zone electrophoresis with post-column derivatization and laser-induced fluorescence detection[J]. J Chromatogr B, 2009, 3(877): 333. |
| [13] |
LEQUIN RM. Enzyme immunoassay(EIA)/enzyme-linked immunosorbent assay(ELISA)[J]. Clin Chem, 2005, 51(12): 2415. DOI:10.1373/clinchem.2005.051532 |
| [14] |
LI C, ZHANG YY, ZHANG XY, et al. Detection of kanamycin and gentamicin residues in animal-derived food using IgY antibody based ic-ELISA and FPIA[J]. Food Chem, 2017, 227: 48. DOI:10.1016/j.foodchem.2017.01.058 |
 2019, Vol. 39
2019, Vol. 39 
