2. 绿叶制药集团有限公司长效和靶向制剂国家重点实验室, 烟台 264003
2. State Key Laboratory of Long-acting and Targeting Drug Delivery System, Lüye Pharma Group Ltd., Yantai 264003, China
药品中的元素杂质来源较多,可能在合成中添加的催化剂残留,也可能由生产设备或容器密闭系统相互作用产生,还可能存在于药品各个组分中。基于元素毒性及在药品中出现的可能性,将元素分为3类[1-2]。第1类:砷(As)、镉(Cd)、汞(Hg)和铅(Pb),对人有毒,药品生产中不得使用或限制使用;第2类:该类元素毒性的大小与药物的给药途径有关,根据出现在药品中概率的大小将该类元素进一步分级为2A和2B类,2A类元素包括钴(Co)、镍(Ni)、钒(V),2B类元素包括银(Ag)、金(Au)、铱(Ir)、锇(Os)、钯(Pd)、铂(Pt)、铑(Rh)、钌(Ru)、硒(Se)、铊(Tl);第3类:该类元素口服毒性低,包括钡(Ba)、铬(Cr)、铜(Cu)、锂(Li)、钼(Mo)、锑(Sb)、锡(Sn)。由于元素杂质不能给患者提供任何治疗效果且有害,所以药品中元素杂质含量应该被控制在可接受的限度。
《元素杂质指南Q3D》(ICHQ3D)是新药制剂元素杂质控制的质量指南,旨在为新药制剂和其赋形剂中元素杂质的定性和定量控制提供全球性方针,为口服、注射和吸入制剂中的24个元素杂质建立了日允许暴露量(PDE)[3-4]。根据国际人用药物注册技术协调会议(ICH)Q3D口服制剂评估要求,生产过程中无有意添加元素杂质的产品需要对分类1和分类2A的7个元素进行评估。
目前,各国药典收载的重金属检查法仍以目视比色法进行半定量测定为主,方法存在专属性差,灵敏度低,操作烦琐等缺点[5],已经不能满足元素杂质控制的要求。USP两项全新通则 < 232 > (限度)、< 233 > (方法)取代了通则 < 231 > (重金属限量检测),已于2018年1月1日正式执行。USP < 233 > 介绍了ICP-OES和ICP-MS 2种现代化元素杂质测定方法,并提出了具体的方法要求[6-8]。
盐酸安舒法辛缓释片是山东绿叶制药有限公司开发的抗抑郁新药[9-12],目前已获准开展Ⅲ期临床研究。为有效控制产品质量,本文按照USP < 233 > 方法要求,建立ICP-MS法测定盐酸安舒法辛缓释片中7个元素杂质的含量。
1 仪器与试药电感耦合等离子体质谱仪:ICAPQ,赛默飞世尔科技公司;微波消解仪:Multiwave GO,安东帕有限公司;十万分之一天平:Mettler Toledo。
硝酸:超级纯,苏州晶瑞化学股份有限公司;Pb标准溶液(1 000 μg·mL-1),Hg标准溶液(1 000 μg·mL-1),As标准溶液(1 000 μg·mL-1)、Cd标准溶液(100 μg·mL-1)、Co标准溶液(1 000 μg·mL-1)、V标准溶液(1 000 μg·mL-1)、Ni标准溶液(1 000 μg·mL-1),Reagecon Diagnostics Ltd.;锗(Ge)标准溶液(1 000 μg·mL-1)、铟(In)标准溶液(1 000 μg·mL-1),国家有色金属及电子材料分析测试中心;铋(Bi)标准溶液(100 μg·mL-1),中国计量科学研究院;Au标准溶液(1 000 μg·mL-1),赛默飞;调谐液1323770B,Inorganic Ventures Inc.。
盐酸安舒法辛缓释片(160 mg·片-1):批号170812、170813、170814,山东绿叶制药有限公司。
2 方法与结果 2.1 元素杂质限度的制定参照ICHQ3D指导原则的要求,口服固体制剂中Pb、Cd、As、Hg、Co、V、Ni 7个元素的PDE如表 1所示,盐酸安舒法辛缓释片每日服用剂量按片重计算不超过10 g。本次研究参考ICHQ3D指南中浓度转换方法1,即日摄入量不超过10 g的药品中元素杂质通用允许浓度限值[13],计算各元素杂质的通用允许浓度——限度值。根据各元素杂质的限度值,稀释合理倍数,得到稀释后溶液中的限度浓度(J)。ICP-MS测定大多数元素的线性动态范围在0.01~100 ng·mL-1 [7],因此,本次研究中调整稀释因子为1:500,使溶液中各目标元素J在ICP-MS合适的线性动态范围内,各目标元素限度值及J如表 1所示。
|
|
表 1 元素PDE值和J值转换表 Tab.1 PDE value of the elements and J value conversion table |
喷雾室温度为2.7 ℃,冷气流速为14.0 L·min-1,蠕动泵速度为40.0 r·min-1,碰撞气流速为4.35 mL·min-1,采样深度为5.0 mm,辅助气流速为0.8 L·min-1,雾化器流速为1.075 L·min-1,火炬垂直位置为-0.37,火炬水平位置为-0.95,测量模式为KED。
2.3 溶液制备 2.3.1 内标溶液分别精密量取Ge、In、Bi标准溶液适量,用5%硝酸溶液定量稀释。即得Ge、In、Bi质量浓度均为10 ng·mL-1的混合内标溶液。
2.3.2 供试品溶液制备取本品20片,用研钵研细,作为供试品,取供试品0.1 g,精密称定,置消解罐中,加硝酸5 mL,110 ℃预消解30 min,然后按表 2条件进行微波消解,消解后110 ℃赶酸30 min,用超纯水将消解罐内溶液转移至50 mL量瓶,稀释至刻度,摇匀,即得。不加样品,同法制备空白溶液。
|
|
表 2 微波消解条件 Tab.2 The conditions of microwave digestion |
分别精密量取Pb、Hg、As、Cd、Co、V、Ni标准溶液适量,用5%硝酸溶液(含200 ng·mL-1 Au)[14]定量稀释成0.1J、0.5J、1.0J、1.5J、2.0J系列浓度的溶液(如表 3所示),作为标准曲线溶液。以5%硝酸溶液(含200 ng·mL-1 Au)为溶剂空白。
|
|
表 3 线性溶液浓度(ng·mL-1) Tab.3 Concentration of linear solution |
测定时选取73Ge、115In、209Bi作为内标,仪器的内标进样管在仪器分析过程中始终插入内标溶液中,依次将仪器的样品管插入各个浓度的标准曲线溶液(包括空白溶液)中进行测定(浓度依次递增),以每一浓度对应的响应值(3次读数的平均值)为纵坐标,相应的浓度为横坐标做标准曲线。将仪器样品管插入供试品溶液中,测定,取3次读数的平均值,从标准曲线上计算相应的浓度,计算各元素杂质的含量。
2.5 方法学验证 2.5.1 系统适用性试验供试品溶液测定前后,分别取标准曲线溶液4(1.5J)进样分析,按USP < 233 > 要求,信号漂移不得过20%。结果如表 4所示,7个元素供试品测定前后信号漂移均小于3%,符合要求。
|
|
表 4 系统适用性试验结果 Tab.4 Results of system suitability test |
分别按各元素限度浓度的0~200%设计线性范围,设计6个浓度点,考察各元素线性关系。取标准曲线溶液依次进样,以各元素杂质的响应值(Y,cps)为纵坐标,浓度(X,ng·mL-1)为横坐标,绘制标准曲线,得各元素杂质的线性方程和相关系数。结果如表 5所示,7个元素P值最大为5.92×10-7,远小于α(α=0.01或0.05),证明回归方程有显著性;相关系数r > 0.999,说明线性关系良好。截距95%置信区间包含零(如图 1,以Hg元素为例),说明线性回归分析中使用过原点的三点校正法,能减少分析的不确定性[15]。残差图以Hg元素为例,如图 2所示。
|
|
表 5 线性试验结果 Tab.5 Results of Linear regression |
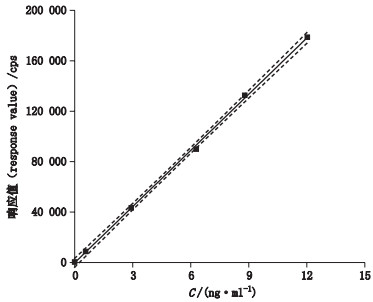
|
图 1 Hg元素线性(直线)及95%置信区间(虚线) Fig.1 Linear regression line of Hg element(straight line)and 95% confidence interval(dotted line) |
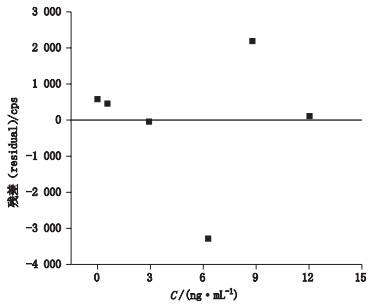
|
图 2 Hg元素线性回归的残差图 Fig.2 Residual plot for the linear regression analysis of Hg element |
取空白溶液连续测定11次,以空白溶液响应值的3倍标准差所对应的浓度值作为检测下限,以空白溶液响应值的10倍标准差所对应的浓度值作为定量下限[16]。具体计算公式为:检测下限LOD=3σ/S,定量下限LOQ = 10σ/S。σ为空白溶液连续测定11次各元素响应值的标准偏差;S为各元素标准曲线斜率。以浓度和含量分别计算检测下限及定量下限。结果如表 6所示,7个元素检测下限、定量下限均低于限度值的10%,能够满足限度测试需求。
|
|
表 6 检测下限及定量下限试验结果 Tab.6 Results of LODs and LOQs |
按照供试品溶液制备方法,加入适量标准物质,使待测元素浓度为限度浓度,即加标供试品溶液。
取空白溶液、供试品溶液、标准曲线溶液3(1.0J)、加标供试品溶液分别进样分析。结果如表 7所示,空白溶液中7个待测元素m/z位置响应值均较低,Pb元素在标准曲线溶液3(1.0J)响应值的7%以内,其余各元素在标准曲线溶液3(1.0J)响应值的2%以内,因此空白溶液对测定影响较小;各待测元素均有各自的m/z,不互相干扰检测;考察基质干扰对测定的影响,以供试品溶液作为基质,在基质中加入对照品,与相应浓度对照品比较,按下式方法计算基质干扰,结果表明基质干扰在-7.54%~0.72%之间,基质抑制或增强均在10%以内,说明基质无较强干扰,因此专属性良好。
|
|
表 7 专属性试验结果(cps) Tab.7 Results of Specificity test(cps) |
| $ {\rm{基质干扰}}\left( \% \right) = \frac{{\left( {A - B} \right) - C}}{C} \times 100\% $ |
式中:A为加标供试品溶液中各待测元素响应值(cps);B为供试品溶液中各待测元素响应值(cps);C为标准曲线溶液3(1.0J)中各待测元素响应值(cps)。
2.5.5 重复性试验精密称取样品6份,按供试品溶液制备方法,分别加入适量标准物质,使待测元素浓度为限度浓度,进样分析,计算每个元素的RSD,考察其重复性。要求每个元素RSD应不大于20%。盐酸安舒法辛中V、Co、Ni、As、Cd、Hg、Pb 7个元素重复性RSD(n=6)分别为0.73%、0.63%、0.57%、1.19%、0.89%、0.78%、1.2%,RSD均在2%以内,符合USP < 233 > 重复性的要求,表明方法的重复性良好[7]。
2.5.6 中间精密度试验由另一位分析人员在不同时间,按照重复性项下方法进行试验,考察随机变动因素对精密度的影响,采用12次测定结果的RSD来验证中间精密度,按USP < 233 > 要求,每个待测元素RSD不超过25%(n=12)。
加标供试品溶液制备:100%限度浓度:精密称取已知含量的供试品6份,分别精密加入适量标准物质,然后按供试品溶液项下方法处理,得到浓度约为1.0J的加标供试品溶液,进样分析。
结果如表 8所示。盐酸安舒法辛缓释片中7个元素由2位分析人员,不同时间测定,各元素总体重复性RSD≤2%(n=12),中间精密度RSD≤3%,满足RSD≤25%的验证要求[7]。
|
|
表 8 中间精密度试验结果(%) Tab.8 Results of intermediate precision test |
精密称取供试品9份,参照供试品溶液制备方法,按限度浓度50%、100%、150%加入标准物质,作为低、中、高3个浓度的加标供试品溶液,每个浓度制备3个平行样品,进行加样回收试验,验证方法准确度,要求每个浓度3个平行样的加样回收率平均值在70%~150%。结果如表 9所示,7个元素3个不同浓度水平下回收率均在92.2%~104.4%之间,符合USP < 233 > 要求。
|
|
表 9 加样回收率试验结果 Tab.9 Results of recovery test |
在上述仪器条件下,采用该方法对3批盐酸安舒法辛缓释片中元素杂质进行含量测定,结果如表 10所示,各批次中元素杂质含量均远小于限度值(均低于限度值的1%),制剂中所测7个元素杂质无风险。
|
|
表 10 样品测定结果(µg·g-1) Tab.10 Determination of sample |
ICP-MS分析过程中,分析信号会随时间而发生漂移,而且分析样品时基质效应可能抑制或增强样品的信号。选择适当的内标元素,不仅能改善方法的精密度,而且还能补偿基质干扰。通常选择供试品中不含,且质量数和第一电离能都和待测元素接近的元素作为内标元素[17]。本试验测定7个元素,依据上述内标选择的原则,选择73Ge、115In、209Bi作为混合内标。内标浓度参考相关文献[18-19]、元素丰度及响应值,仪器合理范围等因素,采用10 ng·mL-1的Ge、10 ng·mL-1的In、10 ng·mL-1的Bi作为混合内标溶液。
3.2 样品消解方法的选择对于不溶或不易溶解的样品,通常采用消解法进行前处理。消解方法分为干灰化法、湿式消解法和微波消解法:干灰化法操作复杂,高温灼烧样品易导致挥发性元素损失,造成结果偏低;湿式法消解在敞口容器中有些元素易挥发,且操作时间较长;比较而言,微波消解法快速、简便、节省试剂,因此本研究首选微波消解作为不溶样品的前处理方法[20]。
3.3 同位素选择ICP-MS测定过程中有质谱干扰,主要包括同量异位素重叠干扰、多原子干扰、难容氧化物干扰及双电荷离子干扰,可以通过同位素的选择和仪器参数的最佳化来减少。许多元素具有多个同位素,应按照丰度大、干扰小、灵敏度高的原则选择同位素[21],按照以上原则,本次实验测定的7个元素选择的同位素如下:51V、59Co、60Ni、75As、111Cd、202Hg、208Pb。
如表 11所示,59Co、75As为单同位素;51V、202Hg、208Pb选择丰度最大同位素,60Ni选择丰度第二高同位素,因丰度最大同位素58Ni存在115In++、116Sn++、58Fe、40Ar+18O等潜在干扰;111Cd选择了丰度第三高同位素,因丰度最大同位素114Cd存在40Ar+74Ge、12C+102Ru、16O+98Mo等潜在干扰,丰度第二高同位素112Cd存在40Ar+72Ge、14N+98Mo、16O+96Mo等潜在干扰。
|
|
表 11 元素分析同位素的选择 Tab.11 Selection of isotope of elements |
按照USP < 233 > 方法学验证要求,分析方法应当能够明确检测每种元素杂质,共存的其他成分(包括其他元素杂质、基质成分)不干扰检测[7]。本方法选择的待测同位素如下:51V、59Co、60Ni、75As、111Cd、202Hg、208Pb。7个待测元素均有各自的m/z,不互相干扰检测;空白溶液中7个待测元素的m/z位置强度值均较低,小于标准曲线溶液3(1.0J)响应值的10%,空白溶液干扰小;设计了样品消解后加标与标准曲线溶液3(1.0J)对比的方法证明基质干扰,基质干扰在10%以内,证明无较强干扰,满足专属性要求。
3.5 线性与范围、定量限分别按各元素限度浓度的0~200%设计线性范围,方法能检测样品中元素杂质含量在0~2倍PDE值对应浓度水平,能够满足元素杂质评估需要。本方法各元素定量限均低于限度浓度的10%,能够满足元素杂质限度测定需求。
3.6 小结本试验按照USP < 233 > 方法要求,建立了ICP-MS法测定盐酸安舒法辛缓释片中7个元素杂质的含量并进行方法学验证;参考 < Method Validation in Pharmaceutical Analysis > [15]线性要求,验证回归方程有显著性,线性关系良好;准确度、中间精密度满足USP < 233 > 方法要求。采用本方法测定盐酸安舒法辛缓释片中7个元素杂质含量,灵敏度高,干扰小,具有良好的准确度与精密度。用该方法测定了3批盐酸安舒法辛缓释片中7个元素杂质含量,测定结果显示各目标元素杂质含量均远小于限度值,满足ICHQ3D中口服制剂元素杂质限度要求,因此盐酸安舒法辛缓释片中元素杂质无风险,不需要进一步控制,在质量标准中,无需设置相关检查项。
本试验建立的测定方法及评估标准符合目前国际上最新的指导原则及法规要求,为元素杂质分析方法的建立与评估提供了参考。
| [1] |
IPCS. Environmental Health Criteria 240 Principles and Methods for the Risk Assessment of Chemicals in Food, Chapter 5: Dose Response Assessment and Derivation of Health Based Guidance Values[S]. 2009: 537
|
| [2] |
HAXEL GB, HEDRICK JB, ORRIS GJ. Rare Earth ElementsCritical Resources for High Technology[EB/OL]. US Geological Survey(2005-05-17)[2018-05-30]. http://geopubs.wr.usgs.gov/fact-sheet/fs087-02/
|
| [3] |
ICH: ICH Q3D Step 4 Version Guideline for Elemental Impurities[EB/OL].(2014-12-16)[2017-04-29]. https://www.ich.Org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q3D/Q3D_Step_4.pdf
|
| [4] |
姜小林, 董素萍, 舒靖能. ICHQ3D新药制剂元素杂质评估及控制的要点解读[J]. 中国药事, 2017, 31(8): 854. JIANG XL, DONG SP, SHU JN, et al. Key points for the evaluation and control of element impurities in ICH Q3D new drug formulations[J]. China Pharm Aff, 2017, 31(8): 854. |
| [5] |
靳贵英. 药用辅料β-环糊精中7种重金属元素的分析[J]. 今日药学, 2017, 27(4): 228. JIN GY. Analysis of heavy metal element in pharmaceutical excipient β-cyclodextrin[J]. Pharm Today, 2017, 27(4): 228. |
| [6] |
USP 40-NF 35[S]. 2017: 6151(<232>, Elemental Impurities-Limits)
|
| [7] |
USP 40-NF 35[S]. 2017: 6147(<233>Elemental Impurities-Procedures)
|
| [8] |
张亚红, 李华龙. 电感耦合等离子体质谱法测定阿加曲班原料药中催化剂钯的残留量[J]. 药物分析杂志, 2016, 36(9): 1667. ZHANG YH, LI HL. Determination of catalyst palladium residue in argatroban crude product by ICP-MS[J]. Chin J Pharm Anal, 2016, 36(9): 1667. |
| [9] |
MUTH EA, MOYER JA, HASKIN JT, et al. Biochemical, neurophysiological, and behavioral effects of Wy-45, 233 and other identified metabolites of the antidepressant venlafaxine[J]. Drug Dev Res, 2010, 23(2): 191. |
| [10] |
DEECHER DC, BEYER CE, JOHNSTON G, et al. Desvenlafaxine succinate:a new serotonin and norepinephrine reuptake inhibitor[J]. J Pharmacol Exp Ther, 2006, 318(2): 657. DOI:10.1124/jpet.106.103382 |
| [11] |
PARKS V, PATAT A, BEHRLE J, et al. Safety, pharmacokinetics (PK) and pharmacodynamics(PD) of ascending single doses of desvenlafaxine(DVS-233 SR) in healthy subjects[J]. Clin Pharmacol Ther, 2005, 77(2): 28. |
| [12] |
李洁, 马崔. 文拉法辛的药理特点及临床应用[J]. 精神医学杂志, 2005, 18(4): 276. LI J, MA C. Pharmacological features and clinical application of venlafaxine[J]. J Psychiatr Neurosci, 2005, 18(4): 276. DOI:10.3969/j.issn.1009-7201.2005.04.035 |
| [13] |
TEASDALE A, CHERY CC, COOK G, et al. Implementation of ICH Q3D elemental impurities guideline:challenges and opportunities[J]. Pharm Technol, 2015, 27(3): 12. |
| [14] |
GB5009.268-2016食品安全国家标准食品中多元素的测定[S]. 2016 GB5009.268-2016 Determination of Multi-elements in Food Safety National Standard Food[S]. 2016 |
| [15] |
ERMER J, NETHERCOTE P, BURGESS C, et al. Method validation in pharmaceutical analysis[M]. 2nd ed. British: Wiley-VCH, 2015: 203.
|
| [16] |
高若梅, 刘鸿皋. 检出限概念问题讨论-IUPAC及其它检出限定义的综合探讨和实验论证[J]. 分析化学, 1993, 21(10): 1232. GAO RM, LIU HG. Discussion of concept of detection limit-the definition, the estimation and the use of IUPAC and etc. Approaches[J]. Chin J Anal Chem, 1993, 21(10): 1232. |
| [17] |
金鹏飞, 马捷, 邹定, 等. ICP-MS同时测定多维元素片(29)中8种微量元素的含量[J]. 药物分析杂志, 2009, 29(6): 994. JIN PF, MA J, ZOU D, et al. Simultaneous determination of eight trace elements in multidimensional element tablets (29) by ICP-MS[J]. Chin J Pharm Anal, 2009, 29(6): 994. |
| [18] |
张振兴, 王强, 杨凤, 等. 微波消解-ICP-MS法测定利奈唑胺中残留钯[J]. 化学研究与应用, 2013, 25(1): 134. ZHANG ZX, WANG Q, YANG F, et al. Determination of residual Pd in linezolid by microwave digestion-ICP-MS[J]. Chem Res Appl, 2013, 25(1): 134. DOI:10.3969/j.issn.1004-1656.2013.01.028 |
| [19] |
李颖, 刘雁鸣, 粟贵, 等. 采用ICP-MS法测定苯甲酸钠中Mn、Co、As、Pb元素的含量[J]. 中南药学, 2015, 13(7): 752. LI Y, LIU YM, SHU G, et al. Determination of Mn, Co, As, and Pb contents in sodium benzoate using ICP-MS[J]. Cent South Pharm, 2015, 13(7): 752. |
| [20] |
CLAUDIA A, PONCE A. Trace element determination in vitamin E using ICP-MS[J]. Anal Bioanal Chem, 2002, 374(2): 230. DOI:10.1007/s00216-002-1480-y |
| [21] |
符传武, 韦瑶瑶, 洪薇, 等. ICP-MS测定明胶空心胶囊中的二氧化钛[J]. 药物分析杂志, 2015, 35(12): 2209. FU CW, WEI YY, HONG W, et al. Determination of titanium dioxide in gelatin hollow capsules by ICP-MS[J]. Chin J Pharm Anal, 2015, 35(12): 2209. |
 2019, Vol. 39
2019, Vol. 39 
