2. 江苏省食品药品监督检验研究院, 南京 210008;
3. 徐州医科大学药物分析教研室, 徐州 221004
2. Jiangsu Institute for Food and Drug Control, Nanjing 210008, China;
3. Department of Pharmaceutical Analysis, Xuzhou Medicine University, Xuzhou 221004, China
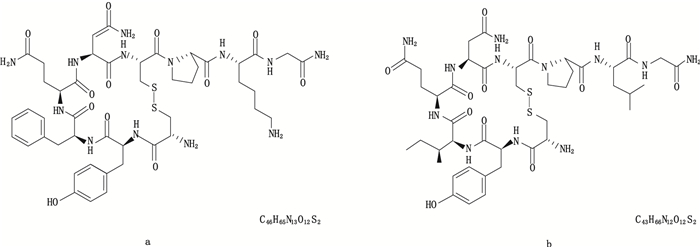
垂体后叶注射液是国家基本药物,其主要成分为升压素和缩宫素,是猪(羊或牛)脑垂体后叶经脱水、干燥、研细制成的垂体后叶粉再经稀醋酸提取、滤过制得的无菌溶液,为激素类药物。升压素和缩宫素均为九肽化合物,具有升压和缩宫作用,猪源升压素为8-位赖氨酸,有别于其他哺乳动物来源(如人、牛等)的升压素,后者为8-位精氨酸;不同来源的缩宫素结构均相同[1-2],两化合物的分子式和结构式见图 1。垂体后叶临床主要用于肺、支气管出血(如咯血)消化道出血(呕血、便血)[3],并适用于产科催产及产后收缩子宫、止血、腹腔手术后肠道麻痹、尿崩症等[4]。
|
图 1 赖氨酸升压素(a)和缩宫素(b)结构式和分子式 Figure 1 The chemical structures and molecular formula of lysine vasopressin(a)and oxytocin(b) |
垂体后叶及其注射液质量标准仅收载于《中华人民共和国药典》(简称《中国药典》)2015版二部[5],其主成分升压素及缩宫素的含量均采用生物效价测定法测定[6]。由于生物效价测定法存在检验周期长,操作复杂费力, 测定误差较大,重复性欠佳等问题,特别是对于限度边缘产品结果的判定,检验人员需要有足够的经验和能力,不利于药品质量的控制[7-8]。因此,参考相关文献[9-12],本文建立了同时测定垂体后叶注射液中赖氨酸升压素与缩宫素含量的高效液相色谱法(HPLC法),并进行方法学验证;将HPLC法与生物效价测定法测定结果进行比较,考察2种方法的相关性和等效性,为HPLC法替代生物效价测定法提供依据。
1 仪器与试药岛津LC20高效液相色谱仪(PDA检测器);Waters Xbridge C18(250 mm×4.6 mm,5 μm)色谱柱;Milli-Q Gradient超纯水系统;奥尔科特离体器官测定系统;生物统计软件BS 2000(中国食品药品检定研究院);SPSS 17.0统计软件(IBM公司);SAS 9.2统计软件(SAS软件研究所)。
缩宫素国家标准品(中国食品药品检定研究院,21 IU·支-1,批号150529-200902);赖氨酸升压素国家标准品(中国食品药品检定研究院,4 IU·支-1,批号101525-201301);缩宫素欧洲药典标准品(0.96 mg·瓶-1,600 IU·mg-1,批号4.0);垂体后叶注射液(A厂家,规格为1 mL:6 IU,批号160501、160502、160503、160504、160505、160506);缩宫素高纯度合成原料(B厂家,批号160507、1609001、609002、1610003、1610004);乙腈为色谱纯,三氯叔丁醇为化学纯,其余试剂均为分析纯。
2 试验方法 2.1 HPLC法采用C18(250 mm×4.6 mm,5 μm)色谱柱,以磷酸盐缓冲液(22.56 g磷酸二氢钠与0.85 g磷酸氢二钠溶于1 000 mL水中,用氢氧化钠调节pH至6.0)为流动相A,以水-乙腈(1:1)为流动相B,进行线性梯度洗脱[流动相A-流动相B比例:0 min(75:25)→20 min(75:25)→50 min(40:60)→50.1 min(75:25)→60 min(75:25)],流速1.0 mL·min-1,检测波长220 nm,柱温40 ℃。取赖氨酸升压素标准品、缩宫素标准品各适量,加0.25%醋酸溶液制成1 mL中含赖氨酸升压素和缩宫素均为6 IU的混合标准品溶液,作为系统适用性试验溶液。赖氨酸升压素峰与缩宫素峰的分离度应大于5.0。
取垂体后叶注射液作为供试品溶液;另取赖氨酸升压素标准品和缩宫素标准品适量,用0.25%醋酸溶液溶解并稀释至浓度均为6 IU·mL-1的混合溶液,作为标准品溶液;分别精密量取供试品溶液和标准品溶液各20 μL,注入液相色谱仪,记录色谱图。按外标法以峰面积分别计算样品中赖氨酸升压素和缩宫素的含量。
精密称取高纯度合成缩宫素原料适量,用0.25%醋酸溶液溶解并稀释至浓度均为5 IU·mL-1的溶液,另取缩宫素欧洲药典标准品适量,用0.25%醋酸溶液溶解并稀释至浓度均为5 IU·mL-1的溶液,作为标准品溶液;分别精密量取供试品溶液和标准品溶液各20 μL,注入液相色谱仪,记录色谱图。按外标法以峰面积计算样品中缩宫素的含量。
2.2 生物效价测定法照《中国药典》2015年版四部升压素生物测定法(通则1205)和缩宫素生物测定法(通则1210)测定效价[6]。测定结果照《中国药典》2015年版四部生物检定统计法中量反应平行线测定法(通则1431)做实验可靠性测验,试验结果可靠者计算效价,统计计算采用生物统计程序软件BS 2000。
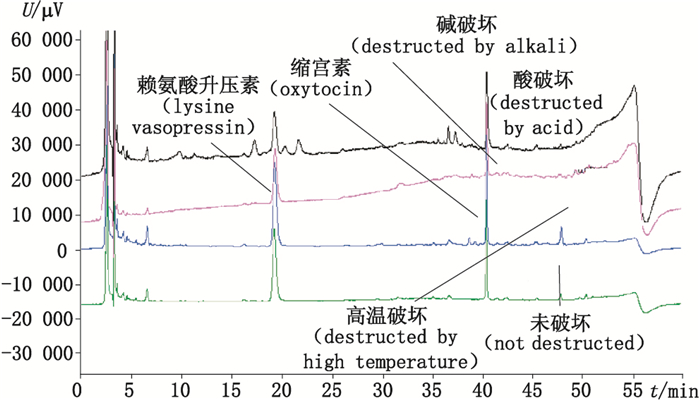
3 方法学考察 3.1 专属性试验由于缺乏赖氨酸升压素和缩宫素2种物质的杂质对照品,通过使用多种破坏性实验而产生特异性杂质进行专属性试验。酸破坏:取垂体后叶注射液1 mL,加强酸(0.5 mol·L-1盐酸)1 mL,30 min后加0.5 mol·L-1氢氧化钠溶液1 mL中和,精密量取20 μL,按“2.1”项条件进行分析。碱破坏:取垂体后叶注射液1 mL,加氢氧化钠(0.5 mol·L-1)1 mL,30 min后加0.5 mol·L-1盐酸1 mL中和,精密量取20 μL,按“2.1”项条件进行分析。高温破坏:取垂体后叶注射液1 mL,高温(沸水浴,2 h)破坏后,精密量取20 μL,按“2.1”项条件进行分析。
结果表明:经破坏试验后产生各个降解产物均与主成分有较好的分离度(图 2),不干扰主成分的测定,该方法专属性良好。
|
图 2 方法专属性考察图谱 Figure 2 Chromatograms for specificity test |
取赖氨酸升压素与缩宫素的标准品适量,用0.25%醋酸溶液溶解并稀释制成每1 mL含赖氨酸升压素为13.33、6.67、3.33、1.67、0.833、0.42、0.21 IU和含缩宫素21.00、10.50、5.25、2.625、1.31、0.66、0.33 IU的系列混合标准品溶液,分别精密量取20 μL,注入液相色谱仪,记录色谱图。以峰面积(Y)对浓度(X)进行线性回归,赖氨酸升压素及缩宫素回归方程分别为:
| $\begin{array}{l} Y = 48{\rm{\;365}}\mathit{X - }{\rm{1\;603}}{\rm{.8\;\;\;\;}}\mathit{r = }{\rm{0}}{\rm{.999\;9}}\\ \mathit{Y = }{\rm{27\;301}}\mathit{X}+{\rm{257}}{\rm{.83\;\;\;\;}}\mathit{r = }{\rm{0}}{\rm{.999\;9}} \end{array} $ |
结果表明:赖氨酸升压素浓度在0.42~13.33 IU·mL-1范围内,缩宫素浓度在0.33~21.00 IU·mL-1范围内,与色谱峰面积呈良好线性关系。
3.3 检测下限、定量下限测定取“3.2”项下每1 mL含赖氨酸升压素0.42 IU和缩宫素0.66 IU的混合标准品溶液适量,用0.25%醋酸溶液稀释,按“2.1”项条件进行分析。结果赖氨酸升压素定量下限(S/N=10)为0.378 IU·mL-1,检测下限(S/N=3)为0.09 IU·mL-1;缩宫素定量下限(S/N=10)为0.144 IU·mL-1,检测下限(S/N=3)为0.04 IU·mL-1。
3.4 重复性试验取垂体后叶注射液同批样品(批号150503)6份,分别精密量取20 μL,注入液相色谱仪,记录色谱图,分别计算6次赖氨酸升压素和缩宫素峰面积测定结果的RSD分别为0.18%和0.35%,表明重复性较好。
3.5 稳定性试验S取垂体后叶注射液同批样品(批号150503),置于4 ℃进样盘中,于0、1、3、5、26、30 h分别进样,以峰面积考察溶液稳定性。结果表明:2种主成分峰面积均无显著下降,溶液在30 h内稳定。
3.6 回收率试验取已知含量的垂体后叶注射液样品(批号150503)1 mL,共9份,分别精密加入赖氨升压素和缩宫素的标准品适量,制成每1 mL含有赖氨酸升压素和缩宫素均为7.2、6.0、4.8 IU·mL-1的高、中、低3个浓度的供试溶液各3份,进样测定,结果赖氨酸升压素高、中、低3个浓度水平的回收率(n=3)分别为101.4%(RSD=0.29%)、100.8%(RSD=0.52%)、99.4%(RSD=0.31%),平均回收率(n=9)为100.5%;缩宫素高、中、低3个浓度水平的回收率(n=3)分别为98.6%(RSD=0.75%)、98.9%(RSD=0.61%)、98.7%(RSD=1.1%),平均回收率(n=9)为98.7%。
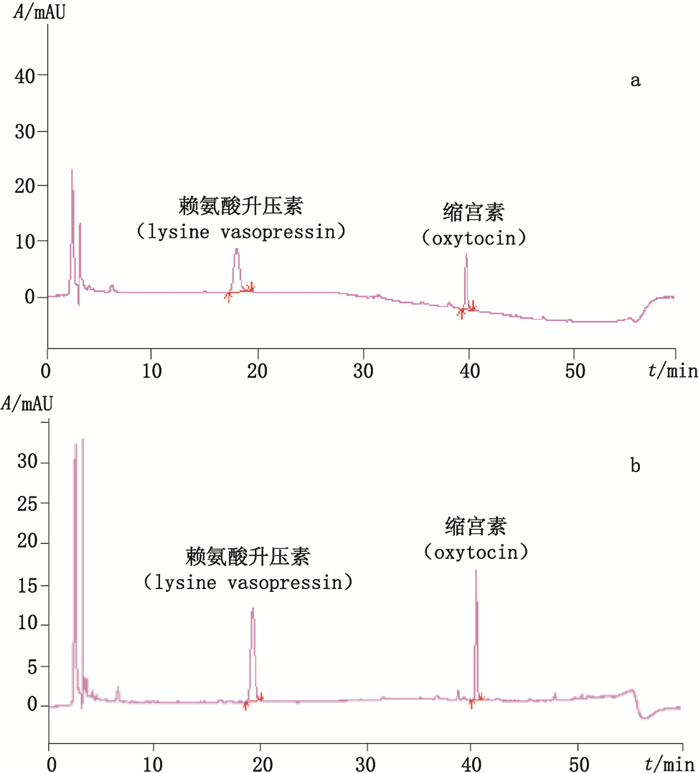
4 结果 4.1 HPLC法系统适用性试验及样品测定在上述色谱条件下,垂体后叶中赖氨酸升压素和缩宫素2个主成分峰分离度不小于5.0,可用于它们的测定,见图 3。
|
a.混合标准品(mixed standard substances)b.垂体后叶注射液样品(sample of posterior pituitary injection) 图 3 垂体后叶注射液含量测定典型色谱图s Figure 3 Typical chromatograms for the posterior pituitary injection |
按“2.1”项下方法,测定6批垂体后叶注射剂样品含量(每个批号取2份样品,每份样品进样2次),结果见表 1,表明6批垂体后叶注射液中赖氨酸升压素含量范围为6.10~6.40 IU·mL-1,缩宫素含量范围为5.63~5.93 IU·mL-1。
|
|
表 1 HPLC法垂体后叶注射液含量测定结果(n=4) Table 1 The results of lysine vasopressin and oxytocin determination of posterior pituitary injection |
分别按照“2.1”、“2.2”项下方法,对6批垂体后叶注射液分别采用HPLC法与生物效价测定法测定含量或效价,见表 2。
|
|
表 2 HPLC法与生物测定法结果汇总 Table 2 The results of HPLC and biological titer measurement of posterior pituitary injection |
以生物效价测定法结果为因变量(X),HPLC法测定结果为自变量(Y),采用SPSS 17.0统计软件分析相关性,结果显示其2种测定法下主要成分均具有相关性,赖氨酸升压素和缩宫素Pearson系数分别为0.897和0.947,见表 3。
|
|
表 3 HPLC法和生物检定法测定样品含量结果的相关性考察 Table 3 Correlation study of posterior pituitary injection content measured by HPLC and biological titer measurement |
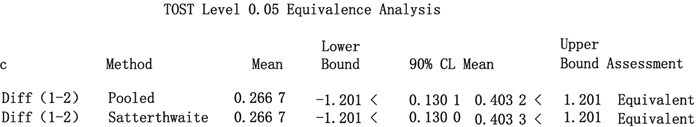
以生物效价测定法测定结果为参比组,分别以赖氨酸升压素和缩宫素参比组均数可信限率20%和10%为等效界值,采用SAS 9.2统计软件分析等效性,结果显示赖氨酸升压素2种测定法的结果具有等效性,缩宫素2种测定法结果不具有等效性,结果见图 4、5。
|
图 4 赖氨酸升压素SAS 9.2等效性分析 Figure 4 SAS 9.2 equivalency analysis of lysine vasopressin |
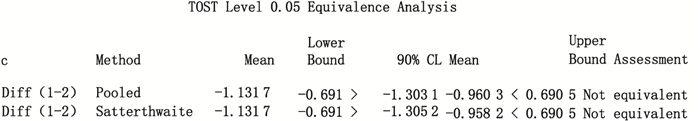
|
图 5 缩宫素SAS 9.2等效性分析 Figure 5 SAS 9.2 equivalency analysis of oxytocin |
为分析造成垂体后叶注射液中缩宫素2种测定方法不等效的原因,按“2.1”项下HPLC法,用欧洲药典缩宫素标准品标定中国食品药品检定研究院合成缩宫素国家标准品,测定结果为标示量的98.6%,2种标准品的效价基本一致;采用“2.1”项下HPLC法和“2.2”项下生物效价测定法,以欧洲药典标准品对高纯度合成缩宫素原料进行HPLC法与生物效价测定法含量或效价测定,结果见表 4,以生物测定法测定结果为参比组,以缩宫素参比组均数可信限率10%为等效界值,采用SAS 9.2统计软件进行等效性分析,结果显示缩宫素2种测定法的测定结果具有等效性,因此,对于高纯度缩宫素,生物效价测定法和HPLC法可以相互替代。结果如图 6。
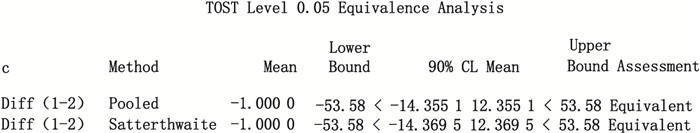
|
图 6 缩宫素原料SAS 9.2等效性分析 Figure 6 SAS 9.2 equivalency analysis of oxytocin API |
|
|
表 4 缩宫素原料药HPLC法和生物效价测定法测定结果 Table 4 HPLC and biological titer measurement results of oxytocin API |
针对现行质量标准《中国药典》2015年版中采用生物效价测定法测定垂体后叶注射液中赖氨酸升压素和缩宫素两主成分的效价,本文参照国外药典及文献中单组分的测定方法,建立了灵敏度高,专属性强,同时测定赖氨酸升压素和缩宫素含量的HPLC法,并进行方法学验证。曾采用USP 35-NF 30[13]收载的(精氨酸)升压素含量测定项下的色谱条件以及EP 8.0[14]收载的赖氨酸升压素含量测定项下的色谱条件,主峰均在10 min内出峰,与杂质无法基线分离,专属性差,基线噪音较大,这可能是因为USP 35-NF 30[13]、EP 8.0[14]只测定升压素1种成分,且纯度较高。新建的HPLC法优化了色谱条件,调节流动相的缓冲盐种类,将pH调至6.0并且流动相采用洗脱梯度,降低基线噪音,使主成分与各个杂质有较好的分离度,增强方法的专属性和准确度,从而达到可同时测定垂体后叶注射液中赖氨酸升压素和缩宫素的含量。
以新建的HPLC法测得垂体后叶注射液中赖氨酸升压素含量与生物效价测定法所得结果基本一致,经SPSS软件分析具有良好的相关性,经SAS软件分析,两法测定结果具有等效性。HPLC法可以替代生物效价测定法用于垂体后叶注射液中赖氨酸升压素的含量测定。
以新建的HPLC法测得垂体后叶注射液中缩宫素含量与生物效价测定法所得结果,经SPSS软件分析具有良好的相关性,但经SAS软件分析,两法测定结果不具有等效性。为进一步分析两法测定垂体后叶注射液中缩宫素含量不等效的原因,又以新建HPLC法对高纯度合成缩宫素原料进行测定,结果表明两法测定结果基本一致,经SAS软件分析,两法测定结果具有等效性。因此,当测定样品中组分纯度较高时,HPLC法与生物效价测定法结果更为一致,HPLC法可以替代生物效价测定法。垂体后叶注射液中缩宫素结果不等效的原因可能是垂体后叶为生物提取得到,成分复杂,注射液中可能存在除缩宫素以外的1种或几种具有引起子宫收缩活性的杂蛋白[2];也可能在制剂生产和贮存中因主成分水解、氧化、外消旋化、二硫键的断裂及重排、β消除、凝聚、沉淀和吸附等产生有关物质[15],由于生物效价测定法专属性差,无法控制有机杂质及活性组分,HPLC法专属性强,可以对活性成分和杂质实现有效分离,故而生物效价测定法结果高于HPLC法。后期本课题组将对垂体后叶及注射液的杂质谱进行研究,确证活性成分和毒性杂质的种类,分析产生杂质的原因,为企业进一步提高产品质量提供依据。
综上所述,新建HPLC法专属性强,灵敏度高,重复性好,能同时测定垂体后叶注射液中赖氨酸升压素和缩宫素2种主成分的含量,与生物效价测定法相关性较好,经SAS软件进行统计分析,新建HPLC法在赖氨酸升压素含量测定时可以替代生物效价测定法,而缩宫素的含量测定目前尚不能替代,仍采用生物效价测定法。
| [1] |
陈宇星, 冯淑玲, 孙红. 垂体后叶素的不良反应与安全应用[J]. 福建医药杂志, 2008, 30(2): 121. CHEN YX, FENG SL, SUN H. Adverse drug reaction and safety application of posterior pituitary[J]. Fujian Med J, 2008, 30(2): 121. DOI:10.3969/j.issn.1002-2600.2008.02.075 |
| [2] |
汪泓, 郑璐侠, 史芳亮, 等. 垂体后叶注射液中主成分和杂蛋白谱的生物质谱研究[J]. 药物分析杂志, 2014, 34(3): 505. WANG H, ZHENG LX, SHI FL, et al. Profiling of key components and impurity proteins of posterior pituitary injection by mass spectrometry[J]. Chin J Pharm Anal, 2014, 34(3): 505. |
| [3] |
翟洁卿, 殷思纯, 何松美. 垂体后叶素治疗肺结核咯血105例临床观察[J]. 当代医学, 2012, 18(17): 280. ZHAI JQ, YIN SC, HE SM. Clinical observation of pituitrin in the treatment of 105 cases of hemoptysis due to pulmonary tuberculosis[J]. Contemp Med, 2012, 18(17): 280. |
| [4] |
张爱倩, 薛敏, 徐大宝. 垂体后叶素及血管加压素在妇科手术中的应用[J]. 实用妇产杂志, 2014, 30(2): 97. ZHANG AQ, XUE M, XU DB. The use of pituitrin and vasopressin in gynecologic surgery[J]. Pract Obstet Gynecol, 2014, 30(2): 97. |
| [5] |
中华人民共和国药典2015年版.二部[S].2015: 657 ChP 2015.Vol Ⅱ[S].2015: 657 |
| [6] |
中华人民共和国药典2015年版.四部[S].2015: 157, 168 ChP 2015.Vol Ⅳ[S].2015: 157, 168 |
| [7] |
李海芳, 钱德明. 缩宫素生物效价测定实验的几点体会[J]. 中国药品标准, 2008, 19(4): 247. LI HF, QIAN DM. Some experiences on biological value test of oxytocin[J]. Drug Stand China, 2008, 19(4): 247. DOI:10.3969/j.issn.1009-3656.2008.04.003 |
| [8] |
许雷鸣, 顾倩, 堵伟锋, 等. 大鼠离体子宫法与高效液相色谱法测定缩宫素效价的相关性分析[J]. 安徽医药, 2014, 18(1): 37. XU LM, GU Q, DU WF, et al. Correlation between isolated rats uterus method and HPLC method for oxytocin assay[J]. Anhui Med Pharm J, 2014, 18(1): 37. DOI:10.3969/j.issn.1009-6469.2014.01.011 |
| [9] |
窦晓睿, 艾小霞, 高荧, 等. 多肽类药物含量(效价)测定方法及其应用[J]. 药学进展, 2011, 35(12): 536. DOU XR, AI XX, GAO Y, et al. The determination method of content/potency for polypeptide drugs and their application[J]. Prog Pharm Sci, 2011, 35(12): 536. |
| [10] |
陈建国, 陆益红, 史清水, 等. 缩宫素的制备及其质量分析研究进展[J]. 中国生化药物杂志, 2012, 33(5): 698. CHEN JG, LU YH, SHI QS, et al. Research advances in the preparation and quality control of oxytocin[J]. Chin J Biochem Pharm, 2012, 33(5): 698. |
| [11] |
黄青, 陆益红, 史清水, 等. 高效液相色谱法测定缩宫素注射液含量及其与生物效价测定方法比较和应用[J]. 药物分析杂志, 2015, 35(6): 1115. HUANG Q, LU YH, SHI QS, et al. HPLC determination of oxytocin injection and comparison with biological titer measurement and its applications[J]. Chin J Pharm Anal, 2015, 35(6): 1115. |
| [12] |
CHAIBVA FA, WALKER RB. Development and validation of a stability indicating analytical method for the quantitation of oxytocin in pharmaceutical dosage forms[J]. J Pharm Biomed Anal, 2007, 43(1): 179. DOI:10.1016/j.jpba.2006.07.002 |
| [13] |
USP 35-NF 30. Vol Ⅲ[S].2012: 5006
|
| [14] |
EP 8.0.Vol Ⅰ[S].2013: 2948
|
| [15] |
白海娇, 王亚敏, 丁一. 多肽类药物有关物质研究的探讨[J]. 天津药学, 2013, 25(1): 9. BAI HJ, WANG YM, DING Y. Research on the related substances of polypeptide drugs[J]. Tanjing Pharm, 2013, 25(1): 9. DOI:10.3969/j.issn.1006-5687.2013.01.004 |
 2018, Vol. 38
2018, Vol. 38 
