2. 湖南中医药大学药学院, 长沙 410208;
3. 湘产大宗药材品质评价湖南省重点实验室, 长沙 410208
2. School of Pharmacy Hunan University of Chinese Medicine, Changsha 410208, China;
3. Key Laboratory for Quality Evaluation of Bulk Herbs of Hunan Province, Changsha 410208, China
乌药为樟科Lauraceae山胡椒属植物乌药(Lindera aggregate(Sims.)Kosterm的干燥块根,其性辛、温,归肺、脾、肾、膀胱经,为传统理气药,具有行气止痛及温肾散寒等功效,主治寒凝气滞,胸腹胀痛,气逆喘急,膀胱虚冷,遗尿,尿频,疝气疼痛,经寒腹痛等[1-2]。根据现代药理学研究表明,乌药其主要化学活性成分为呋喃倍半萜及其内酯、异喹啉生物碱等,具抗炎、镇痛、抗病毒、抗肿瘤、抗氧化等广泛药理活性,对心血管系统、消化系统、肝脏以及中枢神经系统等方面具有显著调节作用和保护作用[3-8]。
近年来,关于生乌药HPLC化学成分和指纹图谱研究多有报道[9-12],其中,方玲等[10]利用HPLC对不同产地生乌药进行指纹图谱的研究,结果发现天台乌药和其他产地乌药的指纹图谱存在显著的差异,该方法可作为台乌药真伪鉴别的有效方法。此外,《中华人民共和国药典》(2015年版)规定了生乌药的质量控制指标主要为乌药醚内酯、去甲异波尔定。但关于乌药制品的质量控制的研究却鲜少报道。据文献报道,乌药经炮制后,其主要活性成分的含量或药效作用与生乌药相比较均存在较大差异[13-15]。因此,乌药的质量控制需要同时考虑生乌药和醋炙乌药的质量,以期全面控制其质量。
目前,指纹图谱结合模式识别方法已广泛应用于药物的质量控制、差异标记物的筛选等方面[16-17]。其中主成分分析(PCA)是一种多指标综合性评价方法,意图通过线性转化将多因子变换为少数的因子,即主成分。其最主要的特点是各主成分之间相关变量相互正交,与线性无关。通过选择合适的主成分进行分析,既不会过多地丢失有用信息,而且还能减少数据中的冗余信息[18]。正交偏最小二乘法-判别分析(OPLS-DA)是将正交信号校正方法(orthogonal signal correction,OSC)与偏最小二乘法(partial least squares,PLS)结合并对PLS进行修正,可以过滤掉与反应没有直接关系的变化,生成的结果更清晰,更易于解释,能够对数据进行可视化和判别,适用于既有对分类起作用的差异变量,同时又包含大量相关的无差异变量,且主成分3个以上的数据[19-20]。因此,本课题实验采用HPLC法对生/醋炙乌药的指纹图谱进行研究,并通过相似度分析及PCA、OPLS-DA等模式识别方法比较不同产地生/醋炙乌药的化学成分和含量的差异性,为科学、全面地制定乌药的质量控制标准提供依据。
1 仪器与试剂 1.1 仪器Alliance Waters e2695高效液相色谱系统,Alliance Waters 2998 PDA检测器,Empower 3色谱工作站(Waters公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);CP114电子分析天平(上海奥豪斯仪器有限公司)。
1.2 试药对照品去甲异波尔定(批号170910)、乌药醚内酯(批号111568-201204)、乌药内酯(批号P1328-401200)分别购买于国家标准品网、中国食品药品检定研究所、上海纯优生物有限公司,含量分别为98%、99.5%、98.08%。
甲醇、甲酸均为色谱纯,水为超纯水,其余均为分析纯;D101大孔吸附树脂(国药集团化学试剂有限公司)。
用于流动相制备的53批次饮片(S代表生品,34批;V代表醋炙品,19批)购自各省大药房和医院,所有实验样品均经湖南中医药大学第一附属医院欧阳荣教授鉴定为正品,样品信息见表 1。
|
|
表 1 乌药饮片的来源 Table 1 Source of the prepared slices |
色谱柱:Agilent 5 HC-C18(2)(250 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.05%甲酸水溶液(B),梯度洗脱(0~5 min,40%A→75%A;5~10 min,75%A→78%A;10~20 min,78%A→100%A;20~30 min,100%A);流速:1 mL·min-1;检测波长:235 nm;柱温25 ℃;进样量:10 μL。
2.2 供试品溶液及混合对照品溶液的制备取样品粉末(过5号筛目)约3.0 g,精密称定,置于50 mL锥形瓶中,精密加入甲醇30 mL,超声(功率250 W,频率40 kHz)提取30 min,抽滤,旋干,再用水30 mL复溶,加入D101大孔吸附树脂层析柱(D101大孔吸附树脂90 g,4.6 cm×90 cm),静态吸附20 min,之后依次以水、30%乙醇水、95%乙醇水各1 000 mL洗脱,收集95%乙醇水洗脱溶液,旋干,最后用30 mL甲醇溶解,取1 mL溶液过0.2 μm微孔滤膜,即得供试品溶液。
精密称取去甲异波尔定、乌药醚内酯、乌药内酯的对照品各0.001 g,置于同一10 mL棕色量瓶中,加甲醇溶解并稀释至刻度,摇匀,取1 mL过0.2 μm微孔滤膜,即得混合对照品溶液。
2.3 方法学考察 2.3.1 精密度试验取同一批乌药饮片粉末,按“2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样测定6次,各主要峰(占总峰面积5%以上)的相对保留时间、相对峰面积的RSD均小于3.0%;以第1次进样所得指纹图谱作为对照图谱计算相似度,其相似度均大于0.99,符合指纹图谱的相关技术要求(应大于0.95)。结果表明该方法精密度良好。
2.3.2 重复性试验取同一批乌药饮片粉末,按“2.2”项方法平行制备供试品溶液6份,按“2.1”项下色谱条件进行指纹图谱测定,各主要色谱峰(图 2中对照图谱中的14个峰)的相对保留时间、相对峰面积的RSD均小于3.0%,其指纹图谱相似度均大于0.97,表明本方法重复性良好。
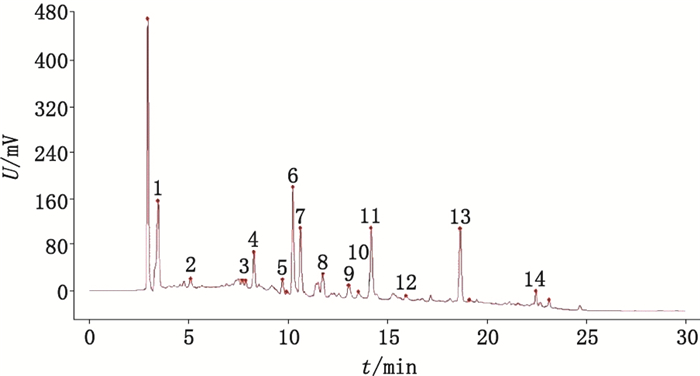
|
图 2 乌药对照图谱 Figure 2 Reference fingerprint of Linderae Radix |
取同一份供试品溶液,在上述色谱条件下分别于0、2、4、8、12、24 h进样测定,以0 h所得指纹图谱为对照,各指纹图谱相似度结果均大于0.99,表明供试品溶液24 h内稳定性良好。
2.4 指纹图谱建立和相似度评价取53批样本,分别按“2.2”项下方法制备供试品溶液,按照“2.1”项下色谱条件进行检测,记录指纹图谱(见图 1)。采用国家药典委员会中药色谱指纹图谱相似度软件(2012.0版)建立53批乌药共有模式图谱,确定14个特征峰作为乌药质量评价的变量指标(见图 2)。以上述共有模式为对照指纹图谱,对53批乌药的指纹图谱进行相似度评价,结果见图 3:通过夹角余弦法计算生/醋炙乌药与共有模式之间的相似度,生/醋炙乌药之间的相似度在0.51~0.70,表明生/醋炙乌药相似度较低,差异较大(颜色代表数值大小,颜色差异大说明相似度差异大,偏红偏绿的说明相似度较小)(见图 3)。为进一步进行分类并确定生/醋炙乌药差异的主要标志化合物,需要进一步采用其他化学模式识别方法。
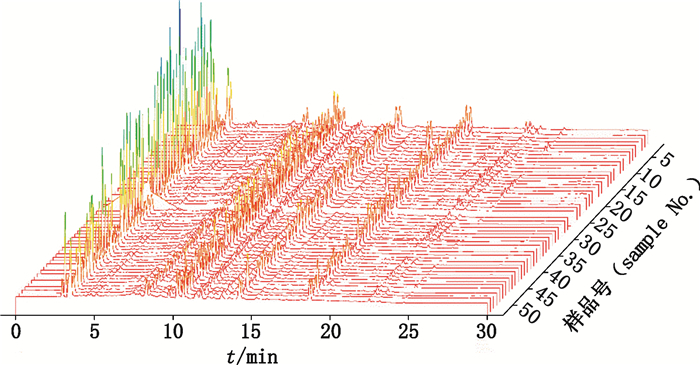
|
图 1 53批乌药HPLC指纹图谱 Figure 1 HPLC fingerprints of 53 batches of Linderae Radix |
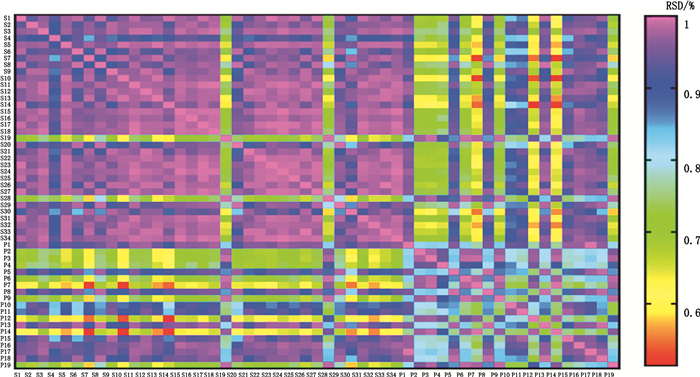
|
图 3 53批样品峰面积RSD Figure 3 RSDs of the peak areas of 53 batches of Linderae Radix |
进行主成分分析是为了便于观察不同生/醋炙品之间的差异性(不同的类别),在不损失大量信息的条件下,利用PCA将高维的指纹图谱数据转化为低维的数据[21]。53批样品所得的数据全部导入SIMCA 13.0进行PCA聚类分析,利用其前3个主成分(PC1、PC2和PC3)进行画图区分,从所得的方差贡献率来看,建立的模型累计解释参数R2Y、预测能力的参数Q2分别为0.841、0.793,说明该模型的区分程度和预测程度都较好。同时,3个主成分对于方差的总贡献度达到85.11%,说明利用PCA这种方法时,所选择的变量能较好地解释不同地区生/醋炙乌药的差异。另外,从PCA结果图(每1个点代表 1个样品来源)可知生品与醋炙品之间能基本上分为2类,但是利用PCA分类时,部分样品不能很好地分离,有一定的交叉(见图 4-a)。为了更好地建立生/醋炙乌药HPLC指纹图谱差异模型,本研究运用OPLS-DA方法继续进一步分析。结果表明,该方法能够很好地将生或醋炙乌药分成2类,以中间轴为界,左边为生品,右为醋炙品(见图 4-b);根据VIP > 1以及P < 0.05的变量来筛选导致差异性的主要化学成分,结果表明6号峰、1号峰、7号峰、14号峰、11号峰均为引起生/醋炙乌药差异的显著性标记物(见图 4-c)。再对排列试验进行验证,结果所有的蓝色的Q2值(左边)均小于原始值(右上角),说明该模型准确有效(见图 4-d)。
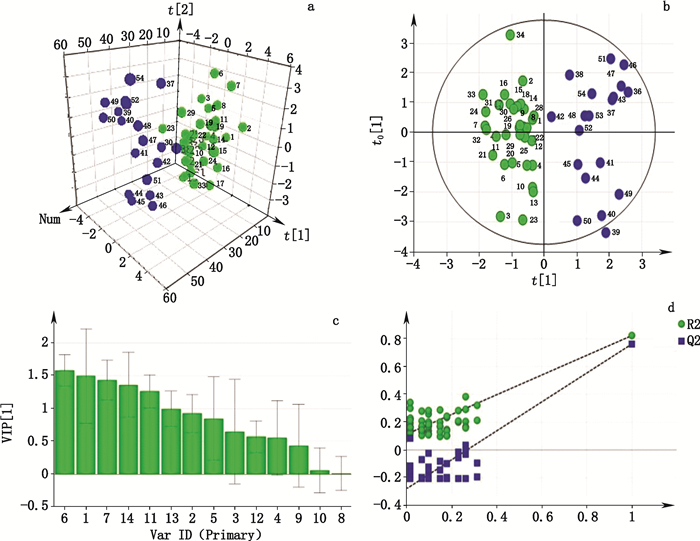
|
a.乌药主成分分析三维得分图(3D diagram scores plots of samples) b.乌药OPLS-DA得分图(OPLS-DA scores plots of samples) c. VIP标志物差异图(VIP of differentiation markers) d.排列试验验证(permutations plot for PLS and OP LS-DA models) 图 4 PCA和OPLS-DA结果 Figure 4 Results of PCA and OPLS-DA |
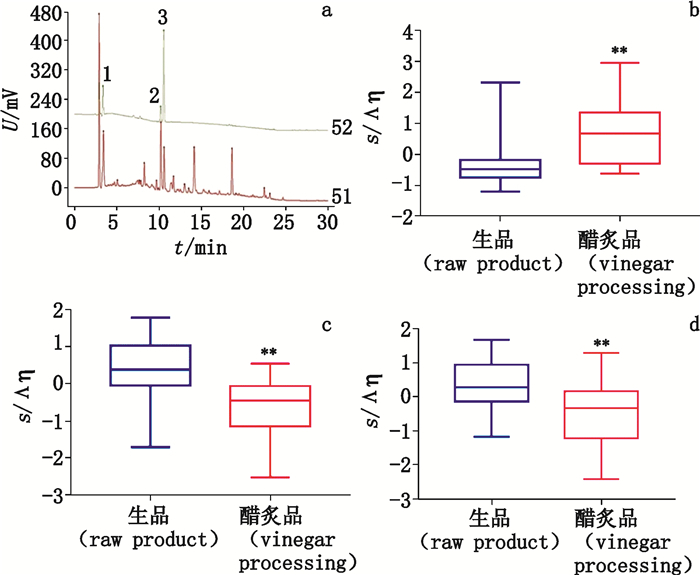
本研究继续通过对照品对照法确认上述筛选得到的标记物。通过HPLC图谱对照等方法,本研究确认了14个标记物中的3个贡献最大的组分,分别鉴定为去甲异波尔定、乌药醚内酯、乌药内酯(图 5-a)。如图 5-b所示箱线图可知,标记物1号峰为去甲异波尔定,表明这一活性成分在醋炙乌药中的含量明显较在生乌药中的高,而其他标记物所代表的化学活性成分在生乌药中的含量明显高于在醋炙乌药中的(见图 5-c、d)。
|
1.去甲异波尔定(norisoboldine) 2.乌药内脂(linderalactone) 3.乌药醚内酯(linderane) a.差异标记物的HPLC(HPLC of differentiation markers) b.标记物1号峰(去甲异波尔定)[VIP of differentiation markers 1(norisoboldine)]c.标记物6号峰(乌药内脂)[VIP of differentiation markers 6(linderalactone)]d.标记物7号峰(乌药醚内酯)[VIP of differentiation markers 7(linderane)] 图 5 生/醋炙乌药差异标志物确定 Figure 5 Differentiation markers of crude and vinegar processed Linderae Radix |
本实验对样品的提取方法、提取溶剂、分离条件进行考察,最终采用甲醇超声提取,用大孔吸附树脂吸附法作为前处理方法。本实验还优选了HPLC色谱条件,先后采用了甲醇-0.1%甲酸水、乙腈-0.1%甲酸水、甲醇-0.05%甲酸水作为流动相,对检测波长280、235、260 nm进行优选,最终确定采用色谱柱Agilent 5 HC-C18(2)(250 mm×4.6 mm,5 μm),以甲醇-0.05%甲酸水溶液为流动相梯度洗脱,检测波长235 nm。在上述色谱条件下HPLC特征指纹图谱色谱峰较多,分离效果较好。
本课题收集了53批次不同地区乌药生/醋炙品,并通过HPLC指纹图谱结合模式识别的方法确定了3个乌药生/醋炙品中共有的差异标记物,分别鉴定为去甲异波尔定、乌药内酯、乌药醚内酯。其中去甲异波尔定、乌药醚内酯均为《中华人民共和国药典》2015年版规定的乌药质量控制组分,说明本研究的结果和《中华人民共和国药典》一致,同时,比药典规定的多了1个参考质控标准。本研究对于完善乌药的质量控制标准具有一定参考意义,同时也为醋炙乌药质量控制和开展醋炙乌药药理药效机制提供了可靠的科学依据。但是,鉴于目前收集的醋炙乌药样品还相对较少,后续实验需要进一步增加样品批次,不断修正醋炙乌药特征图谱。对于生/醋炙乌药图谱中共有峰的定性,还需借用液质联用、核磁共振等手段进行确认。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 76 ChP 2015. Vol Ⅰ[S]. 2015: 76 |
| [2] |
温中京, 陈海委. 乌药的本草学考证[J]. 江西中医药, 2009, 40(3): 57. WEN ZJ, CHEN HW. Decipherment of ancient literature about Lindera aggregata[J]. Jiangxi Univ Tradit Chin Med, 2009, 40(3): 57. DOI:10.3969/j.issn.0411-9584.2009.03.037 |
| [3] |
邢梦雨, 田崇梅, 夏道宗. 乌药化学成分及药理作用研究进展[J]. 天然产物研究与开发, 2017, 29(12): 2147. XING MY, TIAN CM, XIA DZ. Review on chemical constituents and pharmacological effects of Lindera aggregata Kosterm[J]. Nat Prod Res Dev, 2017, 29(12): 2147. |
| [4] |
海萍, 高原, 李蓉涛, 等. 乌药的化学成分研究[J]. 中草药, 2016, 47(6): 872. HAI P, GAO Y, LI RT, et al. Chemical constituents from root of Lindera aggregata[J]. Chin Tradit Herb Drugs, 2016, 47(6): 872. |
| [5] |
陈方亮, 余翠琴. 乌药的药理研究概况[J]. 海峡药学, 2011, 23(12): 44. CHEN FL, YU CQ. Research progress in pharmacological effects of Lindera aggregata[J]. Strait Pharm J, 2011, 23(12): 44. DOI:10.3969/j.issn.1006-3765.2011.12.021 |
| [6] |
郑运亮.乌药、锦灯笼药效物质及质量评价方法研究[D].杭州: 浙江大学, 2012 ZHENG YL. Studies on the Pharmacodynamic Materials and Quality Evalution Method of Lindera aggregate[D]. Hangzhou: Zhejiang University, 2012 |
| [7] |
CAO Y, XUAN B, PENG B, et al. The genus Lindera:a source of structurally diverse molecules having pharmacological significance[J]. Phytochem Rev, 2016, 15(5): 869. DOI:10.1007/s11101-015-9432-2 |
| [8] |
陈潮, 汤小刚, 王军伟, 等. 乌药不同提取物对酒精性肝损伤大鼠肝脏及小肠组织形态学的干预研究[J]. 浙江中西医结合杂志, 2017, 27(11): 940. CHEN C, TANG XG, WANG JW, et al. Effect of extracts from Radix Linderae on monrphology of liver and intestinal tissue in rats with alcoholic liver disease[J]. Zhejiang J Integr Tradit Chin West Med, 2017, 27(11): 940. DOI:10.3969/j.issn.1005-4561.2017.11.009 |
| [9] |
郑运亮, 栾连军, 甘礼社, 等. HPLC法同时测定乌药中3种倍半萜内酯的含量[J]. 中国中药杂志, 2009, 34(21): 2777. ZHENG YL, LUAN LJ, GAN LS, et al. Simultaneous determination of three sesquiterpene lacton components in Lindera aggratata by HPLC[J]. China J Chin Mater Med, 2009, 34(21): 2777. DOI:10.3321/j.issn:1001-5302.2009.21.021 |
| [10] |
方玲, 陈方亮, 余翠琴, 等. 不同产地乌药的HPLC指纹图谱研究[J]. 中草药, 2013, 44(2): 229. FANG L, CHEN FL, YU CQ, et al. HPLC fingerprint analysis of Linderae Radix from different habitats[J]. Chin Tradit Herb Drugs, 2013, 44(2): 229. |
| [11] |
朱发伟, 孙乙铭, 王彬辉, 等. 不同产地乌药质量研究[J]. 浙江中西医结合杂志, 2015, 25(12): 1166. ZHU FW, SUN YM, WANG BH, et al. Quality research of Linderae Radix from different growing areas[J]. Zhejiang J Integr Tradit Chin West Med, 2015, 25(12): 1166. DOI:10.3969/j.issn.1005-4561.2015.12.035 |
| [12] |
张婷, 康显杰, 杨莹, 等. 不同产地乌药质量的评价[J]. 中成药, 2017, 39(10): 2113. ZHANG T, KANG XJ, YANG Y, et al. Quality evaluation of Linderae Radix from different growing areas[J]. Chin Tradit Pat Med, 2017, 39(10): 2113. DOI:10.3969/j.issn.1001-1528.2017.10.026 |
| [13] |
周新蓓, 欧阳荣. 乌药不同炮制品中乌药醚内酯的含量测定[J]. 中药材, 2008(3): 350. ZHOU XB, OUYANG R. Content determination of linderane linderalactone in different processde products of Lindera aggratata[J]. J Chin Med Mater, 2008(3): 350. DOI:10.3321/j.issn:1001-4454.2008.03.011 |
| [14] |
左美玲, 欧阳荣, 皮晓华. 乌药不同炮制品中乌药内酯含量测定[J]. 中国医药指南, 2010, 8(5): 43. ZUO ML, OUYANG R, PI XH. Content determination of linderalactone in different processed products of Lindera aggratata[J]. Guide China Med, 2010, 8(5): 43. DOI:10.3969/j.issn.1671-8194.2010.05.024 |
| [15] |
李珊, 陈文明, 欧阳荣. 乌药及其炮制品不同提取物镇痛作用的研究[J]. 中国现代应用药学, 2015, 32(11): 1306. LI S, CHEN WM, OUYANG R. Studies on analgesic effects of different extracts of Linderae Radix and it's processed products[J]. Chin J Mod Appl Pharm, 2015, 32(11): 1306. |
| [16] |
孔浩, 郭庆梅, 王慧慧, 等. 主成分分析法在中药质量评价中的应用[J]. 辽宁中医杂志, 2014, 41(5): 890. KONG H, GUO QM, WANG HH, et al. Principal conponents analysis in quality evaluation of traditional Chinese medicine[J]. Liaoning J Tradit Chin Med, 2014, 41(5): 890. |
| [17] |
王洋, 申丽, 江坤, 等. 中药砂仁质量的化学模式识别研究[J]. 药物分析杂志, 2016, 36(10): 1863. WANG Y, SHEN L, JIANG K, et al. Quality assessment of the traditional Chinese medicine Amomum villosum by chemical pattern recognition technique[J]. Chin J Pharm Anal, 2016, 36(10): 1863. |
| [18] |
ABDI H, WILLIAMS LJ. Principal component analysis[J]. Wiley Interdiscipl Rev Comput Stat, 2010, 2(4): 433. DOI:10.1002/wics.101 |
| [19] |
李俊南, 侯艳, 李康. 核正交偏最小二乘在代谢组学数据分析中的应用[J]. 中国卫生统计, 2015, 32(1): 14. LI JN, HOU Y, LI K. The application of kernal orthogonal projection to latent structurs(KOPLS)in metabolomics data analysis[J]. Chin J Health Stat, 2015, 32(1): 14. |
| [20] |
BOCCARD J, RUTLEDGE DN. A consensus orthogonal partial least squares discriminant analysis(OPLS-DA)strategy for multiblock omics data fusion[J]. Anal Chim Acta, 2013, 769(6): 30. |
| [21] |
夏伯候, 胡玉珍, 熊苏慧, 等. 随机森林算法在中药指纹图谱中的应用:以不同品牌夏桑菊颗粒指纹图谱分析为例[J]. 中国中药杂志, 2017, 42(7): 1324. XIA BH, HU YZ, XIONG SH, et al. Application of random forest algorithm in fingerprint of Chinese medicine:different brands of Xiasangju granules as an example[J]. China J Chin Mater Med, 2017, 42(7): 1324. |
 2018, Vol. 38
2018, Vol. 38 
