药物中存在的杂质,按其理化性质一般分为有机杂质、无机杂质及残留溶剂3类[1]。近年来,基因毒性杂质因其重大的安全风险,逐渐引起了广泛关注,欧洲药物管理局(EMA)与美国食品药品监督管理局(FDA)等机构陆续发布针对基因毒性杂质的指南,对该类杂质的控制与评估提出要求[1-9]。2004年,EMA下属的人用医药品委员会(CHMP)发布了《基因毒性杂质限度指南》,提出有必要采用“可接受风险水平”的概念,以毒理学关注阈值(threshold of toxicological concern,TTC)控制基因毒性杂质,TTC为1.5 μg·d-1(相当于十万分之一的患癌风险)[10-12]。根据患者每天预计的服用剂量,便可计算出原料药中所允许的基因毒性杂质的含量。
托吡司特是新型非嘌呤类选择性黄嘌呤氧化还原酶(XOR)抑制剂,用于治疗痛风、高尿酸血症。在合成工艺中可能存在潜在的基因毒性杂质对甲苯磺酸异丙酯(杂质H)、对甲苯磺酸仲丁酯(杂质I)和对甲苯磺酸乙酯(杂质J)[13-15]。目前尚未见有托吡司特基因毒性杂质测定的报道,因此本文拟建立一种高效液相色谱(HPLC)方法,可以简便快速检测托吡司特中上述3种杂质的含量。在托吡司特说明书中表明,本品每天总剂量应不超过180 mg;参照EMA《基因毒性杂质限度指南》,按原料药中基因毒性杂质限度1.5 μg·d-1计算,托吡司特中基因毒性杂质均应不得过0.000 833%。
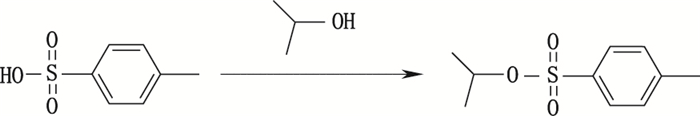
托吡司特合成过程中采用了对甲苯磺酸一水合物,在反应过程中,对甲苯磺酸一水合物和溶剂异丙醇发生缩合形成杂质H,产生途径见图 1。
|
图 1 对甲苯磺酸异丙酯(杂质H)的形成 Figure 1 Formation of isopropyl p-toluenesulfonate(impurity H) |
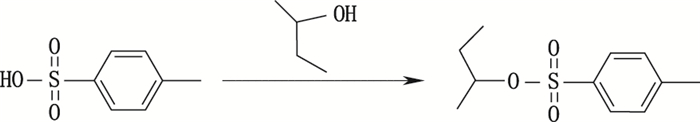
在反应过程中,对甲苯磺酸一水合物和溶剂2-丁醇发生缩合形成杂质I,产生途径见图 2。
|
图 2 对甲苯磺酸仲丁酯(杂质I)的形成 Figure 2 Formation of sec-butyl p-toluenesulfonate(impurity I) |
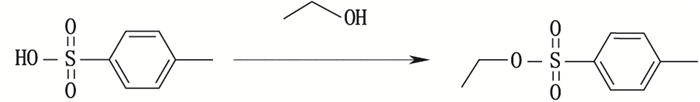
在洗涤过程中,对甲苯磺酸和无水乙醇会反应形成杂质J,具体形成过程见图 3。
|
图 3 对甲苯磺酸乙酯(杂质J)的形成 Figure 3 Formation of ethyl p-toluenesulfonate(impurity J) |
岛津20A高效液相色谱仪,岛津SPD-M20A、SPD-20A检测器。
1.2 试药托吡司特对照品,纯度99.86%,批号20140518;杂质H对照品,纯度100.0%,批号20140702;杂质I对照品,纯度100.0%,批号20140703;杂质J对照品,纯度100.0%,批号20140705;托吡司特样品,批号20140703。上述对照品及样品均为泰州锦鸿医药科技有限公司自制。乙腈为色谱纯,试验用水为超纯水。
2 方法与结果 2.1 色谱条件色谱柱:Aglient Eclipse Plus C18柱(4.6 mm×100 mm,3.5 μm);流动相:水为A相,乙腈为B相,梯度洗脱(0~50 min,75%A→40%A;50~50.1 min,40%A→75%A;50.1~60 min,75%A);流速:0.8 mL·min-1;检测波长:220 nm;柱温:40 ℃;进样量:20 μL。
2.2 溶液的制备 2.2.1 对照品溶液取托吡司特对照品125 mg,精密称定,置10 mL量瓶中,加乙腈适量,超声(功率100 W,频率40 kHz)10 min使溶解,并用乙腈稀释至刻度,摇匀,即得托吡司特对照品溶液。取杂质H、I、J的对照品各约20 mg,精密称定,分别置100 mL量瓶中,加乙腈适量,超声(功率100 W,频率40 kHz)10 min使溶解,并用乙腈稀释至刻度,摇匀,即得杂质H、I、J的对照品储备溶液;再分别精密吸取杂质H、I、J的对照品储备溶液各0.2 mL,分别置100 mL量瓶中,加乙腈稀释至刻度,摇匀,即分别得杂质H、I、J的单一对照品溶液。
2.2.2 混合对照品溶液分别精密吸取杂质H、I、J的对照品溶液各2.5 mL,置同一10 mL量瓶中,加乙腈稀释至刻度,摇匀,即得混合对照品溶液。
2.2.3 供试品溶液取托吡司特样品125 mg,精密称定,置10 mL量瓶中,加乙腈适量,超声(功率100 W,频率40 kHz)10 min使溶解,并用乙腈稀释至刻度,摇匀,即得供试品溶液。
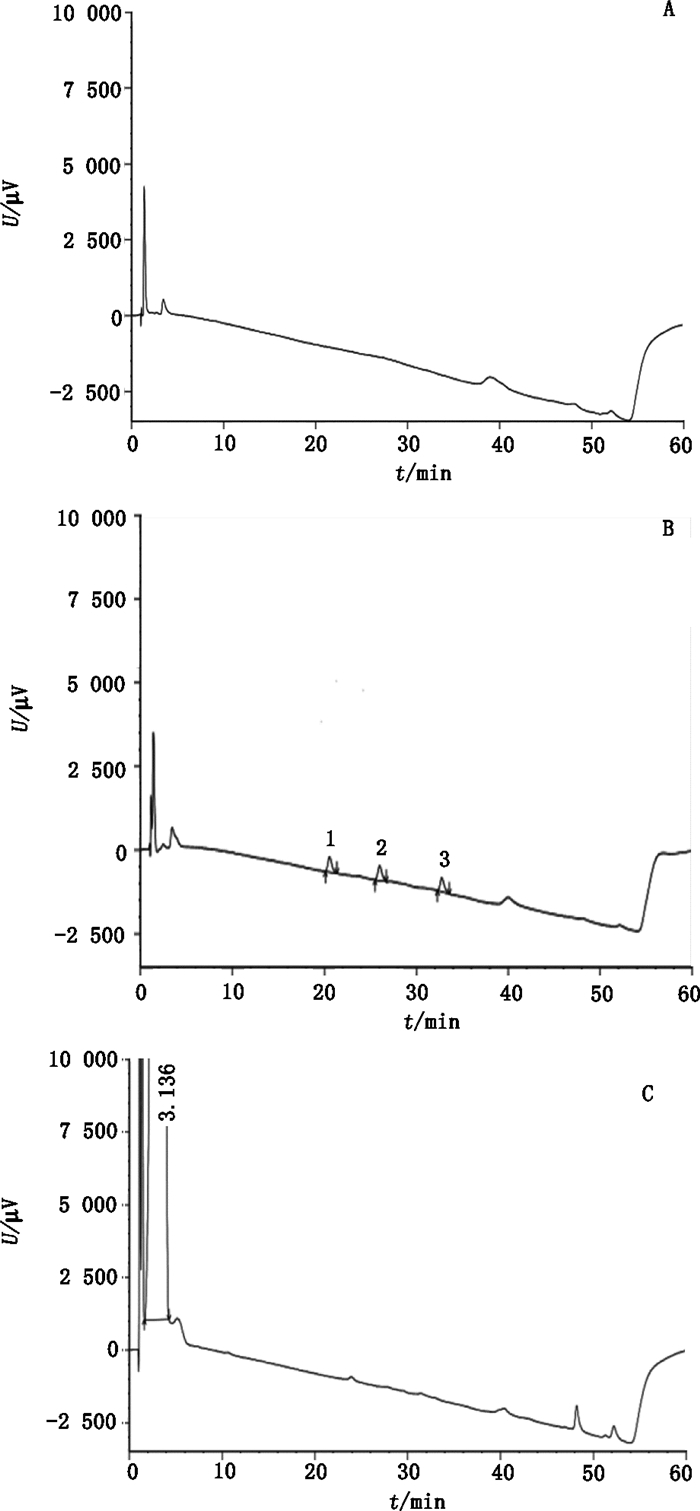
2.3 专属性试验取溶剂乙腈、混合对照品溶液和供试品溶液,分别进样分析,结果见图 4。测定结果表明,杂质H、I、J和托吡司特在本文色谱条件下分离度较好,溶剂不干扰测定。
|
1.杂质J(impurity J)2.杂质H(impurity H)3.杂质I(impurity I)A.溶剂(solvent)B.混合对照品(mixed reference substances)C.样品(sample) 图 4 专属性试验的HPLC色谱图 Figure 4 HPLC chromatograms of specificity test |
取混合对照品溶液室温放置26 h,于0、2、5、8、13、16、26 h分别进样测定,结果杂质H、I、J峰面积的RSD分别为2.3%、1.7%、1.6%;表明26 h内杂质H、I、J在溶剂中的稳定性良好。
2.5 定量下限与检测下限测定精密称取杂质H对照品25.25 mg,杂质I对照品24.00 mg和杂质对照品J 25.50 mg,置同一50 mL量瓶中,用乙腈溶解并稀释至刻度,摇匀,即得混合对照品储备液。取混合对照品储备液,用乙腈逐级稀释,进样测定,直至峰高约为基线噪音的10倍,测得杂质H的定量下限为0.050 5 μg·m L-1(相当于供试品溶液浓度的0.000 40%),杂质I的定量下限为0.048 0μg·m L-1(相当于供试品溶液浓度的0.000 38%),杂质J的定量下限为0.051 0 μg·m L-1(相当于供试品溶液浓度的0.000 41%)。连续进样6次,杂质H、I和J峰面积的RSD分别为2.3%、1.4%和1.7%,表明定量下限具有一定的精密度。
取上述定量下限溶液,用乙腈逐级稀释,进样测定,直至峰高约为基线噪音的3倍,测得杂质H的检测下限为0.016 7 μg·m L-1(相当于供试品浓度的0.000 13%),杂质I的检测下限为0.015 8μg·m L-1(相当于供试品浓度的0.000 13%),杂质J的检测下限为0.016 8 μg·m L-1(相当于供试品浓度的0.000 13%)。
2.6 线性关系考察精密称取杂质H对照品20.20 mg,杂质I对照品19.20 mg,杂质J对照品20.40 mg,置同一200 mL量瓶中,加乙腈溶解并稀释至刻度,摇匀;精密量取1 mL,置100 mL量瓶中,用乙腈稀释至刻度,摇匀;精密量取0.5、0.6、0.8、1.0、1.2、1.5和2.0 mL,分别置10 mL量瓶中,加乙腈稀释至刻度,摇匀,即得系列混合对照品溶液。精密量取上述各溶液20 μL,分别注入液相色谱仪,记录峰面积。以质量浓度X(μg·m L-1)为横坐标,主峰面积Y为纵坐标,进行线性回归。杂质H、I、J线性回归方程分别为:
| $ \begin{array}{l} Y = 6.720\;2 \times {10^4}X - 416.069\;4\;\;\;\;{R^2} = 0.999\;7\\ Y = 6.670\;9 \times {10^4}X - 415.401\;9\;\;\;\;{R^2} = 0.999\;8\\ Y = 6.715\;0 \times {10^4}X - 339.995\;8\;\;\;\;{R^2} = 0.999\;5 \end{array} $ |
进样质量浓度分别在0.050~0.202、0.048~0.192、0.051~0.204 μg·m L-1范围内与其峰相应值呈良好线性关系。
2.7 进样精密度、重复性与中间精密度试验取杂质H、I、J的对照品适量,以乙腈制得约0.1 μg·m L-1的混合对照品溶液,连续进样6次,计算得杂质H、I、J峰面积的RSD分别为1.8%、1.5%和1.6%,表明进样精密度良好。取托吡司特样品适量,按“2.2.3”项下方法平行制备6份供试品溶液,进样测定,均未检出杂质;另配制含杂质H、I、J均约为0.000 83%的供试品溶液6份,进样测定,计算得杂质H、I、J峰面积的RSD分别为1.7%、1.4%、1.6%,表明方法重复性良好。由2位人员分别在周一和周三使用安捷伦高效液相色谱仪及岛津高效液相色谱仪对托吡司特样品进行测定,均在样品中加入杂质限度(0.000 83%)的杂质H、I、J对照品,制备供试溶液,进样测定;测得供试溶液中杂质H平均浓度为0.098 2 μg·m L-1,RSD为1.9%(n=12);杂质I平均质量浓度为0.098 8 μg·m L-1,RSD为1.4%(n=12);杂质J平均质量浓度为0.099 9 μg·m L-1,RSD为1.7%(n=12);结果表明本方法中间精密度良好。
2.8 准确度试验准确度是通过在样品中加入杂质限度的80%、100%、120% 3个不同浓度的各杂质测得的回收率所得。已知杂质的准确度是加入已知量的杂质,再测定加样样品中已知杂质的测定结果和加入量的比值(回收率),以百分率来表达,要求在90.0%~110.0%之间,以证实方法具有良好的准确度。测定结果见表 1~3。
|
|
表 1 杂质H准确度测定结果 Table 1 Recovery tests of impurity H |
|
|
表 2 杂质I准确度测定结果 Table 2 Recovery tests of impurity I |
|
|
表 3 杂质J准确度测定结果 Table 3 Recovery tests of impurity J |
取3批托吡司特样品,分别按“2.2.3”项下方法制备供试品溶液;按“2.2.2”项下方法制备混合对照品溶液;精密量取供试品溶液与混合对照品溶液各20 μL,分别注入液相色谱仪,按外标法以峰面积计算托吡司特中杂质H、I和J的含量。结果显示,3批样品中均未检出杂质H、I和J。
3 讨论 3.1 最大吸收波长的选择托吡司特的杂质H最大吸收波长224.8 nm,托吡司特杂质I最大吸收波长224.80 nm,托吡司特杂质J最大吸收波长223.8 nm,托吡司特最大吸收波长为217.60、272.80 nm,本文选择220 nm作为托吡司特的基因毒性杂质检查的检测波长。
3.2 流动相的确定以0.1%磷酸溶液(用氢氧化钠溶液调pH 3.0)为流动相A,乙腈为流动相B,采用不同比例的等度和梯度进行洗脱,进样检测,结果发现溶剂对基因杂质峰稍有干扰;改用以水为流动相A,乙腈为流动相B,梯度洗脱,3个基因毒性杂质H、I和J均出峰情况较好,且与主峰及其他杂质峰完全可以达到基线分离。
3.3 小结试验说明,HPLC法线性关系与精密度均良好,方法准确度高,检测下限与定量下限能满足分析要求,可以准确可靠地检测托吡司特中的基因毒性杂质H、I和J,具有快速简便等优点。
| [1] |
国家食品药品监督管理总局.国食药监注[2005] 106号化学药物杂质研究的技术指导原则[S].2005 State Food and Drug Administration.State Food and Drug Administration Note[2005] 106 Technical Guidelines for the Study of Chemical Impurities[S].2005 |
| [2] |
王萍, 徐彩虹, 陈仙, 等. 原料药中基因毒性杂质控制的研究进展[J]. 中国现代应用药学, 2015, 32(1): 119. WANG P, XU CH, CHEN X, et al. Development of genotoxic impurities control in active pharmaceutical ingredient[J]. Chin J Mod Appl Pharm, 2015, 32(1): 119. |
| [3] |
张慧敏, 林建群, 冯康彪, 等. 药品中遗传毒性杂质的评估和控制[J]. 中国现代应用药学, 2014, 31(9): 1160. ZHANG HM, LIN JQ, FENG KB, et al. Evaluation and control of genotoxic impurities in drugs[J]. Chin Mod Appl Pharm, 2014, 31(9): 1160. |
| [4] |
EMA(European Medicines Agency).Guidelines on the Limits of Genotoxic Impurities[EB/OL].(2006-06-28)[2017-08-20].http://www.EMA.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002903.pdf
|
| [5] |
European Directorate for the Quality of Medicines and Health Care. Enquiry:Alkyl mesilate(methane sulfonate)impurities in mesilate salts[J]. Pharm Europa, 2000, 12(1): 27. |
| [6] |
Committee for Proprietary Medicinal Products.Position Paper on the Limits of Genotoxic Impurities[S].2002
|
| [7] |
European Medicines Agency.EMEA/CHMP/SWP/431994/2007 Pre-authorization Evaluation of Medicines for Human Use, Question & answers on the CHMP Guideline on the Limits of Genotoxic Impurities[S].2008
|
| [8] |
张芳芳, 朱心强. 新药中遗传毒性杂质及其管理[J]. 浙江预防医学, 2007, 19(12): 65. ZHANG FF, ZHU XQ. Genotoxicity in new drugs and its management[J]. Zhejiang J Prev Med, 2007, 19(12): 65. DOI:10.3969/j.issn.1007-0931.2007.12.048 |
| [9] |
宋冬梅, 徐倩昱, 任美婷, 等. HPLC-Q TOF MS法测定马来酸依那普利及中间体中的对甲苯磺酸乙酯[J]. 药物分析杂志, 2012, 32(5): 834. SONG DM, XU QY, REN MT, et al. Determination of ethyl p-toluenesulfonate in enalapril maleate and its intermediates by HPLC-Q TOF MS[J]. Chin J Pharm Anal, 2012, 32(5): 834. |
| [10] |
U.S.Department of Health and Human Services Food and Drug Administration.Guidance for Industry.Genotoxic and Carcinogenic Impurities in Drug Substances and Products: Recommended Approaches(Draft guideline)[S].2008
|
| [11] |
KROES R, RENWICK AG, CHEESEMAN M, et al. Structure-based thresholds of toxicological concern(TTC):guidance for application to substances present at low levels in the diet[J]. Food Chem Toxicol, 2004, 42(1): 65. DOI:10.1016/j.fct.2003.08.006 |
| [12] |
MULLER L, MAUTHE RJ, RILEY CM, et al. A rationale for determination, testing and controlling specific impurities in pharmaceuticals that possess potential for genotoxicity[J]. Regul Toxicol Pharmacol, 2006, 44(3): 198. DOI:10.1016/j.yrtph.2005.12.001 |
| [13] |
张园园, 李银峰, 王杰晶, 等. 药物中痕量磺酸酯类物质的检测技术研究进展[J]. 药物评价研究, 2012, 35(4): 304. ZHANG YY, LI YF, WANG JJ, et al. Research progress in detection technology of trace sulfonate in drugs[J]. Drug Eval Res, 2012, 35(4): 304. |
| [14] |
孙朴. HPLC法测定氢溴酸西酞普兰中的基因毒性杂质对甲苯磺酸乙酯[J]. 药学研究, 2012, 35(11): 304. SUN P. Determination of genotoxic impurities p-toluenesulfonate in citalopram hydrobromide by HPLC[J]. J Pharm Res, 2012, 35(4): 304. |
| [15] |
马磊, 马玉楠, 陈震, 等. 遗传毒性杂质的警示结构[J]. 中国新药杂志, 2014, 23(18): 2106. MA L, MA YN, CHEN Z, et al. Warning structure of genotoxic impurities[J]. Chin J New Drugs, 2014, 23(18): 2106. |
 2018, Vol. 38
2018, Vol. 38 