聚氯乙烯固体药用硬片广泛用于医药产业,如片剂、胶囊剂、栓剂等固体制剂,也可用于滴剂等液体制剂。由于其属于直接接触药品的包装材料(以下简称药包材),所以必须符合药用安全要求,以保证临床用药安全[1-2]。根据国家药包材标准规定,聚氯乙烯固体药用硬片需按照《中华人民共和国药典》2015年版四部通则1105、1106微生物限度检查法进行细菌数、霉菌和酵母菌数的测定,以及大肠埃希菌的检查。《中华人民共和国药典》2015年版四部的微生物限度检查法的计数方法是采用胰酪大豆胨琼脂培养基进行需氧菌总数测定,沙氏葡萄糖琼脂培养基进行霉菌和酵母菌总数测定。据此,本文对158批聚氯乙烯固体药用硬片分别按照《中华人民共和国药典》2010年版二部附录ⅪJ的微生物限度检查法测定细菌数、霉菌和酵母菌数;按照《中华人民共和国药典》2015年版四部通则1105、1106的微生物计数法测定需氧菌总数、霉菌和酵母菌总数以及检查大肠埃希菌,并对其中检出的污染菌株进行鉴定,旨在对国内固体药用硬片的微生物污染现状进行分析,为其微生物限度标准合理化和产品质量提高提供参考依据[3-5]。
1 材料与方法 1.1 仪器与材料EZ-S Stream TM pump(美国MILLIPORE公司),一次性EZ滤杯(规格:100 mL;批号:F7AA46440;孔径:0.45 μm;材质:尼龙膜),生物安全柜(美国Thermo公司),生化培养箱(德国Binder公司),VITEK全自动生化鉴定仪(法国梅里埃生物公司),杜邦全自动微生物基因指纹系统(美国DuPont公司),生物显微镜(日本Olympus公司)。
聚氯乙烯固体药用硬片:2015年全国评价性抽验品种,包括6种规格(0.25×250 mm、0.35×240 mm、0.25×190 mm、0.24×255 mm、0.28×255 mm、0.29×345 mm),16家企业158批样品。
1.2 试剂与菌种微生物限度检查用培养基及试剂均参照《中华人民共和国药典》2010年版二部附录ⅪJ、《中华人民共和国药典》2015年版四部通则1105的微生物限度检查项下的方法配制,并通过培养基适用性检查。
Buffer缓冲液、RiboPrinter试剂盒(批号2290、4066,DuPont公司)。
微生物限度检查用标准菌株:枯草芽孢杆菌(Bacillus subtilis)[CMCC-B63501]、金黄色葡萄球菌(Staphylococcus aureus)[CMCC-B 26003]、大肠埃希菌(Escherichia coli)[CMCC-B 44102]、铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]、白色念珠菌(Candida albicans)[CMCC-F 98001],中国医学细菌保藏中心;黑曲霉(Aspergillus niger)[CMCC-F 98003],中国食品药品检定研究院。
2 方法[4-5] 2.1 菌液制备取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌和大肠埃希菌的新鲜培养物以及黑曲霉的孢子悬液,用0.9%的无菌氯化钠溶液制成每1 mL含菌数为50~100 cfu的菌悬液,备用。
2.2 供试液制备方法取聚氯乙烯固体药用硬片100 cm2,将10支无菌棉签分别用0.9%的无菌氯化钠溶液沾湿,擦抹5次后投入含0.9%无菌氯化钠溶液30 mL中,摇匀,制成供试液①;取本品100 cm2,分别加50~100 cfu的试验菌悬液,取10支无菌棉签分别用0.9%的无菌氯化钠溶液沾湿,随意擦抹5次后投入含0.9%无菌氯化钠溶液30 mL中,摇匀,制成供试液②;取本品100 cm2,分别加50~100 cfu的试验菌悬液,取10支无菌棉签分别用0.9%的无菌氯化钠溶液沾湿,用力均匀擦抹5次后投入含0.9%的无菌氯化钠溶液30 mL中,摇匀,制成供试液③,备用。
2.3 细菌数、霉菌和酵母菌数、需氧菌总数、霉菌和酵母菌总数测定试验 2.3.1 细菌数、霉菌和酵母菌数测定方法验证试验薄膜过滤法:分别取供试液②、③30 mL全量通过一次性EZ滤杯后,加入0.9%无菌氯化钠溶液30 mL冲洗1次,滤过,将滤膜贴至营养琼脂培养基和玫瑰红钠琼脂培养基平板上,细菌置35 ℃培养24~48 h;霉菌和酵母菌置25 ℃培养48~72 h,观察结果。
2.3.2 需氧菌总数、霉菌和酵母菌总数测定方法适用性试验薄膜过滤法:分别取供试液②、③30 mL,全量通过滤膜后,加入0.9%无菌氯化钠溶液30 mL冲洗1次,滤过,将滤膜贴至胰酪大豆胨琼脂培养基和沙氏葡萄糖琼脂培养基平板上,需氧菌置30~35 ℃培养5 d;霉菌和酵母菌置20~25 ℃培养7 d,观察结果。
2.3.3 细菌数、霉菌和酵母菌数和需氧菌总数、霉菌和酵母菌总数测定试验薄膜过滤法:分别取供试液①30 mL,全量通过滤膜后,加入0.9%无菌氯化钠溶液30 mL冲洗1次,将滤膜分别贴至营养琼脂培养基、玫瑰红钠琼脂培养基板、胰酪大豆胨琼脂培养基和沙氏葡萄糖琼脂培养基平板上,细菌置、需氧菌置30~35 ℃培养5 d;霉菌和酵母菌置20~25 ℃培养7 d,观察结果。
2.4 控制菌检查试验 2.4.1 大肠埃希菌检查验证试验取聚氯乙烯固体药用硬片100 cm2,将10支无菌棉签分别用0.9%无菌氯化钠溶液沾湿,擦抹5次后投入100 mL胰酪大豆胨液体培养基中,再加入含菌数为50~100 cfu的大肠埃希菌悬液,30~35 ℃培养18~24 h,观察结果。
2.4.2 大肠埃希菌检查试验直接接种法:取本品100 cm2,将10支无菌棉签分别用0.9%的无菌氯化钠溶液沾湿,擦抹5次后投入100 mL胰酪大豆胨液体培养基中,30~35 ℃培养18~24 h,观察结果。
2.5 污染菌株分析采用仪器配置的专用菌落棒挑取从聚氯乙烯固体药用硬片中分离纯化的菌落至200 μL缓冲液中,混匀。取菌悬液30 μL置微量反应板,使用细菌热处理器加热25 min,加入裂解液,混匀备用。开启杜邦全自动微生物基因指纹系统并装入试剂盒,将微量反应板放入杜邦全自动微生物基因指纹系统进行菌株分析。
3 结果 3.1 微生物限度检查法的建立根据《国家药包材标准》规定,聚氯乙烯固体药用硬片的细菌数:100 cm2不得过1 000 cfu;霉菌和酵母菌数:100 cm2不得过100 cfu;大肠埃希菌100 cm2不得检出[4]。按照《中华人民共和国药典》2010年版二部附录ⅪJ微生物限度检查法[6]以及《中华人民共和国药典》2015年版四部通则1105、1106的微生物计数法和控制菌检查法中规定的试验菌株,聚氯乙烯固体药用硬片进行细菌、霉菌和酵母菌测定的验证试验和需氧菌总数、霉菌和酵母菌总数测定以及控制菌检查的方法适用性试验[3-5]。
供试液③采用薄膜过滤法时,5株试验菌采用以上2种微生物限度检查方法的3次回收率均在70%以上(采用《中华人民共和国药典》2010年版检查方法的试验结果见表 1,采用《中华人民共和国药典》2015年版检查方法的试验结果见表 2),证明了方法的有效性。
|
|
表 1 聚氯乙烯固体药用硬片微生物限度检查验证试验结果(《中华人民共和国药典》2010年版薄膜过滤法) Table 1 The validation test results of total aerobic microbial count in PVC sheet for solid pharmaceutical packaging (filtration method in ChP 2010) |
|
|
表 2 聚氯乙烯固体药用硬片微生物计数方法适用性试验结果(《中华人民共和国药典》2015年版薄膜过滤法) Table 2 The validation test results of total aerobic microbial count in PVC sheet for solid pharmaceutical packaging (filtration method in ChP 2015) |
进行控制菌检查的验证试验,采用直接接种法,能满足控制菌检查的基本要求。
3.2 聚氯乙烯固体药用硬片的微生物限度检查结果及其探讨 3.2.1 细菌数、霉菌和酵母菌数、需氧菌总数、霉菌和酵母菌总数测定结果细菌数:28批检出(17.7%);霉菌和酵母菌数:10批检出(6.3%);需氧菌总数:43批检出(27.2%);霉菌和酵母菌总数:11批检出(7.0%)。其中,细菌数测定结果最高值为23 cfu/100 cm2;霉菌和酵母菌数测定结果最高值为6 cfu/100 cm2;需氧菌总数测定结果最高值为30 cfu/100 cm2;霉菌和酵母菌总数测定结果最高值为8 cfu/100 cm2。
从聚氯乙烯固体药用硬片的细菌数、霉菌和酵母菌数、需氧菌总数、霉菌和酵母菌总数lg值结果分布可知(图 1),细菌数最高值为1.361 728,平均值为0.680 864;霉菌和酵母菌数最高值为0.778 151,平均值为0.389 076;需氧菌总数最高值为1.477 121,平均值为0.738 560 5;霉菌和酵母菌总数最高值为0.903 09,平均值为0.451 545;最低值均为0。
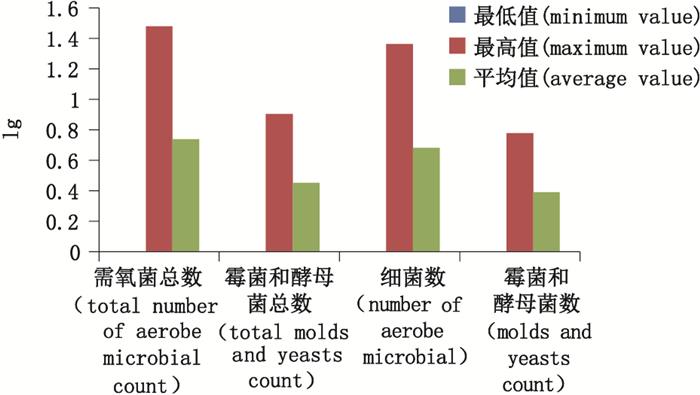
|
图 1 需氧菌总数、霉菌和酵母菌总数、细菌数、霉菌和酵母菌数lg值结果分布图 Figure 1 lg value distribution of the total number of aerobe microbial, the total molds and yeasts, the number of bacteria, fungi and yeast strains |
从聚氯乙烯固体药用硬片的需氧菌总数、霉菌和酵母菌总数测定结果区间结果分布可知(图 2),其需氧菌总数以及霉菌和酵母菌总数测定结果均显著低于标准限值。
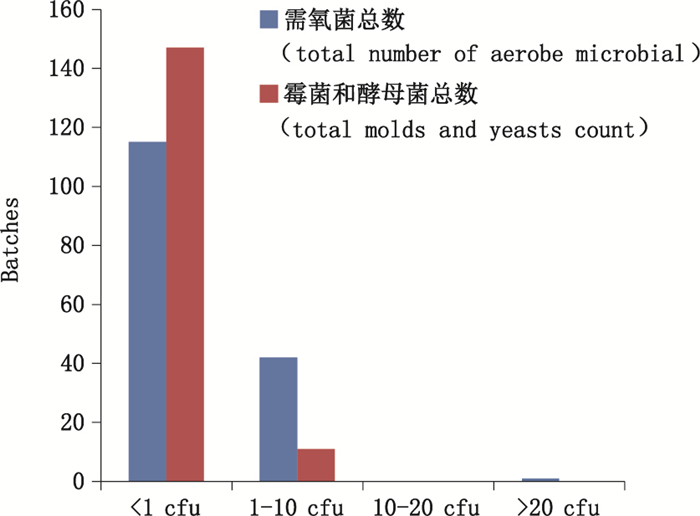
|
图 2 需氧菌总数、霉菌和酵母菌总数测定结果区间分布图 Figure 2 Interval distribution of the total number of aerobe microbial, the total molds and yeasts |
158批聚氯乙烯固体药用硬片样品中均未检出大肠埃希菌。
3.3 污染菌株鉴定结果采用全自动细菌鉴定试验系统对聚氯乙烯固体药用硬片中检出的污染菌进行菌株鉴定,其中按照《中华人民共和国药典》2010年版二部附录ⅪJ的微生物限度检查法检出类芽孢杆菌属(Paenibacillus provencensis)、短小芽孢杆菌/沙福芽孢杆菌(Bacillus pumilus/safensis)、马赛类芽孢杆菌(Paenibacillus massiliensis)、地衣形芽孢杆菌(Bacillus licheniformis)、莫海威芽孢杆菌(Bacillus mojavensis/subtilis)、巨大芽孢杆菌(bacillus megaterium),共计6种革兰阳性菌;按照《中华人民共和国药典》2015年版四部通则1105的微生物计数法不但检出上述6种污染菌,还检出地衣形芽孢杆菌(Bacillus licheniformis)、吉氏芽孢杆菌/马丁教堂芽孢杆菌(Bacillus gibsonii/murimartini)、蜡样芽孢杆菌/苏云金芽孢杆菌(Bacillus cereus/thuringiensis)、强固芽孢杆菌(Bacillus firmus)、解木聚糖类芽孢杆菌(Paenibacillus xylanilyticus)、死谷芽孢杆菌(Bacillus vallismortis/subtilis)6种革兰阳性菌,嗜麦芽寡养单胞菌(Stenotrophomonas)、抗辐射不动杆菌(Acinetobacter radioresistens)、嗜热菌属(Thermus igniterrae)3种革兰阴性菌。
上述在聚氯乙烯固体药用硬片干燥表面检出的污染菌,虽然不是危害性较大的致病菌,但也属于条件致病菌,在固体药品或液体制剂等适宜的环境下会迅速繁殖,会通过污染药品、食品、日化产品等对生产、生活造成危害。由于微生物具有非常丰富的酶系统,有强大的分解、转化物质的能力,会对中药的化学成分进行生物转化,产生新的化合物或引起中药中一些成分含量的变化,使中药中的部分抑菌成分被微生物转化为非活性成分,使其抗菌活性降低[6-8]。在人体基础病变引起机体防卫功能降低时导致各种感染[9-13]。而革兰阴性菌一旦侵入人体,可引发感染性休克、败血症、多器官功能性衰竭等多种疾病,其用药对象若是婴幼儿及衰弱患者,更会导致使用该药品的患者受到感染,危害免疫力低的用药人群[14-15]。
4 讨论 4.1 供试液制备方法对实验结果的影响根据供试液②、③试验菌回收率试验结果,由于棉签涂抹方式和塑料制品对微生物有一定吸附作用,会导致试验菌的回收达不到要求。因此,本方法适用性试验采用将10支无菌棉签分别用0.9%的无菌氯化钠溶液沾湿,用力均匀擦抹加试验菌株的聚氯乙烯固体药用硬片5次后,投入含30 mL的0.9%的无菌氯化钠溶液中,充分振摇,使吸附在固体硬片上的污染微生物能被更彻底地洗脱下来,从而提高检出率[16-17]。
4.2 对固体药用硬片的微生物限度检查方法和标准的探讨药品卫生标准是保证药品质量的重要因素,国外药典附录都列有药包材质量标准要求[18],我国规定药包材的微生物检查要求是参照国家药包材标准,即聚氯乙烯固体药用硬片需按照《中华人民共和国药典》2015年版四部通则1105、1106进行细菌数、霉菌和酵母菌数的测定和大肠埃希菌的检查。从试验结果可以看出检查方法和培养体系与国外药典一致[5, 19-21],对于药品微生物计数方法是采用胰酪大豆胨琼脂培养基测定需氧菌总数和沙氏葡萄糖琼脂培养基测定霉菌和酵母菌总数。因为《中华人民共和国药典》培养体系对微生物的促生长能力强,对158批聚氯乙烯固体药用硬片进行微生物计数,其需氧菌总数、霉菌和酵母菌总数测定结果和污染微生物检出率均高于按照《中华人民共和国药典》2010年版二部附录微生物计数方法规定的采用营养琼脂培养基测定细菌数和采用玫瑰红钠琼脂培养基霉菌和酵母菌数的结果[22]。且由于细菌、霉菌和酵母菌均属于需氧菌,建议将聚氯乙烯固体药用硬片的微生物限度检查项中细菌数更名为需氧菌总数,霉菌和酵母菌数更名为霉菌和酵母菌总数更为合理,并有利于固体药用硬片上污染微生物的检出,并在《中华人民共和国药典》中增设药包材的微生物检查项。
4.3 加强固体药用硬片产品的过程控制药品在其设计、生产、运输、贮存、销售的各个环节,都离不开包装,直接接触药品的包装材料更是药品重要组成部分。本次实验中,聚氯乙烯固体药用硬片的细菌数、霉菌和酵母菌数、需氧菌总数以及霉菌和酵母菌总数测定结果均显著低于标准限值,建议可按固体药用硬片的原料来源、性质、生产工艺条件、应用途径及微生物污染对患者的潜在危险等因素综合考虑,分类制订其合理安全的微生物限度标准,对于某些对患者有潜在危害性的产品,应制定更严格的微生物限度标准,并在其品种项下规定。从固体药用硬片的污染菌株鉴定结果可知,样品中检出的污染菌株既有生存环境要求低、繁殖快、耐受性强,一直被认为是药用原料、辅料的主要污染物的革兰阳性芽孢杆菌,也有革兰阴性菌,说明其微生物污染问题多且复杂。笔者分析是由于药包材涉及的行业门类较多,生产企业的规模和管理水平良莠不齐,一些企业在生产过程中没有相应的防止微生物污染的控制要求,甚至为了降低生产成本,在生产过程中添加二次回收材料等诸多生产管理问题直接影响了产品质量,并进一步影响药品的质量和使用安全[12, 23-24]。所以,药包材在生产过程中应在原材料的微生物污染控制、管理和操作人员所产生的污染控制、厂房及设施设备的污染控制和成品的储存场所以及有效期管理这四个方面,建立起从原料、中间产物、终产品、生产环境等全过程的微生物污染排查和溯源解决方案,对于产品的生产工艺和流程中存在微生物污染风险较高的环节,予以重视,及时排查污染源。并针对不同的产品类别,逐步建立微生物污染的控制警戒线和纠偏线,例如药包材成品应按要求包装完整、合理储存,并根据先进先出原则,按批号先后依次出库,以免存放时间过长造成微生物污染[25-26]。
| [1] |
白莹余, 刘黎. 中美药品包装研发概念与比较[J]. 上海医药, 2015, 36(15): 59. BAI YY, LIU L. Summary and comparision of the research and development of drug packaging between China and USA[J]. Shanghai Med, 2015, 36(15): 59. |
| [2] |
李宝林. 关于直接接触药品的包装材料和容器标准化管理的探讨和改进[J]. 中国药品标准, 2012, 13(2): 129. LI BL. Suggestions on administration of standardization for drug immediate packaging materials and containers[J]. Drug Stand China, 2012, 13(2): 129. DOI:10.3969/j.issn.1009-3656.2012.02.016 |
| [3] |
国家药包材标准[S]. 2015: 188 National Drug Packaging Standard[S]. 2015: 188 |
| [4] |
中华人民共和国药典2010年版. 二部[S]. 2010: 附录107 ChP 2010. Vol Ⅱ[S]. 2010: Appendix 107 |
| [5] |
中华人民共和国药典2015年版. 四部[S]. 2015: 通则1105 ChP 2015. Vol Ⅳ[S]. 2015: Appendix 1105 |
| [6] |
关维, 陈仪本. 枯草杆菌耐药转运蛋白Bmr及其基因Bmr的表达调控研究进展[J]. 微生物学通报, 2012, 39(2): 246. GUAN W, CHEN YB. Advances in multidrug resistance transporter Bmr of Bacillus subtilis and transcriptional regulation mechanism of its gene Bmr[J]. Microb Chin J, 2012, 39(2): 246. |
| [7] |
蓝晓红, 周永刚. 临床药师在创伤术后枯草芽孢杆菌感染中的药学监护[J]. 抗感染药学, 2013, 10(1): 68. LAN XH, ZHOU YG. Clinical pharmacists in the trauma of pharmaceutical guardianship of postoperative infection of Bacillus subtilis[J]. Anti Infect Pharm J, 2013, 10(1): 68. |
| [8] |
李国红, 张克勤, 沈月毛. 枯草芽孢杆菌对50种中药的发酵及抗菌活性检测[J]. 中药材, 2006, 29(2): 154. LI GH, ZHANG KQ, SHEN YM. The fermentation of 50 kinds of TCMs by Bacillus subtilis and the a ssay of antibacterial activities of fermented products[J]. Chin Med Mater J, 2006, 29(2): 154. DOI:10.3321/j.issn:1001-4454.2006.02.023 |
| [9] |
房海, 陈翠珍, 张晓君. 肠杆菌科病原细菌[M]. 北京: 中国农业科技出版社, 2011: 89. FANG H, CHEN CZ, ZHANG XJ. Pathogenic Bacteria of Enterobacteriaceae[M]. Beijing: China Agricultural Science Press, 2011: 89. |
| [10] |
时布卿. 赣榆县人民医院条件致病菌发布及其耐药情况分析[J]. 医学动物防制, 2011, 27(11): 1048. SHI BQ. Pathogens release Ganyuxian people's hospital and its drug resistance analysis[J]. Med Post Control, 2011, 27(11): 1048. DOI:10.3969/j.issn.1003-6245.2011.11.034 |
| [11] |
方四倍. 希瓦菌血流感染2例实验诊断和临床分析[J]. 淮海医药, 2013, 31(2): 139. FANG SB. Shiva bacterial blood infection, 2 cases of laboratory diagnosis and clinical analysis[J]. Huaihai Med, 2013, 31(2): 139. DOI:10.3969/j.issn.1008-7044.2013.02.026 |
| [12] |
梅玲. 条件致病菌所致腹泻的病原学分析[J]. 临床医学, 2004, 24(10): 49. MEI L. Condition the etiology of diarrhea caused by pathogenic bacteria[J]. Clin Med, 2004, 24(10): 49. DOI:10.3969/j.issn.1003-3548.2004.10.046 |
| [13] |
贾红岩, 崔婧, 王轶. 金黄色葡萄球菌感染的发布特征及耐药性分析[J]. 中华医院感染学杂志, 2013, 23(1): 190. JIA HY, CUI J, WANG Y. Distribution of Staphylococcus aureus infections and analysis of drug resistance[J]. Chin J Nosocomiol, 2013, 23(1): 190. |
| [14] |
李颜颜, 史峰, 李烨. 细菌类脂A结构与功能研究进展[J]. 微生物学报, 2008, 48(6): 845. LI YY, SHI F, LI Y. Structure and function of lipopolyaccharide lipid A in bacteria-A review[J]. Acta Microbiol Sin, 2008, 48(6): 845. |
| [15] |
王小元, 宋鸿军. 细菌内毒素的生物合成途径及分子结构多样性[J]. 食品与生物技术学报, 2013, 32(10): 1009. WANG XY, SONG HJ. Biosynthesis pathway and structure variability of bacterial endotoxin[J]. J Food Sci Biotechnol, 2013, 32(10): 1009. |
| [16] |
许文艳. 医药塑料包装材料[M]. 北京: 中国医药科技出版社, 2003: 68. XU WY. Pharmaceutical Plastic Packaging Materials[M]. Beijing: China Medical Science Press, 2003: 68. |
| [17] |
鲁军, 欧阳素英. 塑料滴眼瓶微生物限度检查方法探讨[J]. 怀化学院学报, 2007, 26(2): 11. LU J, OUYANG SY. Study for microbial limit inspection method of eye drug plastic tube[J]. Huaihua Univ J, 2007, 26(2): 11. |
| [18] |
刘倩, 张媛, 高华. 对现行《国家药品包装容器(材料)方法标准》中生物安全相关标准的几点修改建议[J]. 药物分析杂志, 2012, 32(10): 1889. LIU Q, ZHANG Y, GAO H. Biosafety suggestions in current national drug packaging containers(material)standard[J]. China J Pharm Anal, 2012, 32(10): 1889. |
| [19] |
JP16[S]. 2011: 120
|
| [20] |
EP 7. 0[S]. 2010: 5798
|
| [21] |
USP 36-NF 31[S]. 2012: 2023
|
| [22] |
由亚宁, 陈雪芹, 周志云. 2005年版《中国药典》和《欧洲药典》菌落计数培养基比较[J]. 中国药事, 2010, 24(6): 587. YOU YN, CHEN XQ, ZHOU ZY. Compare the colony counting method between the 2005 version Chinese Pharmacopeia and EP[J]. Chin Pharm Aff, 2010, 24(6): 587. |
| [23] |
王似锦, 刘文杰, 牛振东. 参苓白术丸微生物学质量分析与评价)[J]. 药物分析杂志, 2013, 33(4): 673. WANG SJ, LIU WJ, NIU ZD. Microbiological quality analysis and evaluation of Shenling Baizhu pills[J]. Chin Pharm Anal, 2013, 33(4): 673. |
| [24] |
郭健. 安徽省药包材监督抽验情况分析[J]. 中国药事, 2008, 22(12): 1072. GUO J. Analysis on surveillance of drugs packing material and containers in Anhui Province[J]. Chin Pharm Aff, 2008, 22(12): 1072. |
| [25] |
高用华, 张军. 药包材企业构建质量管理体系的研究[J]. 中国药事, 2012, 26(7): 659. GAO YH, ZHANG J. Quality management system building for pharmaceutical packaging material enterprises[J]. Chin Pharm Aff, 2012, 26(7): 659. DOI:10.3969/j.issn.1002-7777.2012.07.001 |
| [26] |
冯殊良. 高分子材料在药包材中的应用研究[J]. 当代化工研究, 2016, 8: 134. FENG SL. Research on the application of high polymer material in pharmaceutical packaging materials[J]. Chem Intermed, 2016, 8: 134. |
 2018, Vol. 38
2018, Vol. 38 
