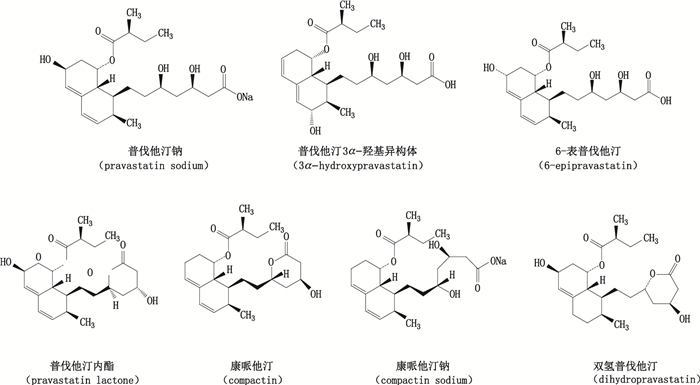
普伐他汀钠(+)-(βR,δR,1S,2S,6S,8S,8αR)-1,2,6,7,8,8α-六氢β,δ,6,8-四羟基-2-甲基-1-萘庚酸钠盐,8-[(2S)-2-甲基丁酸酯],结构式见图 1,适用于饮食限制仍不能控制的原发性高胆固醇血症或合并有高甘油三酯三酰甘油血症患者(IIa和IIb型)[1]。普伐他汀钠约34%吸收在肠道,全身系统生物利用度约为17%,普伐他汀以药物原型在尿中排泄约6%~7%[2],普伐他汀钠的代谢产物主要为普伐他汀3伐他羟基异构体和6-表普伐他汀等[3-4]。已有许多文献报道了用液相色谱-质谱联用方法对生物样品中普伐他汀钠的定量研究[5-7],主要代谢产物普伐他汀3伐他羟基异构体[8]也是普伐他汀钠中的重要降解产物。虽然文献报道采用液相色谱法测定普伐他汀钠中的杂质[9],但对杂质的定性报道较少。
|
图 1 普伐他汀钠及其杂质的化学结构 Figure 1 Chemical structures of pravastatin and its related substances |
本文采用UPLC-DAD-MS/MS技术,对普伐他汀钠原料及其制剂中杂质进行测定,并对其中6种重要杂质进行解析鉴别,并测定其在紫外光谱条件下的校正因子,为普伐他汀钠原料及其制剂的杂质定性定量检查提供可靠的科学依据,各杂质结构式见图 1。本文收集了市场上的各厂家生产的样品,对样品中的重要杂质定性定量,为生产企业提供改进生产工艺及质量控制中存在的问题提供参考。
1 仪器与试药 1.1 仪器Waters Quattro Premier XE QQQ超高效液相色谱-串联四极杆质谱仪,Waters AcquitTM UPLC超高效液相色谱仪,Waters Acquity UPLC四元泵;Waters Acquity UPLC柱温箱;Waters Acquity UPLC PDA二极管阵列检测器;软件MassLynx V 4.1版;AcQuity UPLCTM BEH C18色谱柱(2.1 mm×100 mm,1.7 μm)。Mill-Q Integral 5超纯水系统;Mettler XP205DR电子天平(d=0.01 mg);HermLe E300K离心机。
1.2 药品与试药普伐他汀四甲基丁胺对照品(中国食品药品检定研究院,批号100936-201301,供HPLC法测定,含量为99.6%),普伐他汀3α-羟基异构体对照品,自制,纯度95.7%;6-表普伐他汀,自制,纯度98.6%;普伐他汀内酯,自制,纯度99.4%。普伐他汀钠原料分别来源于4个企业,制剂为普伐他汀钠片和普伐他汀胶囊,分别来源于6个生产企业,见表 1。试验用水为超纯水,电阻率为18.2 mΩ,乙腈、甲醇为色谱纯,醋酸铵为优级纯,其他试剂均为分析纯。
|
|
表 1 样品信息表 Table 1 Information of samples |
色谱柱:AcQuity UPLCTM BEH C18(2.1 mm×100 mm,1.7 μm);流动相A为水-pH 7.0缓冲液(0.01 mol·L-1醋酸铵溶液,用氨水调节pH 7.0)-乙腈(52:30:18),流动相B为乙腈-pH 7.0缓冲液-水(60:30:10),梯度洗脱程序见表 2;流速:0.3 mL·min-1;柱温:25 ℃;检测波长:238 nm;进样量:1 μL。
|
|
表 2 梯度洗脱程序 Table 2 Gradient elution program |
电喷雾电离源(ESI);正离子模式ESI+;毛细管电压3.0 KV;样品锥孔电压30 V;源温120 ℃;脱溶剂气温度350 ℃;脱溶剂气流量500 L·h-1;锥孔气流量50 L·h-1。二级质谱:碰撞气为氩气;碰撞电压:20 V。
2.2 溶液的配制 2.2.1 供试品溶液精密称取各企业原料样品各约12.5 mg,分别置不同的25 mL量瓶中,用甲醇-水(1:1)溶解并稀释至刻度,摇匀。精密称取各企业制剂样品适量(相当于普伐他汀钠约12.5 mg),分别置不同的25 mL量瓶中,加甲醇-水(1:1)适量,振摇20 min,用甲醇-水(1:1)稀释至刻度,摇匀,即得。
2.2.2 强制降解溶液精密称取原料样品(来源A,批号10001)约12.5 mg及片剂细粉适量(来源E,批号100090,相当于普伐他汀钠约12.5 mg),分别置25 mL量瓶中,加3%过氧化氢适量,60 ℃加热3 h后,加3%过氧化氢至刻度,摇匀,即得原料及制剂氧化降解溶液。精密称取原料样品约12.5 mg及片剂细粉适量(相当于普伐他汀钠约12.5 mg),分别置25 mL量瓶中,加1 mol·L-1氢氧化钠溶液1 mL,30 min后加1 mol·L-1盐酸调节至pH 7.0,加甲醇-水(1:1)至刻度,摇匀,即得原料及制剂碱降解溶液。精密称取原料样品约12.5 mg及片剂细粉适量(相当于普伐他汀钠约12.5 mg),分别置25 mL量瓶中,加0.1 mol·L-1盐酸溶液1 mL,30 min后加0.1 mol·L-1氢氧化钠溶液调节至pH 7.0,加甲醇-水(1:1)至刻度,摇匀,即得原料及制剂酸降解溶液。精密称取原料样品约12.5 mg及片剂细粉适量(相当于普伐他汀钠约12.5 mg),分别置25 mL量瓶中,加甲醇-水(1:1)适量,80 ℃加热3 h后,加甲醇-水(1:1)至刻度,摇匀,即得原料及制剂热降解溶液。精密称取原料样品约12.5 mg及片剂细粉适量(相当于普伐他汀钠约12.5 mg),分别置25 mL量瓶中,加甲醇-水(1:1)适量,紫外灯(254 nm)照射2 h,加甲醇-水(1:1)至刻度,摇匀,即得原料及制剂光降解溶液。
2.2.3 校正因子线性溶液精密称取对照品普伐他汀四甲基丁胺、普伐他汀3α-羟基异构体、6-表普伐他汀和普伐他汀内酯适量,加甲醇-水(1:1)溶解并制成每1 mL中含2.598 3、2.205、2.015、2.035 mg的溶液。精密量取1、2、5、10和20 mL,分别置100 mL量瓶中,用甲醇-水(1:1)稀释至刻度,摇匀,即得。
3 结果 3.1 有关物质 3.1.1 原料普伐他汀钠在酸性条件下极不稳定,在碱性、氧化、加热和光照条件下较为稳定。综合各杂质的色谱、光谱和质谱信息,检出已知杂质6个,分别为普伐他汀3伐他羟基异构体、6-表普伐他汀、普伐他汀内酯、康哌他汀、康哌他汀钠和双氢普伐他汀。酸破坏主要形成3个主要降解产物,分别为普伐他汀3α-羟基异构体、6-表普伐他汀和普伐他汀内酯。根据普伐他汀钠的合成工艺可以推测康哌他汀和康哌他汀钠为工艺杂质,双氢普伐他汀为工艺副产物,在各种降解试验中工艺杂质的含量均未显著增加。其中来源于厂家D的原料杂质个数与含量均高于其他来源原料,可能是由于晶型和工艺不同造成。各有关物质色谱峰与主峰分离效果良好,各杂质混合总离子流图见图 2。
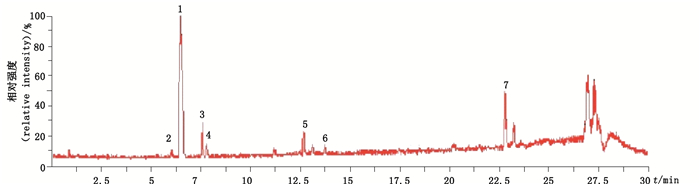
|
1.普伐他汀钠(pravastatin sodium)2. 6-表普伐他汀(6-epipravastatin)3.双氢普伐他汀(dihydropravastatin)4.普伐他汀3α-羟基异构体(3α-hydroxypravastatin)5.普伐他汀内酯(pravastatin lactone)6.康哌他汀钠(compactin sodium)7.康哌他汀(compactin) 图 2 各杂质混合总离子流图 Figure 2 TIC of sample with added impurities |
普伐他汀钠制剂在各种降解条件下,降解杂质出现情况与原料较为相似,主要的降解杂质为普伐他汀3α-羟基异构体、6-表普伐他汀和普伐他汀内酯。其余3个工艺杂质,在各降解条件下均未增加,说明上述3个工艺杂质在制剂中也无法降解产生,且制剂中的辅料未产生辅料峰干扰测定,在强制降解条件下也未与主成分反应生成新的杂质。不同来源的制剂杂质个数和水平相差较远,推测是由于各来源的制剂处方和工艺不同造成。其中来源于厂家G的普伐他汀钠片杂质含量远高于其他来源制剂中的杂质水平,主要的杂质为普伐他汀内酯。普伐他汀内酯易在酸性或高温条件下产生,推测当制剂在高温高湿条件下在二氧化碳影响下易降解产生,因此应在辅料中添加偏碱性辅料,并严格控制制剂贮藏温度,以增加普伐他汀钠的稳定性。
原料与制剂的供试品溶液采用LC-DAD法,并用0.1%自身对照法计算有关物质含量,结果见表 3。
|
|
表 3 样品中有关物质测定结果(%) Table 3 Related substances results of samples |
采用液相色谱质谱联用方法测定各有关物质分子离子峰,得到相对分子质量信息,测定各有关物质的二级质谱图,通过与普伐他汀二级质谱碎片离子的对比分析,推测各有关物质的结构,见表 4,普伐他汀钠及主要有关物质的二级质谱和裂解途径分析分别见图 3、4。
|
|
表 4 普伐他汀钠及其制剂有关物质信息列表 Table 4 Information of the related substances in pravastatin and its preparations |
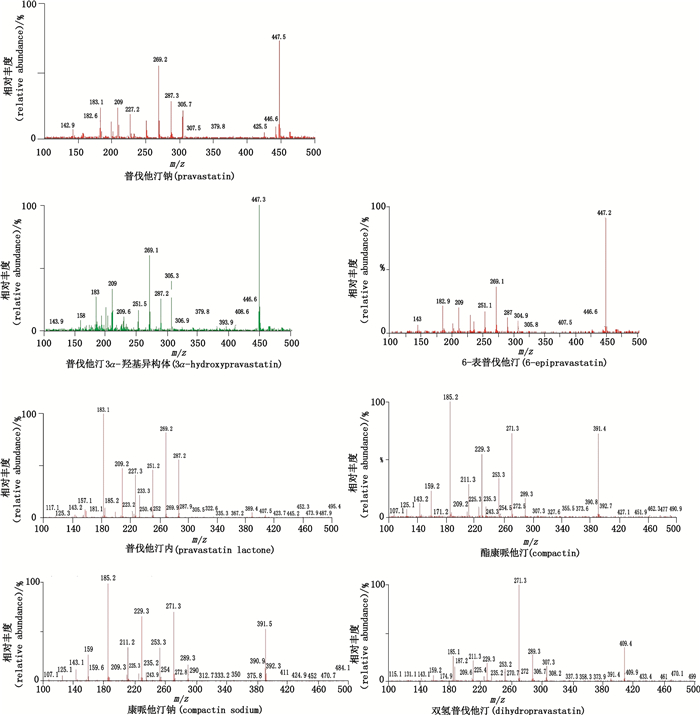
|
图 3 普伐他汀钠及其有关物质准分子离子峰的二级质谱图 Figure 3 MS/MS spectra of[M+H]+ ions of pravastatin sodium and its impurities |
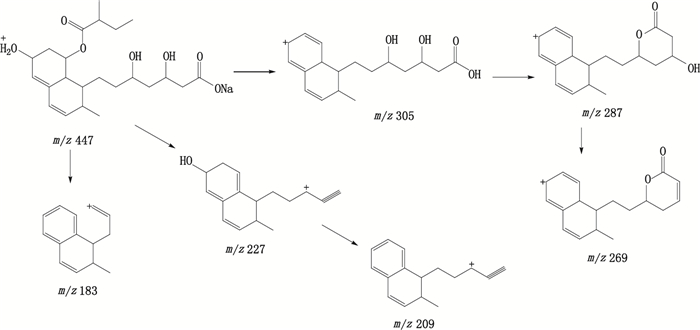
|
图 4 普伐他汀钠可能的裂解途径 Figure 4 Fragmentation pathway of pravastatin sodium |
保留时间为6.5 min,在ESI正离子化模式下,测得普伐他汀钠[M+H]+m/z为447.5,与离子组成C23H36NaO7+相应。普伐他汀钠[M+H]+MS/MS谱中主要碎片离子m/z分别为305.7、287.3、269.2、227.2、209.0、183.1,m/z 305为普伐他汀钠[M+H]+离子裂解脱去钠离子、一分子水和2-甲基丁酸酯侧链形成的[M+H-C5H11NaO3]+特征碎片离子,该离子继续脱去二羟基庚酸侧链上的一分子水环合形成m/z287的[M+H-C5H13NaO4]+碎片离子,进一步脱去庚酸钠侧链上的另一分子水形成m/z269的[M+H-C5H15NaO5]+碎片离子。m/z 227为普伐他汀钠[M+H]+离子裂解脱去2-甲基丁酸酯侧链和二羟基庚酸钠侧链上的羟基和羧酸部分形成的[M+H-C7H17NaO6]+特征碎片离子,其进一步脱去一分子水即得m/z209的[M+H-C7H19NaO7]+碎片离子。m/z183为普伐他汀钠[M+H]+离子裂解脱去2-甲基丁酸酯侧链和二羟基庚酸钠侧链上部分结构后形成的[M+H-C9H21NaO7]+特征碎片离子。推测裂解途径见图 4,普伐他汀钠的二级质谱分析对于解析确认其有关物质具有参考意义[10-12]。
3.2.2 普伐他汀3伐他羟基异构体保留时间为7.8 min,在ESI正离子化模式下,测得普伐他汀3α-羟基异构体[M+Na]+的m/z为447.3,与离子组成C23H36NaO7+相应。普伐他汀3α-羟基异构体[M+Na]+的MS/MS谱中主要碎片离子m/z分别为305.3、287.2、269.1、209.0、183.0,与普伐他汀钠MS/MS谱基本一致。普伐他汀3α-羟基异构体的结构式为普伐他汀钠的6-OH位置变更为3-OH,其余化学结构与普伐他汀一致,因此二者的二级质谱图基本一致,降解途径也基本一致[13]。
3.2.3 6-表普伐他汀保留时间为6.0 min,在ESI正离子化模式下,测得6-表普伐他汀[M+Na]+的m/z为447.2,与离子组成C23H36NaO7+相应。6-表普伐他汀[M+Na]+的MS/MS谱中主要碎片离子m/z分别为304.9、287.0、269.1、227.2、209.0、182.9,与普伐他汀钠MS/MS谱基本一致。6-表普伐他汀的结构式为普伐他汀钠的6-OH的空间构型发生变化,其余化学结构与普伐他汀一致,因此二者的二级质谱图基本一致,降解途径也基本一致。
对普伐他汀钠、普伐他汀3α-羟基异构体和6-表普伐他汀的紫外光谱图进行比较,3种成分均在238光谱图进处具有最大吸收,因此上述3种成分在光谱和质谱信息不具有明显差异,色谱信息差别较大,可通过3种成分的相对保留时间进行鉴别。
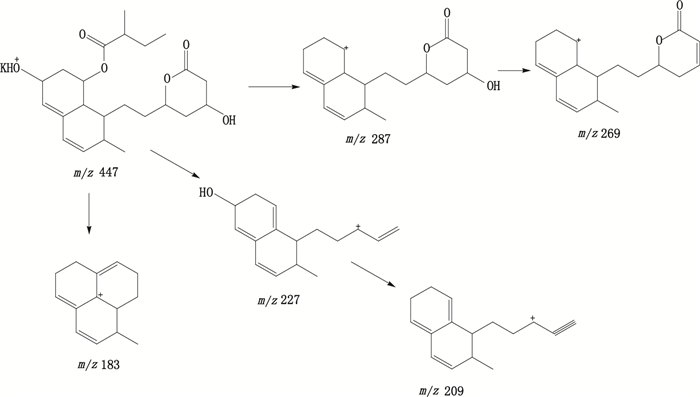
3.2.4 普伐他汀内酯保留时间为12.7 min,在ESI正离子化模式下,测得普伐他汀内酯[M+K]+的m/z为445.4,与离子组成C23H34KO6+相应。普伐他汀内酯[M+K]+的MS/MS谱中主要碎片离子m/z分别为287.2、269.2、227.3、209.2、183.1,m/z 287为普伐他汀内酯[M+K]+离子裂解脱去钾离子、6位羟基和2-甲基丁酸酯侧链形成的m/z 287的[M+K-C5H10KO3]+特征碎片离子,进一步脱去内酯侧链上的另一分子水形成m/z 269的[M+K-C5H12KO4]+碎片离子。m/z 227为普伐他汀内酯[M+K]+离子裂解脱去2-甲基丁酸酯侧链和内酯开环脱去羟基和羧酸部分形成的[M+K-C7H15KO5]+特征碎片离子,其进一步脱去一分子水即得m/z 209的[M+K-C7H17KO6]+碎片离子。m/z 183为普伐他汀内酯[M+H]+离子裂解脱去2-甲基丁酸酯侧链和内酯侧链上部分结构后形成的[M+K-C9H20O6]+特征碎片离子。推测裂解途径见图 5。
|
图 5 普伐他汀内酯可能的裂解途径 Figure 5 Fragmentation pathway of pravastatin lactone |
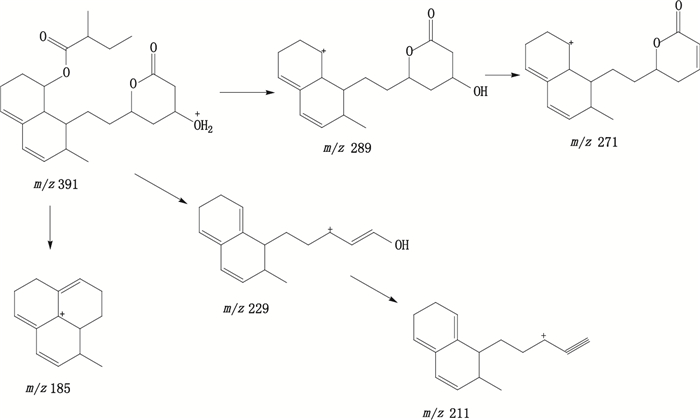
保留时间为22.8 min,在ESI正离子化模式下,测得康哌他汀[M+H]+的m/z为391.4,与离子组成C23H35O5+相应。康哌他汀[M+H]+的MS/MS谱中主要碎片离子m/z分别289.3、271.3、229.3、211.2、185.2,m/z 289为康哌他汀[M+H]+离子裂解2-甲基丁酸酯侧链形成的m/z 289的[M+H-C5H10O2]+特征碎片离子,进一步脱去内酯侧链上的另一分子水形成m/z 271的[M+H-C5H12O3]+碎片离子。m/z 229为康哌他汀[M+H]+离子裂解脱去2-甲基丁酸酯侧链和内酯开环脱去羟基和羧酸部分形成的[M+H-C7H14O4]+特征碎片离子,其进一步脱去一分子水即得m/z 211的[M+H-C7H16O5]+碎片离子。m/z 185为康哌他汀[M+H]+离子裂解脱去2-甲基丁酸酯侧链和内酯侧链上部分结构后环合形成的[M+H-C9H18O5]+特征碎片离子。推测裂解途径见图 6。
|
图 6 康哌他汀可能的裂解途径 Figure 6 Fragmentation pathway of compactin |
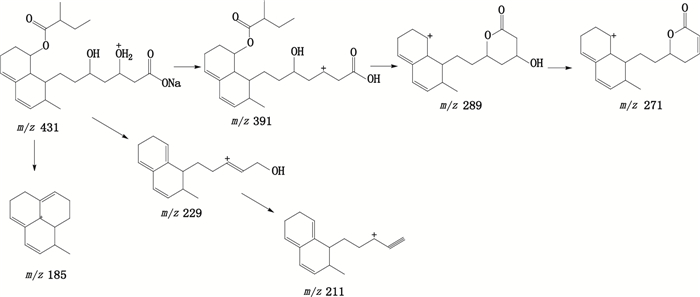
保留时间为13.8 min,在ESI正离子化模式下,测得康哌他汀钠[M+H]+的m/z为431.3,与离子组成C23H36NaO6+相应。康哌他汀钠[M+H]+的MS/MS谱中主要碎片离子m/z分别为391.5、289.3、271.3、229.3、211.3、185.2,m/z 391为康哌他汀钠裂解脱去钠离子和庚酸侧链上的一分子水的形成的特征碎片离子,进一步裂解脱去2-甲基丁酸酯侧链形成的[M+H-C5H11NaO3]+碎片离子,继而脱去一分子水即得m/z 271的[M+H-C5H13NaO4]+碎片离子。m/z 229为康哌他汀钠[M+H]+离子裂解脱去2-甲基丁酸酯侧链和庚酸侧链脱去羧酸部分形成的[M+H-C7H15NaO5]+特征碎片离子,其进一步脱去一分子水即得m/z 211的[M+H-C7H17NaO6]+碎片离子。m/z 185为康哌他汀钠[M+H]+离子裂解脱去2-甲基丁酸酯侧链和庚酸侧链上部分结构后环合形成的[M+H-C9H19NaO6]+特征碎片离子。推测裂解途径见图 7。
|
图 7 康哌他汀钠可能的裂解途径 Figure 7 Fragmentation pathway of compactin sodium |
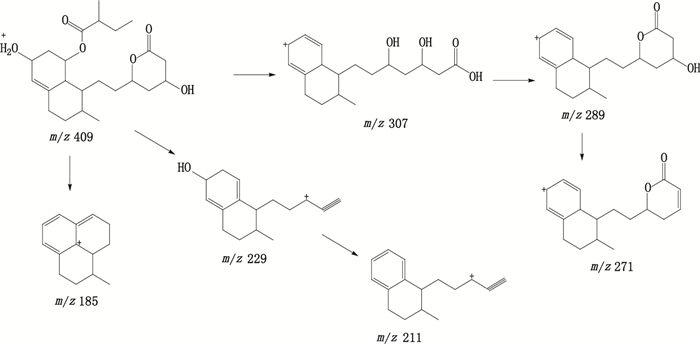
保留时间为7.5 min,在ESI正离子化模式下,测得双氢普伐他汀[M+H]+的m/z为409.2,与离子组成C23H37O6+相应。双氢普伐他汀[M+H]+的MS/MS谱中主要碎片离子m/z分别为307.3、289.3、271.3、229.3、211.3、185.1,m/z 307为双氢普伐他汀[M+H]+离子裂解脱去6位羟基和2-甲基丁酸酯侧链形成的[M+H-C5H10O2]+特征碎片离子,庚酸侧链环合成酯得到m/z 289的碎片离子,进一步失去一分子水后形成m/z 271[M+H-C5H14O4]+碎片离子。m/z 229为双氢普伐他汀[M+H]+离子裂解脱去2-甲基丁酸酯侧链和庚酸侧链失去羧酸部分形成的[M+H-C7H16O5]+特征碎片离子,进一步脱去一分子水即得m/z 211的[M+H-C7H18O6]+碎片离子。m/z 185为双氢普伐他汀[M+H]+离子裂解脱去6位羟基、2-甲基丁酸酯侧链和内酯侧链上部分结构后形成的[M+H-C9H20O6]+特征碎片离子。推测裂解途径见图 8。
|
图 8 双氢普伐他汀可能的裂解途径 Figure 8 Fragmentation pathway of dihydropravastatin |
采用LC-DAD法测定上述已知降解杂质的校正因子。根据“3.1“校正项下各杂质测定结果,普伐他汀3α-羟基异构体、6-表普伐他汀、普伐他汀内酯为含量较高,检出率较高的重要降解杂质,对上述3个降解杂质进行紫外光谱条件下的校正因子测定。由于普伐他汀钠具有较强引湿性,故采用普伐他汀四甲基丁胺对照品进行线性测定,普伐他汀钠与普伐他汀四甲基丁胺的换算因子为0.806 3,计算普伐他汀钠及其各杂质的线性方程,并计算各杂质校正因子。计算公式为:校正因子=各杂质斜率/普伐他汀钠斜率,测定结果见表 5。采用校正因子计算各来源的原料与制剂中的已知降解杂质含量,结果见表 6。当杂质含量较低时,自身对照法与校正因子法测定结果基本一致;当杂质含量较高时,由于部分杂质校正因子,自身对照法测定结果与校正因子法测定结果略有差异,校正因子法较能真实的反映样品中的杂质水平。
|
|
表 5 各杂质校正因子 Table 5 Correction factor of impurities by HPLC-DAD |
|
|
表 6 校正因子法测定已知杂质含量 Table 6 Specified impurities results of samples by correction factor method |
研究过程中色谱条件参考日本药局方17版普伐他汀钠有关物质项下[14],选用流动相为甲醇-水-三乙胺-冰醋酸(450:550:1:1),等度洗脱,检测波长为238 nm。但在试验过程中发现等度洗脱色谱条件无法洗脱出康哌他汀、康哌他汀钠等工艺杂质,故改用梯度洗脱色谱条件,可使各工艺杂质有效分离并被检出。
4.2 普伐他汀钠降解产物普伐他汀钠在酸中不稳定,易降解出多种杂质。推测普伐他汀钠制剂在胃中的酸性环境下会降解出诸多杂质。普伐他汀钠在酸中的主要降解产物为普伐他汀3α-羟基异构体、6-表普伐他汀和普伐他汀内酯3个降解产物,因此需要对不同企业生产原料及其制剂的降解产物进行定性定量分析,评价其有效性和安全性。来源于不同企业的普伐他汀钠原料及其制剂产生的降解产物比例具有一定差别,推测可能由生产工艺和处方不同造成,其中普伐他汀钠原料具有多晶型[15],可能对其稳定性造成影响。
4.3 杂质校正因子本研究明确区分了合成工艺杂质和降解杂质,总结了普伐他汀钠及其制剂中杂质产生的途径,并通过色谱相对保留时间和液质联用技术获得杂质的分子质量信息和碎片信息,辅助与文献数据对比,对部分杂质结构进行了推测,并储备了部分杂质的光谱、色谱和质谱数据。对原料和制剂中产生的各杂质进行了定性和定量。研究工作中测定了3个重要降解杂质的校正因子,均在0.8~1.2之间,故在杂质计算时可不加入校正因子,为普伐他汀钠原料及其制剂质量控制提供参考,以确保有效控制原料及制剂的质量。
| [1] |
TERRI MW, BRUCE AW, BRIAN W. Pitavastatin:a new HMG-CoA reductase inhibitor[J]. New Drug Appr, 2010, 44: 507. |
| [2] |
SIGURBJORNSSON S, KJARTANSDOTTIR T, JOHANNSSON M, et al. A pharmacokinetic evaluation of pravastatin in middle-aged and elderly volunteers[J]. Eur J Drug Metab Pharmacokinet, 1998, 23(1): 13. DOI:10.1007/BF03189821 |
| [3] |
KARIN O, CHRISTIAN M. Determination of pravastatin in human plasma by high-performance liquid chromatography with ultraviolet detection[J]. J Chromatogr B, 1998, 708(1-2): 235. DOI:10.1016/S0378-4347(97)00625-7 |
| [4] |
ZHANG X, DARIA IV, WANG XM, et al. Quantitative determination of pravastatin and its metabolite 3α-hydroxy pravastatin in plasma and urine of pregnant patients by LC-MS/MS[J]. Biomed Chromatogr, 2016, 30(4): 548. DOI:10.1002/bmc.v30.4 |
| [5] |
STEFFEN B, JESSICA M, ANGELA S, et al. Quantification of pravastatin in human plasma and urine after solid phase extraction using high performance liquid chromatography with ultraviolet detection[J]. J Chromatogry B, 2005, 818(2): 257. DOI:10.1016/j.jchromb.2005.01.006 |
| [6] |
LEON VH, KIM TG, STEVEN JL, et al. Quantification of pravastatin acid, lactone and isomers in human plasma by UHPLC-MS/MS and its application to a pediatric pharmacokinetic study[J]. J Chromatogr B, 2016, 1012: 169. |
| [7] |
NIROGI R, MUDIGONDA K, KANDIKERE V. Chromatography-mass spectrometry methods for the quantitation of statins in biological samples[J]. J Pharm Biomed Anal, 2007, 44(2): 379. DOI:10.1016/j.jpba.2007.02.008 |
| [8] |
邓鸣, 刘会臣, 薛洪源, 等. HPLC-MS法同时测定人血浆中普伐他汀及其主要代谢物3'α-异普伐他汀[J]. 药物分析杂志, 2005, 25(2): 160. DENG M, LIU HC, XUE HY, et al. Simultaneous determination of pravastatin and its main metabolite 3'α-isopravastatin in human plasma by HPLC-MS[J]. Chin J Pharm Anal, 2005, 25(2): 160. |
| [9] |
苏芳, 丁锐, 张蓉. 用梯度反相高效液相色谱法测定普伐他汀钠中的有关物质[J]. 药物分析杂志, 2006, 26(11): 1640. SU F, DING R, ZHANG R. RP-HPLC determination of related substances of pravastatin sodium with gradient elution[J]. Chin J Pharm Anal, 2006, 26(11): 1640. |
| [10] |
HANA V, MARTINA R, ALENA M, et al. Determination of pravastatin and pravastatin lactone in rat plasma and urine using UHPLC-MS/MS and microextraction by packed sorbent[J]. Talanta, 2012, 90(1): 22. |
| [11] |
KUMAR V, SHAH RP, SINGH S. LC and LC-MS methods for the investigation of polypills for the treatment of cardiovascular diseases.Part 1.Separation of active components and classification of their interaction/degradation products[J]. J Pharm Biomed Anal, 2008, 47(3): 508. DOI:10.1016/j.jpba.2008.01.041 |
| [12] |
JEMAL M, YUAN Q, WHIGAN DB. The use of high-flow high performance liquid chromatography coupled with positive and negative ion electrospray tandem mass spectrometry for quantitative bioanalysis via direct injection of the plasma/serum samples[J]. Rapid Commun Mass Spectrom, 1998, 12(19): 1389. DOI:10.1002/(ISSN)1097-0231 |
| [13] |
DANIEL M, MOHAMMED J, SABINE CP. Quantitative determination of pravastatin and its biotransformation products in human serum by turbo ion spray LC/MS/MS[J]. J Pharm Biomed Anal, 2000, 23(5): 851. DOI:10.1016/S0731-7085(00)00372-1 |
| [14] |
JP ⅩⅦ[S]. 2016: 1444
|
| [15] |
MARTINISLAN AP, CRUZADO MC, ASENSIO R, et al. Crystalline polymorphism and molecular structure of sodium pravastatin[J]. J Phys Chem B, 2006, 110(51): 26148. DOI:10.1021/jp0624449 |
 2018, Vol. 38
2018, Vol. 38 
