2. 齐齐哈尔市食品药品检验检测中心, 齐齐哈尔 161000
2. Qiqihaer Food and Drug Inspection Control, Qiqihar 161000, China
附子理中丸为常用中药制剂,由附子(制)、党参、白术(炒)、干姜、甘草(炙)5味中药组成,具有温中健脾的功效,用于脾胃虚寒、脘腹冷痛、呕吐泄泻、手足不温等症的治疗[1],历版《中华人民共和国药典》(以下简称《中国药典》)均有收载。现代临床研究表明,附子理中丸除主治脾胃虚寒所致的泄泻之外,还用于治疗心脑血管疾病、特发性水肿、顽咳、眩晕、腰痛等症[2]。由于该制剂中君药附子为毒性药材,其中所含的双酯型生物碱乌头碱、次乌头碱、新乌头碱等毒性很强,文献中亦有服用附子理中丸中毒的报道,表现为恶心、呕吐,心悸不安,语言不清等[3-5];附子药材经炮制加工后,此类成分可转化为单酯型生物碱,从而减小毒性[6]。在《中国药典》2015年版中,采用HPLC-UV法对附子药材中新乌头碱、次乌头碱和乌头碱等双酯型生物碱进行限量检查,对苯甲酰新乌头原碱、苯甲酰次乌头原碱、苯甲酰乌头原碱等单酯型生物碱进行含量测定,以保证药材质量和安全性。但中成药中处方药味较多,乌头类生物碱含量低,HPLC-UV法干扰较大。在《中国药典》2015年版一部附子理中丸项下,仅采用薄层色谱展开后目测比较斑点大小,对乌头碱进行限量检查,方法准确度差,更容易受到主观因素影响[7]。近年来,液相色谱-质谱联用法发展较快,在中药质量控制的应用也不断深入。有文献报道使用液相色谱-质谱联用法对中成药中乌头类成分进行测定[8],但由于仪器价格较贵,检测成本较高,难以适应日常检测的需要。相对于普通液相色谱质谱联用仪器,小型液相色谱质谱价格相对较低,操作简单,维护保养简便,使液相色谱质谱联用作为常规检测成为可能[9]。为加强含乌头附子类中成药的质量控制,本研究选用液相色谱仪与QDA小型质谱仪联用,同时测定单酯型和双酯型生物碱苯甲酰新乌头原碱、苯甲酰次乌头原碱、苯甲酰乌头原碱、新乌头碱、次乌头碱和乌头碱6个成分的含量。该方法灵敏度高,重复性好,实用性强,为附子理中丸的质量标准提高提供了新的手段。
1 仪器与试药Waters公司Alliance e2695-QDA液相色谱-质谱联用仪。
乌头碱(批号110720-201111,纯度98.8%)、次乌头碱(批号110798-201307,纯度98.4%)、新乌头碱(批号110799-201307,纯度98.3%)、苯甲酰乌头原碱(批号111794-201303,纯度98.8%)、苯甲酰次乌头原碱(批号111796-201303,纯度97.5%)、苯甲酰新乌头原碱(批号111795-201303,纯度96.3%)的对照品由中国食品药品检定研究院提供。附子理中丸样品3批(批号13011190、13013497、13012969)均为市售,购自北京同仁堂。乙腈为色谱纯试剂(默克公司),水为超纯水(Millipore Milli-Q系统),其他试剂均为分析纯(国药集团化学试剂有限公司)。
2 方法与结果 2.1 色谱及质谱条件采用Phenomenex Luna C18色谱柱(250 mm×4.6 mm,5 μm),以乙腈为流动相A,0.2%乙酸水溶液(用三乙胺调pH 6.2)为流动相B,梯度洗脱(0~44 min,21%A→31%A;44~65 min,31%A→35%A),流速1.0 mL·min-1,按照1:4分流进入质谱仪,柱温30 ℃,进样量10 μL;采用电喷雾离子源(ESI源),正离子检测,选择性离子监测(SIM),毛细管电压1.4 kV,离子源温度600 ℃,锥孔电压15 V,以m/z 574.0(苯甲酰次乌头原碱)、m/z 590.0(苯甲酰新乌头原碱)、m/z 604.0(苯甲酰乌头原碱)和m/z 616.0(次乌头碱)、m/z 632.0(新乌头碱)、m/z 646.0(乌头碱)为测定离子。
2.2 混合对照品溶液的制备精密称取对照品苯甲酰次乌头原碱10.05 mg,苯甲酰新乌头原碱10.35 mg,苯甲酰乌头原碱10.19 mg,次乌头碱9.96 mg,新乌头碱10.12 mg及乌头碱10.40 mg,置同一100 mL量瓶中,加0.01%盐酸甲醇溶液溶解并稀释至刻度,摇匀;精密量取25 mL,置50 mL量瓶中,加0.01%盐酸甲醇溶液稀释至刻度,摇匀,滤过,制成6个成分质量浓度分别为50.25、51.75、50.95、49.80、50.60和52.00 μg·mL-1的混合对照品溶液。
2.3 供试品溶液的制备取附子理中丸(大蜜丸)适量,剪碎,精密称定,精密加入等量硅藻土粉碎,取粉末约9 g,精密称定,置具塞锥形瓶中,加氨试液4 mL,精密加入异丙醇-乙酸乙酯(1:1)50 mL,称量,超声处理(功率300 W,频率40 kHz,水温在25 ℃以下)30 min,放冷,再称量,用异丙醇-乙酸乙酯(1:1)补足减失的量,摇匀,滤过;精密量取续滤液25 mL,40 ℃以下减压回收溶剂至干,残渣精密加入0.01%盐酸甲醇溶液3 mL溶解,用0.45 μm微孔滤膜(尼龙)滤过,即得。
2.4 阴性样品溶液的制备按附子理中丸处方称取缺附子(制)的其他成分,按制备工艺制成缺附子(制)的阴性样品,按“2.3”项下方法制成缺附子(制)的阴性样品溶液。
2.5 专属性考察分别精密吸取混合对照品溶液、供试品溶液和阴性样品溶液各10 μL,注入液相色谱-质谱联用仪进行测定,记录色谱图。样品色谱图中出现与对照品色谱图中保留时间一致的色谱峰,缺附子的阴性样品对测定无干扰。色谱图及质谱图见图 1、2。
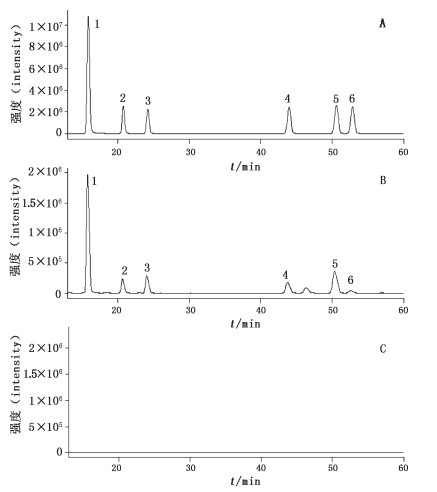
|
1.苯甲酰新乌头原碱(benzoylmesaconitine)2.苯甲酰乌头原碱(benzoylaconitine)3.苯甲酰次乌头原碱(benzoylhypaconitine)4.新乌头碱(mesaconitine)5.次乌头碱(hypaconitine)6.乌头碱(aconitine) A.混合对照品(mixed reference substances)B.样品(sample)C.阴性样品(negative sample without Aconiti Lateralis Radix Praeparata) 图 1 SIM色谱图 Figure 1 SIM chromatograms |
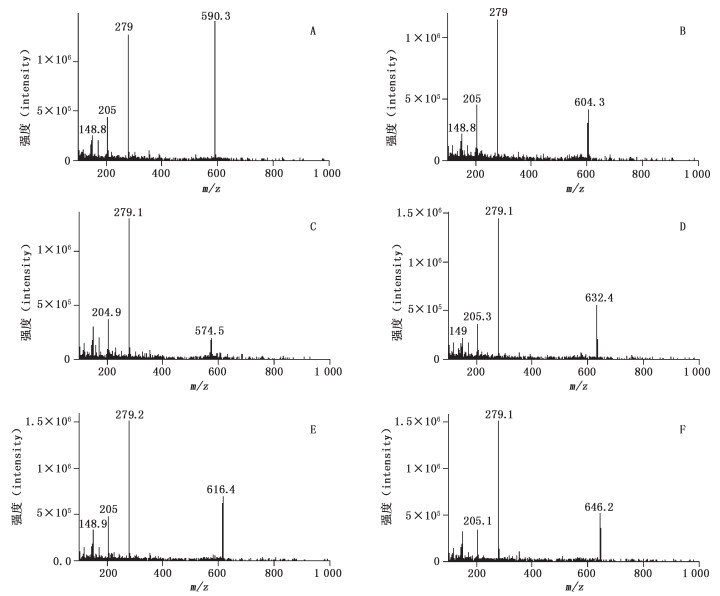
|
A.苯甲酰新乌头原碱(benzoylmesaconitine)B.苯甲酰乌头原碱(benzoylaconitine)C.苯甲酰次乌头原碱(benzoylhypaconitine)D.新乌头碱(mesaconitine)E.次乌头碱(hypaconitine)F.乌头碱(aconitine) 图 2 6个生物碱的质谱图 Figure 2 Mass spectra of six alkaloids |
将混合对照品储备液逐级稀释10倍、100倍、1 000倍、10 000倍及250 000倍,制成6个成分质量浓度范围为0.000 2~50 μg·mL-1的6个混合对照品溶液;分别精密吸取不同浓度的混合对照品溶液各10 μL,注入液-质联用仪进行测定;以峰面积积分值Y为纵坐标,对照品质量浓度X(μg·mL-1)为横坐标,绘制标准曲线(n=6),进行线性回归,得苯甲酰次乌头原碱、苯甲酰新乌头原碱、苯甲酰乌头原碱、次乌头碱、新乌头碱及乌头碱回归方程分别为:
| $ \begin{array}{l} Y{\rm{ = 8}}{\rm{.361}} \times {10^4}X - 9.996 \times {10^4}\;\;r = 0.9998\\ Y{\rm{ = 8}}{\rm{.717}} \times {10^6}X - 4.386 \times {10^6}\;\;r = 0.9992\\ Y{\rm{ = 1}}{\rm{.013}} \times {10^6}X - 1.678 \times {10^4}\;\;r = 0.9995\\ Y{\rm{ = 1}}{\rm{.522}} \times {10^6}X - 6.099 \times {10^4}\;\;r = 0.9999\\ Y{\rm{ = 1}}{\rm{.565}} \times {10^6}X - 7.426 \times {10^4}\;\;r = 0.9995\\ Y{\rm{ = 9}}{\rm{.434}} \times {10^4}X - 2.990 \times {10^4}\;\;r = 0.9997 \end{array} $ |
线性范围分别为0.000 2~50.25、0.000 2~ 51.75、0.000 2~50.95、0.000 2~49.80、0.000 2~50.60和0.000 2~52.00 μg·mL-1。
2.7 检测下限及定量下限测定精密吸取质量浓度为0.000 2 μg·mL-1的混合对照品溶液适量,以0.01%盐酸甲醇溶液逐级稀释,在选定的色谱条件下进样测定,按信噪比3:1计算,测得苯甲酰次乌头原碱、苯甲酰新乌头原碱、苯甲酰乌头原碱、次乌头碱、新乌头碱及乌头碱的检测下限均为0.000 02 μg·mL-1;按信噪比10:1计算,测得上述6个化合物的定量下限均为0.000 08 μg·mL-1。
2.8 精密度试验精密吸取质量浓度为5 μg·mL-1的混合对照品溶液10 μL,连续进样6次,测得苯甲酰次乌头原碱、苯甲酰新乌头原碱、苯甲酰乌头原碱、次乌头碱、新乌头碱及乌头碱峰面积积分值的RSD分别为2.3%、1.9%、2.4%、2.6%、2.2%和2.5%。结果表明仪器精密度良好。
2.9 重复性试验取附子理中丸(大蜜丸13011190),按“2.3”项下方法平行制备6份供试品溶液,按上述色谱条件进行测定并计算;结果苯甲酰次乌头原碱、苯甲酰新乌头原碱、苯甲酰乌头原碱、次乌头碱、新乌头碱及乌头碱平均含量分别为1.034、7.231、0.621、1.556、1.368和0.163 μg·g-1,RSD分别为2.7%、2.1%、3.0%、2.5%、2.8%和4.5%。表明重复性良好。
2.10 稳定性试验取附子理中丸(大蜜丸13011190)的供试品溶液室温放置,分别于制备后0、4、8、12、16、20、24 h进样测定,记录峰面积积分值;结果6个生物碱成分苯甲酰次乌头原碱、苯甲酰新乌头原碱、苯甲酰乌头原碱、次乌头碱、新乌头碱及乌头碱峰面积积分值的RSD分别为2.4%、2.3%、2.7%、2.5%、2.6%和2.9%,表明供试品溶液在24 h内稳定。
2.11 加样回收率试验精密称取6份已加等量硅藻土粉碎,并已测知含量的附子理中丸(大蜜丸13011190)粉末4.5 g,置具塞锥形瓶中,精密加入苯甲酰次乌头原碱、苯甲酰新乌头原碱、苯甲酰乌头原碱、次乌头碱、新乌头碱及乌头碱质量浓度分别为20.70、10.19、15.28、24.90、25.30和5.20 μg·mL-1的混合对照品溶液1.0 mL,蒸干后,按“2.3”项下方法制备供试溶液;按上述色谱条件进样测定并计算,结果6个生物碱成分苯甲酰次乌头原碱、苯甲酰新乌头原碱、苯甲酰乌头原碱、次乌头碱、新乌头碱及乌头碱平均回收率分别为98.2%、101.8%、101.3%、104.8%、99.9%和89.9%,其RSD分别为2.7%、6.4%、2.6%、6.1%、3.8%和5.7%。表明本方法回收率较好。
2.12 样品含量测定精密称取3批附子理中丸(大蜜丸)样品各2份,分别按“2.3”项下方法制备供试品溶液,分别按“2.1”项下的条件进样测定,以外标法计算样品含量,结果见表 1。苯甲酰新乌头原碱、苯甲酰次乌头原碱、苯甲酰乌头原碱、新乌头碱、次乌头碱和乌头碱的含量分别在7.095~7.366、1.007~1.214、0.594~0.742、1.261~1.438、1.492~1.578和0.135~0.163 μg·g-1之间。
|
|
表 1 样品含量测定结果 Table 1 Results of sample determination |
附子理中丸处方中君药为附子(制),其为毒性药材,主要含单酯型生物碱苯甲酰新乌头原碱、苯甲酰次乌头原碱、苯甲酰乌头原碱和双酯型生物碱新乌头碱、次乌头碱及乌头碱,既是有效成分又是毒性成分,其中双酯型生物碱毒性较强[6],应对其含量进行控制。参照《中国药典》2015年版一部附子药材及炮制品项下对上述6个生物碱成分进行含量测定和限量检查[1],本试验对附子理中丸中6个生物碱成分进行检测具有实际意义。
3.2 附子理中丸中乌头生物碱成分质控方法附子理中丸收载于《中国药典》2015年版一部,现行质量标准采用薄层色谱法对乌头碱进行限量检查,以甘草苷作为含量测定指标,未对君药附子(制)中的单酯及双酯型生物碱成分进行含量测定,难以有效控制附子理中丸的安全性和有效性。目前已有4篇文献报道了附子理中丸中生物碱成分含量测定的方法[10-13],即HPLC法测定附子理中丸中乌头碱的含量,HPLC法测定附子理中丸中3个单酯型生物碱含量及HPLC-MS法测定附子理中丸中3个双酯型生物碱含量。附子理中丸中成分复杂,乌头类生物碱含量较低,使用紫外检测器进行检测时,干扰较大。使用质谱仪进行检测的文献也仅针对3个双酯型乌头碱类成分进行测定,难以全面控制附子理中丸的质量。从文献报道来看,部分市售附子理中丸中只检测到双酯型生物碱或单酯型生物碱成分,表明附子原料在炮制加工过程中可能存在炮制不充分或炮制太过的情况,从而影响临床用药的安全性和有效性[10-15]。本文所选用的样品均来自同仁堂,使用测定结果折算其附子原料药中生物碱类含量均符合《中国药典》规定,表明其原料药质量可靠,同时也证明本文所建立的方法稳定可靠,可为保证制剂的安全性和有效性提供技术保障。
3.3 小型质谱仪在中成药质控中的应用近年来质谱检测器在中药质量控制中的应用越来越多,质谱检测具有选择性强及灵敏度高的特点,适用于微量成分分析。本文所用QDA质谱仪为单四极杆小型质谱仪,该仪器操作简便,购置和使用成本较低。除此型号外,市场上还可见到多种其他型号的小型质谱仪。随着此类仪器的不断发展和完善,质谱仪作为HPLC的普通检测器进入日常检测将成为可能。与目前常用的HPLC-UV和HPLC-ELSD法相比,HPLC-MS法具有灵敏度高及专属性强等优点,可满足药物质量控制的需要。本研究所建立的方法,为此类仪器在含毒性药材的中成药质量控制中的应用进行了有益的探索。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 1013 ChP 2015. Vol Ⅰ[S]. 2015: 1013 |
| [2] |
马光明. 附子理中丸治疗特发性水肿[J]. 医药论坛杂志, 2007, 28(3): 104. MA GM. Treatment of idiopathic edema with Fuzi Lizhong pills[J]. J Med Forum, 2007, 28(3): 104. |
| [3] |
张向力, 张丽萍, 王晓霞. 附子理中丸中毒致心律失常一例[J]. 中国中医药信息杂志, 1996, 3(4): 37. ZHANG XL, ZHANG LP, WANG XX. One case of arrhythmia caused by Fuzi Lizhong pills[J]. Chin J Inf Tradit Chin Med, 1996, 3(4): 37. |
| [4] |
王建凯, 刘国良. 附子理中丸致中毒反应2例报道[J]. 实用中医药杂志, 2001, 17(1): 43. WANG JK, LIU GL. Report of two cases about the toxic reaction of Fuzi Lizhong pills[J]. J Pract Tradit Chin Med, 2001, 17(1): 43. |
| [5] |
张庆辉. 附子理中丸中毒致心律失常1例[J]. 临床荟萃, 2010, 25(23): 2082. ZHANG QH. A case report about the arrhythmia caused by Fuzi Lizhong pills[J]. Clin Focus, 2010, 25(23): 2082. |
| [6] |
聂黎行, 张聿梅, 鲁静, 等. 附子和附片质量标准研究[J]. 中国药学杂志, 2010, 45(15): 1182. NIE LX, ZHANG YM, LU J, et al. Study on quality standard of Fuzi and Fupian[J]. Chin Pharm J, 2010, 45(15): 1182. |
| [7] |
刘小鸣, 张振凌, 梁君, 等. 《国家中成药标准汇编》中含乌头碱类中药制剂质量标准的分析[J]. 中国实验方剂学杂志, 2015, 21(8): 230. LIU XM, ZHANG ZL, LIANG J, et al. Analysis quality standards of Chinese drug preparations that contain aconitine in Compilation of National Standard for Traditional Chinese Medicines[J]. Chin J Exp Tradit Med Form, 2015, 21(8): 230. |
| [8] |
王勇, 邓晓春, 夏博. 三种中成药中乌头生物碱飞行时间质谱分析[J]. 深圳大学学报(理工版), 2009, 26(3): 257. WANG Y, DENG XC, XIA B. Analysis of Aconitum alkaloids in three kinds of proprietary Chinese medicines by MALDI-TOF mass spectrometry[J]. J Shenzhen Univ Sci Eng, 2009, 26(3): 257. |
| [9] |
周超, 张聿梅, 何轶, 等. HPLC-MS法同时测定益母草及其颗粒剂中盐酸水苏碱与盐酸益母草碱的含量[J]. 药物分析杂志, 2016, 36(5): 830. ZHOU C, ZHANG YM, HE Y, et al. Simultaneous content determination of stachydrine hydrochloride and leonurine hydrochloride in Herba Leonuri and Yimucao granules by HPLC-MS[J]. Chin J Pharm Anal, 2016, 36(5): 830. |
| [10] |
朱瑞龙, 景明, 柴国林, 等. HPLC测定附子理中丸中双酯型乌头碱含量[J]. 中成药, 1996, 18(10): 13. ZHU RL, JING M, CHAI GL, et al. Determination of diester aconitine in Fuzi Lizhong pills by HPLC[J]. Chin Tradit Pat Med, 1996, 18(10): 13. |
| [11] |
钟碧华, 陆帅. HPLC法测定附子理中丸中乌头碱的含量[J]. 海峡药学, 2014, 26(11): 115. ZHONG BH, LU S. Determination of aconitine in Fuzi Lizhong pills by HPLC[J]. Strait Pharm J, 2014, 26(11): 115. DOI:10.3969/j.issn.1006-3765.2014.11.047 |
| [12] |
邵峰, 俞瑜, 任刚, 等. HPLC同时测定附子理中丸中3种单酯型生物碱含量[J]. 中国实验方剂学杂志, 2012, 18(16): 58. SHAO F, YU Y, REN G, et al. Simultaneous determination of benzoylmesaconitine, benzoylaconitine and benzoylhypaconitine in Fuzi Lizhong pills by HPLC[J]. Chin J Exp Tradit Med Form, 2012, 18(16): 58. |
| [13] |
索志荣, 徐敏, 秦海燕, 等. LC-MS测定附子理中丸中3种双酯型生物碱含量[J]. 药物分析杂志, 2010, 30(12): 2279. SUO ZR, XU M, QIN HY, et al. LC-MS determination of three diester diterpenoid alkaloids in Fuzi Lizhong pills[J]. Chin J Pharm Anal, 2010, 30(12): 2279. |
| [14] |
刘岚, 范智超, 张志琪. HPLC同时测定成药中4种乌头类生物碱含量[J]. 药物分析杂志, 2010, 30(2): 236. LIU L, FAN ZC, ZHANG ZQ. HPLC simultaneous determination of four aconitine alkaloids in patent medicine[J]. Chin J Pharm Anal, 2010, 30(2): 236. |
| [15] |
张盼盼, 魏文跃, 李岑, 等. 附子理中丸中乌头碱类毒性成分的富集及检测[J]. 华西药学杂志, 2012, 27(5): 563. ZHANG PP, WEI WY, LI C, et al. Enrichment and detection of aconitine-type toxic composition in Fuzi Lizhong pills[J]. West China J Pharm Sci, 2012, 27(5): 563. |
 2018, Vol. 38
2018, Vol. 38 
