鹿瓜多肽是由鹿科动物梅花鹿的骨骼和葫芦科植物甜瓜的干燥成熟种子,经分别提取后制成的灭菌水溶液[1];适用于风湿、类风湿性关节炎、骨折的早期愈合、骨关节炎、腰腿疼痛及创伤恢复等[2-5]。鹿瓜多肽主要含有骨诱导多肽、甜南瓜肽、游离氨基酸和多种有机钙、磷等元素,其中骨诱导多肽能有效促进人体骨形态发生蛋白、转化生长因子β、成纤维细胞生长因子等影响骨形成和骨吸收衍生生长因子的合成,参与骨代谢的调节,在促进新骨形成的同时,抑制骨的吸收,从而增加骨质疏松症患者的骨密度[6]。
目前仅1家鹿瓜多肽国家注册标准采用大鼠骨折模型评价其炎症愈合作用。本文研究建立了一种基于骨细胞株的鹿瓜多肽体外活性测定方法,并用该方法分别对2个厂家生产的鹿瓜多肽注射液和注射用鹿瓜多肽进行了活性测定。
1 仪器和材料Thermo Series 8000WT型CO2培养箱,MD M5e酶标仪,Labconco Free Zone®型冻干机。
3个细胞株(大鼠骨肉瘤UMR106细胞株、小鼠颅顶前骨MC3T3-E1细胞株、人SV40转染成骨细胞株)均购至中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
含谷氨酰胺的DMEM高糖培养液(厂家:Gibco;货号:12800-017)、不含谷氨酰胺的DMEM高糖培养液(厂家:Gibco;货号:10313-021)、MEM培养液(厂家:Gibco;货号:11900024)、MEM/F12培养液(厂家:Gibco;货号:12400024),4 ℃保存。
完全培养液:量取胎牛血清(FBS)10 mL,加含谷氨酰胺的DMEM高糖培养液90 mL,混匀,4 ℃保存。
维持培养液:量取胎牛血清(FBS)1 mL,加不含谷氨酰胺的DMEM高糖培养液99 mL,混匀,4 ℃保存。
样品稀释液:本试验探讨了3种样品稀释液对试验结果的影响。样品稀释液1:含10%FBS的无谷氨酰胺DMEM培养液;样品稀释液2:含1%FBS的无谷氨酰胺DMEM培养液;样品稀释液3:含10%FBS的含谷氨酰胺DMEM培养液。
磷酸盐缓冲液(DPBS)(厂家:Gibco;货号:14190-144)。
胰蛋白酶(厂家:Gibco;货号:25200-056)。
CCK-8试剂盒(同仁化学研究所,货号CK04),4 ℃保存。
本研究选用了2个厂家生产的样品,分别是厂家A生产的鹿瓜多肽注射液(批号:20160115;规格:2 mL:4 mg),厂家B生产的注射用鹿瓜多肽(批号:1501217;规格:8 mg·支-1)。
2 方法 2.1 细胞株的培养大鼠骨肉瘤UMR106细胞株用完全培养液,小鼠颅顶前骨MC3T3-E1细胞株用含10%FBS的MEM培养液,人SV40转染成骨细胞株用含10%FBS的MEM/F12培养液于37 ℃、5%CO2的培养箱内进行培养。选择细胞状态良好,处于对数生长期的细胞进行试验。
2.2 鹿瓜多肽活性测定方法简介选用处于对数生长期的骨细胞株,制备一定密度的细胞悬液,每孔100 μL接种于96孔细胞培养板。待细胞贴壁后,加入不同浓度的鹿瓜多肽溶液,培养一定时间,CCK-8显色,测定加药组溶液吸收值。同时以样品稀释液代替药物溶液,进行试验,作为阴性对照组。
2.3 实验分组实验分2组:阴性对照组(不加样品溶液,加入同体积的稀释液)和加药组(加入不同浓度的样品溶液),以不加细胞的孔作为空白对照。
2.4 样品溶液的配制将鹿瓜多肽注射液(质量浓度为2 mg·mL-1)冷冻后,用冻干机进行冻干,用样品稀释液复溶,并配制成4、2、1、0.5、0.25、0.12、0.06、0.03、0.015和0.008 mg·mL-1的鹿瓜多肽注射液的样品溶液。
取注射用鹿瓜多肽1支,加样品稀释液1 mL复溶样品,制成8 mg·mL-1的溶液,再用样品稀释液配制成4、2、1、0.5、0.25、0.12、0.06、0.03、0.015和0.008 mg·mL-1的注射用鹿瓜多肽的样品溶液。
2.5 结果计算按(加药组溶液吸收值-空白吸收值)/(阴性对照组吸收值-空白吸收值)计算刺激指数(SI),以刺激指数的大小评价鹿瓜多肽促骨细胞增长的活性。
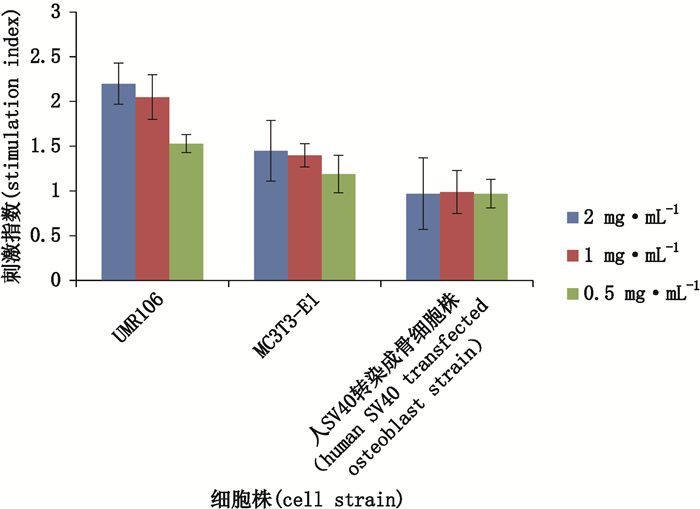
3 结果 3.1 关键试验参数的筛选 3.1.1 适合本试验细胞株的筛选选用3种骨细胞株,大鼠骨肉瘤UMR106细胞株、小鼠颅顶前骨MC3T3-E1细胞株和人SV40转染成骨细胞株,按“2.2”项方法进行试验,接种细胞密度为2×104个·mL-1,分别用含1% FBS含谷氨酰胺的DMEM培养液、MEM培养液和MEM/F12培养液配制质量浓度为2、1和0.5 mg·mL-1的样品溶液,作用细胞3 d。样品溶液对3种细胞株的刺激指数测定结果见表 1;结果表明鹿瓜多肽注射液对UMR106细胞和MC3T3-E1细胞株的增殖促进作用较注射用鹿瓜多肽明显,2种样品溶液对人SV40转染成骨细胞无增殖促进作用。因鹿瓜多肽注射液对骨细胞有增殖促进作用,故对其测定结果做图(见图 1),图 1表明鹿瓜多肽注射液对UMR106细胞的增殖促进作用最明显(刺激指数SI > 2.0),对MC3T3-E1细胞有轻微的促增殖作用(刺激指数SI为1.5~2.0),对人SV40转染成骨细胞无增殖促进作用(刺激指数SI < 1.5),注射用鹿瓜多肽对3种骨细胞株均无增殖促进作用,但对UMR106细胞株的刺激指数大于MC3T3-E1和人SV40转染成骨细胞株。以上结果表明:鹿瓜多肽对大鼠骨肉瘤UMR106细胞株增殖促进作用最明显,可选用该细胞株作为该方法的试验对象。
|
|
表 1 鹿瓜多肽对不同骨细胞株的增殖促进作用比较(n=3) Table 1 The comparison of the proliferation activity of Cervus and Cucumis polypeptide on different bone cell strains |
|
图 1 鹿瓜多肽注射液对3种骨细胞株的增殖促进作用比较 Figure 1 The comparison of the proliferation activity of Cervus and Cucumis polypeptide injection on three bone cell strains |
对该方法细胞密度和作用时间进行探讨。配制8×104、4×104和2×104个·mL-1密度的细胞悬液,选用鹿瓜多肽注射液系列浓度进行试验,样品稀释液为UMR106细胞株的完全培养液,分别作用UMR106细胞株1、2和3 d,观察不同密度,不同作用时间细胞的刺激指数。选择促进细胞增殖最明显的鹿瓜多肽样品溶液浓度,计算刺激指数;结果(见表 2)表明鹿瓜多肽质量浓度在0.06~4 mg·mL-1范围内,在2×104个·mL-1细胞密度悬液时,样品溶液作用细胞3 d对细胞的增殖促进作用较明显。故选择2×104个·mL-1细胞密度,样品溶液作用细胞3 d进行试验。但如何提高样品溶液对细胞的刺激指数,也是后续需解决的问题。
|
|
表 2 细胞密度和作用时间对试验结果的影响 Table 2 The effects of cell density and incubation time on the results |
为了提高鹿瓜多肽对UMR106细胞的刺激指数,探讨稀释液对试验结果的影响。配制含3种样品稀释液(稀释液1,稀释液2和稀释液3,),用3种稀释液配制2×104个·mL-1的UMR106细胞株悬液,1 mg·mL-1的鹿瓜多肽注射液样品溶液作用细胞3 d,按“2.2”方法进行试验,计算不同稀释液试验时样品对细胞株的刺激指数,结果见表 3,该结果提示使用稀释液2即含1%FBS的无谷氨酰胺培养液,能得到较理想的结果。
|
|
表 3 不同稀释液对试验结果的影响(n=3) Table 3 The effects of dilute solution on the results |
经过以上试验,确定了适合该试验的参数,选用UMR106细胞株,试验稀释液为含1%FBS的无谷氨酰胺培养液,即维持培养液,细胞密度为2×104个·mL-1,样品溶液作用细胞3 d,CCK-8细胞染色,计算刺激指数。
3.3 试验方法的验证及应用对该方法的线性和重复性进行了验证。
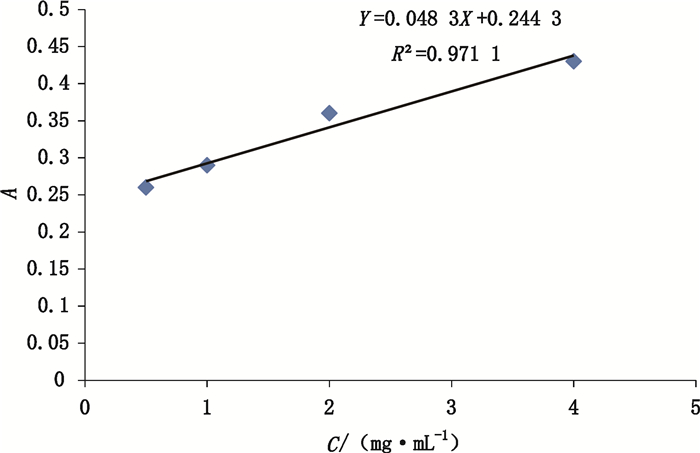
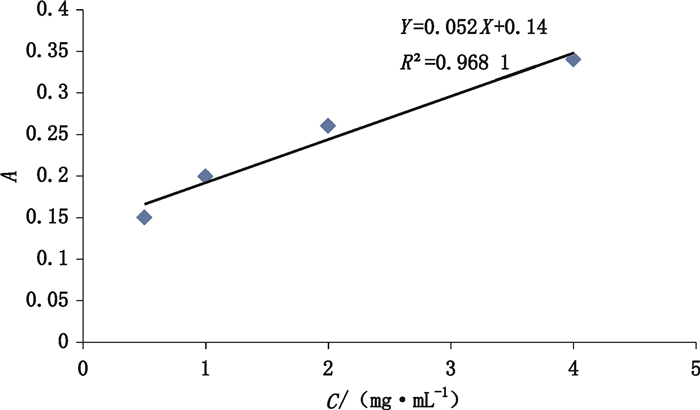
将鹿瓜多肽注射液进行冻干,同时取注射用鹿瓜多肽1支,用维持培养液分别配制鹿瓜多肽质量浓度为4、2、1、0.5、0.25、0.125、0.06、0.03和0.015 mg·mL-1的样品溶液,进行试验。以鹿瓜多肽质量浓度为横坐标,以吸收值A为纵标准进行线性拟合(见图 2和3)。3次试验结果表明鹿瓜多肽质量浓度在4~0.5 mg·mL-1范围内,浓度和A值呈现较好的线性关系,R2分别为0.971和0.968,表明该方法线性良好。
|
图 2 鹿瓜多肽注射液样品浓度和A值之间线性关系图谱 Figure 2 The linearity between the concentration of Cervus and Cucumis polypeptide injection and A value |
|
图 3 注射用鹿瓜多肽样品浓度和A值之间线性关系图谱 Figure 3 The linearity between the concentration of injection for Cervus and Cucumis polypeptide and A value |
选择以上对细胞增殖最明显的鹿瓜多肽质量浓度计算其刺激指数,鹿瓜多肽注射液在2 mg·mL-1时对细胞的增殖刺激作用最明显,注射用鹿瓜多肽在4 mg·mL-1时对细胞的增殖刺激作用最明显。3次试验刺激指数及其RSD见表 4,表明2种样品3次试验结果的RSD均低于10%,不同厂家的样品对细胞增殖刺激作用不同。
|
|
表 4 样品测定结果及方法的重复性 Table 4 Detection results of samples and the reproducibility of the methods |
鹿瓜多肽为从动植物中提取的多组分生化药,在临床上可有效促进患者骨折愈合[7-8]。目前的质量标准较简单,缺乏相应的促骨细胞增殖指标。本研究建立了一种新的鹿瓜多肽促骨细胞增殖评价方法,该方法选用大鼠骨肉瘤UMR106细胞株作为试验对象,该细胞株体外培养较容易,也较易获得,有益于该方法的推广应用。
本试验探讨了关键参数对试验结果的影响。其中,稀释液的选择是本试验研究的关键。研究表明:用含10%FBS含谷氨酰胺的培养液进行试验时,鹿瓜多肽对细胞的增殖促进作用并不明显,但用含1%FBS不含谷氨酰胺的培养液进行试验时,鹿瓜多肽对细胞的增殖促进作用较明显。因FBS和谷氨酰胺均是促细胞增殖的物质,它们对细胞的增殖促进作用掩盖了鹿瓜多肽对细胞的增殖促进作用,故需用含1%FBS不含谷氨酰胺的培养液进行试验。这和之前对肝水解肽体外活性测定方法研究的结果[9]一致。
刺激指数是评价细胞增殖活性的一个指标[10-11]。行业内认为,刺激指数大于4,表明对细胞有明显增殖促进作用;大于2,表明对细胞有增殖促进作用;在1.5~2.0之间对细胞有轻微的增殖促进作用;小于1.5对细胞无增殖促进作用。本试验结果表明鹿瓜多肽注射液对大鼠骨肉瘤UMR-106细胞株有增殖促进作用。
岳云飞等[12]研究报告了四甲基噻唑蓝(MTT)法测定注射用鹿瓜多肽活性的方法。该方法选用的细胞模型为人成骨肉瘤MG-63细胞株,培养时间为96 h,显色方法为MTT法,样品对细胞的刺激指数最高达2.5。本文建立的方法选用大鼠骨肉瘤UMR106细胞株,试验时间为72 h,显色方法为CCK-8显色,样品对细胞的增殖刺激作用最大可达2.97。而且,本研究还进行了线性和重复性验证,结果表明该方法线性和重复性均良好。和报道的MTT法[12]进行比较,本文建立的试验方法的试验时间更短,选用的细胞株对鹿瓜多肽刺激更敏感。试验染色剂为CCK-8,是MTT的一种升级替代产品,其测定原理和MTT法相似,但测定时不需要有机溶剂DMSO对染料进行溶解,操作更安全方便,测定结果更稳定[13-15],因此,本文建立的试验方法明显优于MTT法,该方法操作简单,实验重复性好,为该类产品质量控制提供了方法学依据。
该方法初步用于不同厂家鹿瓜多肽促骨细胞增殖活性的比较,发现不同厂家的产品促骨细胞增殖活性差异较大,故应扩大该方法在不同厂家不同批次产品促骨细胞增殖的应用研究,为该产品促骨细胞增殖活性限度的制定提供依据。
| [1] |
彭昊, 汪喆, 李章华, 等. 鹿瓜多肽注射液促进骨折愈合过程中血管内皮生长因子表达的机制[J]. 中国临床康复, 2006, 10(37): 81. PENG H, WANG Z, LI ZH, et al. Mechanism of Cervus and Cucumis polypeptide injection in promoting the expression of vascular endothelial growth factor in the fracture healing[J]. Chin J Clin Rehabil, 2006, 10(37): 81. DOI:10.3321/j.issn:1673-8225.2006.37.031 |
| [2] |
吴晓光. 鹿瓜多肽对骨质疏松性骨折术后骨生长过程中炎症因子影响研究[J]. 辽宁中医药大学学报, 2018, 20(1): 170. WU XG. Study on the effects of application of Cervus and Cucumis polypeptide in postoperative osteoporotic fracture and its influence on bone metabolism and bone mineral density[J]. J Liaoning Unive Tradit Chin Med, 2018, 20(1): 170. |
| [3] |
罗东方, 詹志军, 代百发. 鹿瓜多肽治疗膝骨关节炎的疗效观察[J]. 中国医院用药评价与分析, 2016, 16(10): 1334. LUO DF, ZHAN ZJ, DAI BF. Observation on efficacy of Cervus and Cucumis polypeptide in treatment of knee osteoarthritis[J]. Eval Anal Drug Use Hosp China, 2016, 16(10): 1334. |
| [4] |
曾乐天. 鹿瓜多肽注射液治疗类风湿性关节炎临床疗效[J]. 海峡药学, 2016, 28(1): 106. ZENG LT. Clinical effectiveness for treatment of rheumatoid arthritis by Cervus and Cucumis polypeptide injection[J]. Strait Pharm J, 2016, 28(1): 106. |
| [5] |
陈友银. 鹿瓜多肽治疗创伤性骨折的临床疗效[J]. 中国中西医结合外科杂志, 2017, 23(3): 250. CHEN YY. Clinical effectiveness for treatment of traumatic fractures by Cervus and Cucumis polypeptide injection[J]. Chin J Surg Integr Tradit West Med, 2017, 23(3): 250. |
| [6] |
林文鑫. 鹿瓜多肽的药理作用和临床应用[J]. 实用全科医学, 2006, 4(6): 730. LIN WX. Pharmacological effect and clinical application of Cervus and Cucumis polypeptide[J]. Appl J Gen Pract, 2006, 4(6): 730. |
| [7] |
徐文艳. 鹿瓜多肽治疗骨折患者的疗效及护理分析[J]. 临床护理, 2017, 15(15): 258. XU WY. Nursing analysis and clinical effects of Cervus and Cucumis polypeptide on the treatment of fracture[J]. J Clin Nurs, 2017, 15(15): 258. |
| [8] |
杨杰, 张殿英. 接骨七厘片联合鹿瓜多肽治疗四肢骨折的疗效观察[J]. 现代药物与临床, 2018, 33(2): 368. YANG J, ZHANG DY. Clinical observation of Jiegu Qili tablets combined with Cervus and Cucumis polypeptide in treatment of limb fracture[J]. Drugs Clin, 2018, 33(2): 368. |
| [9] |
林上炎, 王灿, 邵红, 等. 肝水解肽体外活性测定方法的优化[J]. 中国医药工业杂志, 2013, 44(6): 600. LIN SY, WANG C, SHAO H, et al. Optimization of bioassay method of liver hydrolysates in vitro[J]. Chin J Pharm, 2013, 44(6): 600. |
| [10] |
吴耀松, 尹素改, 任闪闪, 等. 六君子汤对食管癌EC-9706细胞株树突状细胞成熟的影响[J]. 中医杂志, 2018, 59(6): 508. WU YS, YIN SG, REN SS, et al. Effect of six gentlemen decoction on the maturation of dendritic cells in esophageal cancer cell line EC-9706[J]. J Tradit Chin Med, 2018, 59(6): 508. |
| [11] |
陈书明, 贾丹, 王志强, 等. 复方中药对感染NIB鸡淋巴细胞刺激指数的影响[J]. 山西农业大学学报, 2009, 29(6): 575. CHEN SM, JIA D, WANG ZQ, et al. Effects of compound Chinese herbal medicine on the stimulation indexes of the lymphocytes in the chicks infected by nephropathogenic infectious bronchitis virus[J]. J Shanxi Agric Univ, 2009, 29(6): 575. |
| [12] |
岳云飞, 张丽英. MTT法测定注射用鹿瓜多肽活性[J]. 黑龙江医药, 2011, 24(3): 248. YUE YF, ZHANG LY. Determination of the activity of Cervus and Cucumis polypeptide for injection with MTT[J]. Helongjiang Med Pharm J, 2011, 24(3): 248. |
| [13] |
刘素贞, 曹晓敏, 许丽娟, 等. 应用CCK8法检测鸡淋巴细胞活性的检测最佳条件研究[J]. 黑龙江畜牧兽医, 2017(13): 212. LIU SZ, CAO XM, XU LJ, et al. Study on the best condition for detection of chicken lymphocyte activity by CCK8[J]. Helongjiang Anim Sci Vet Med, 2017(13): 212. |
| [14] |
王灿, 吴利红, 史芳亮, 等. 肝水解肽体外活性测定方法的探讨研[J]. 药物分析杂志, 2011, 31(10): 1982. WANG C, WU LH, SHI FL, et al. Research on the method for determining the bioactivity of liver hydrolysates in vitro[J]. Chin J Pharm Anal, 2011, 31(10): 1982. |
| [15] |
王灿, 林上炎, 吴利红, 等. 注射用核糖核酸Ⅱ的抗肿瘤活性测定[J]. 中国医药工业杂志, 2015, 46(4): 375. WANG C, LIN SY, WU LH, et al. Determination of anti-carcinoma activity of ribonucleic acid Ⅱ[J]. Chin J Pharm, 2015, 46(4): 375. |
 2018, Vol. 38
2018, Vol. 38 
