2. 上海众胜医药科技有限公司, 上海 201203
2. Shanghai Zhongsheng Pharm-tech Co., Ltd., Shanghai 201203, China
暖宫孕子胶囊由熟地黄、香附、当归、川芎、白芍、阿胶、艾叶、杜仲、续断、黄芩共10味药制成,为胶艾汤加味方,具有滋阴养血、温经散寒、行气止痛的作用。该药临床上用于血虚气滞、经水不调、赤白带下、子宫寒冷、久不受孕等症,治疗效果显著[1-2]。中药的药理药效是多种有效组分协同作用的结果,制剂的质量评定应是多种组分的考察[3]。现代研究表明,暖宫孕子胶囊中,熟地黄所含的毛蕊花糖苷,香附所含的α-香附酮,当归所含的藁本内酯,白芍所含的没食子酸、芍药苷、芍药内酯苷、苯甲酰芍药苷,杜仲所含的松脂醇二葡萄糖苷,续断所含的川续断皂苷Ⅵ,以及黄芩所含的黄芩苷等均是活性成分[4-6]。这些成分含量的同时分析在相关文献报道[7-13]中并未涉及,现行质量标准仅以芍药苷为含量测定指标,采用HPLC法进行定量分析,不能有效地控制药品的内在质量。LC-MS法是重要的多成分微量分析方法,鉴于暖宫孕子胶囊中多指标成分精确定量测定方法的研究尚未见报道,本文采用UPLC-MS法同时分析暖宫孕子胶囊中没食子酸、松脂醇二葡萄糖苷、芍药内酯苷、毛蕊花糖苷、芍药苷、黄芩苷、川续断皂苷Ⅵ、苯甲酰芍药苷、藁本内酯、α-香附酮共10个指标成分,为该制剂的质量控制提供参考。
1 仪器与材料 1.1 仪器Waters ACQUITY UPLC系统(包括四元泵溶剂系统,在线脱气机和自动进样器;Waters公司);Xevo TQ检测器(Waters公司);MassLynxTM质谱工作站软件(Waters公司);ML204/02、MS-205电子天平(上海梅特勒-托利多仪器有限公司);KH-500DV超声波清洗器(昆山禾创超声仪器有限公司);D3024R台式高速冷冻离心机(北京大龙兴创实验仪器有限公司)。
1.2 材料暖宫孕子胶囊(批号分别为20161101、20161102、20170301、20170302、20170601、20170603,规格为0.4 g·粒-1,国药准字Z20090572)购自湖北福人药业股份有限公司。对照品没食子酸(批号MSZS20170113)和苯甲酰芍药苷(批号BJSY20170406)购自南京春秋生物工程有限公司,松脂醇二葡萄糖苷(批号911C021)和黄芩苷(批号1209A022)购自北京索莱宝科技有限公司,芍药内酯苷(批号lw16060804)和毛蕊花糖苷(批号lw16062004)购自南京良纬生物科技有限公司,芍药苷(批号11736-201741)和川续断皂苷Ⅵ(111685-201506)购自中国食品药品检定研究院,藁本内酯(批号C10093362)购自上海麦克林生化科技有限公司;经HPLC峰面积归一化法检测,上述对照品纯度均在98%以上。甲醇、乙腈、甲酸均为色谱纯(Merck公司),超纯水经过Milli-Q系统纯化制备,其余试剂均为分析纯(国药集团化学试剂有限公司)。
2 方法与结果 2.1 色谱-质谱条件采用Waters Acquity UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~13 min,5%B→100%B;13~14 min,100%B;14~14.5 min,100%B→5%B),流速为0.4 mL·min-1,柱温35 ℃,进样体积为2 μL。
采用多反应检测(MRM)模式,离子源温度150 ℃,毛细管电压3.5 kV,锥孔气流量50 L·h-1,碰撞气流量0.15 mL·min-1,脱溶剂气温度400 ℃,脱溶剂气流量1000 L·h-1。各成分的质谱参数见表 1。
|
|
表 1 10个成分的部分质谱分析参数 Table 1 The MS/MS parameters of 10 components |
分别精密称取各对照品适量,单独以纯甲醇溶解并定容,制成质量浓度均为1.0 mg·mL-1的对照品储备液;取对照品储备液适量置量瓶中,以甲醇稀释,制成没食子酸、松脂醇二葡萄糖苷、芍药内酯苷、毛蕊花糖苷、芍药苷、黄芩苷、川续断皂苷Ⅵ、苯甲酰芍药苷、藁本内酯、α-香附酮质量浓度分别为35.0、14.3、114.7、52.7、190.7、128.7、54.4、11.9、454.7和85.4 μg·mL-1的混合对照品母液;取混合对照品母液适量,以甲醇逐级稀释,制得6个浓度的系列混合对照品溶液,避光4 ℃保存。
2.2.2 供试品溶液精密称取暖宫孕子胶囊内容物0.5 g,加入甲醇10 mL,称量,超声(500 W,40 kHz)提取30 min,再称量,用甲醇补充损失的量,10 000 r·min-1离心10 min,取上清液,经0.22 μm微孔滤膜过滤,取续滤液作为供试品溶液,避光4 ℃保存。
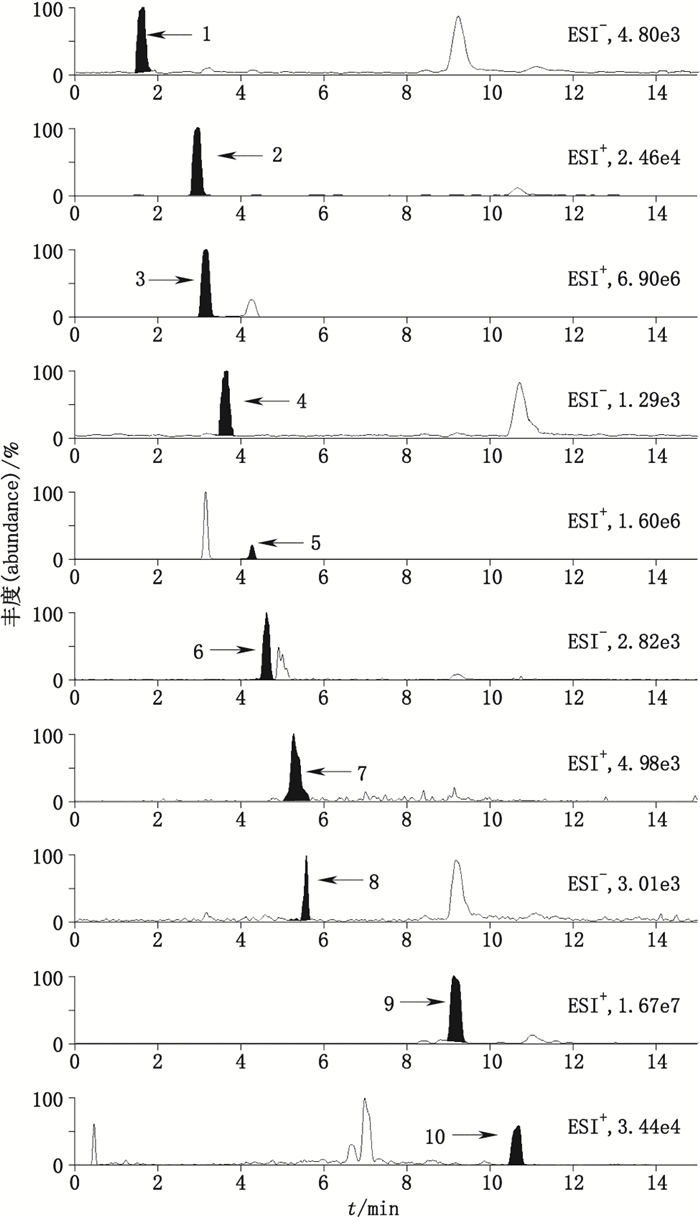
2.3 线性关系考察所测成分的定量下限(LOQ)要求信噪比S/N>10,检测下限(LOD)要求信噪比S/N>3,6次进样的精密度试验的峰面积的RSD≤15%。根据预实验的样品含量范围考察,选择7个浓度的混合对照品溶液在3 d内每天重复进样(n=3),分别计算各成分的平均峰面积Y,以Y对进样质量浓度X(μg·mL-1)进行线性回归,得回归方程。10个成分回归方程线性范围、相关系数(r)、LOQ见表 2,批号为20170301的样品的MRM离子图见图 1。结果表明,各化合物在相应质量浓度范围内呈良好的线性关系(r为0.995 3~0.999 8)。
|
|
表 2 线性关系考察及检测下限、定量下限检测的结果 Table 2 The results of linear regression, LOD and LOQ of the investigated compounds |
|
1.没食子酸(gallic acid) 2.松脂醇二葡萄糖苷(pinoresinol diglucoside) 3.芍药内酯苷(albiflorin) 4.毛蕊花糖苷(verbascoside) 5.芍药苷(paeoniflorin) 6.黄芩苷(baicalin) 7.川续断皂苷Ⅵ(asperosaponin Ⅵ) 8.苯甲酰芍药苷(benzoylpaeoniflorin) 9.藁本内酯(ligustilide) 10.α-香附酮(α-cyperone) 图 1 10个化合物的样品MRM质谱图 Figure 1 Typical MRM chromatograms of 10 compounds from a real sample |
将混合对照品溶液连续进样测定6次,没食子酸、松脂醇二葡萄糖苷、芍药内酯苷、毛蕊花糖苷、芍药苷、黄芩苷、川续断皂苷Ⅵ、苯甲酰芍药苷、藁本内酯和α-香附酮色谱峰峰面积的RSD分别为0.79%、1.7%、2.2%、4.2%、2.8%、6.2%、0.48%、5.8%、4.1%和2.3%,表明精密度良好。
2.5 稳定性试验取同一供试品溶液(样品批号20170301),每隔1 h进样1次,连续进样测定6次,计算得到没食子酸、松脂醇二葡萄糖苷、芍药内酯苷、毛蕊花糖苷、芍药苷、黄芩苷、川续断皂苷Ⅵ、苯甲酰芍药苷、藁本内酯和α-香附酮峰面积的RSD分别为3.0%、5.6%、0.9%、3.4%、1.2%、4.0%、9.4%、5.0%、3.6%、5.9%,表明供试品溶液在5 h内稳定性较好。
2.6 重复性试验取同一批样品(批号20170301)5份,按“2.2.2”项下方法制备供试品溶液,进样测定,样品中没食子酸、松脂醇二葡萄糖苷、芍药内酯苷、毛蕊花糖苷、芍药苷、黄芩苷、川续断皂苷Ⅵ、苯甲酰芍药苷、藁本内酯和α-香附酮平均含量分别为113.6、22.4、771.9、235.9、1 573.4、645.9、512.8、26.3、3 765.4、60.1 μg·g-1,RSD分别为3.3%、6.1%、0.92%、3.0%、1.1%、4.3%、3.1%、5.5%、2.0%和6.4%,表明方法的重复性较好。
2.7 加样回收率试验取9份已测知含量的样品(批号20170301)0.25 g,分别加入相当于样品中各待测成分含有量80%、100%、120%的对照品,按“2.2.2”项下方法制得供试溶液,进样测定,计算回收率,结果见表 3。
|
|
表 3 暖宫孕子胶囊中10个成分加样回收率试验结果(n=3) Table 3 Recovery results of ten components in Nuangong Yunzi capsules |
取不同批次的样品,分别按“2.2.2”项下方法制备供试品溶液,进样测定,以外标法计算含量,结果见表 4。
|
|
表 4 不同批次暖宫孕子胶囊中10个主要成分的含量(n=3) Table 4 Contents of ten main components in Nuangong Yuzi capsules of different batches |
中药多成分多靶点的特点使得对制剂进行多组分质量控制显得尤为重要,本实验采用UPLC-MS/MS所建立的方法,可同时测定暖宫孕子胶囊中的10个活性物质,该方法操作简单、快速,能较全面地反映所含药材的质量。
根据化合物的理化性质,对超声与加热回流提取2种方式进行了比较,结果2种提取方式效果基本相同,但回流提取至少需2 h才能提取完全,而超声提取30 min即可,且操作简单,溶剂用量少[14],所以选择超声提取作为提取方式。比较了甲醇、稀乙醇和水3种提取溶剂对被测物的提取率,结果以甲醇为提取溶剂能够使被检测物较好地溶出。
根据化合物的理化性质和色谱行为,比较了以甲醇、乙腈与水、甲酸水构成的洗脱系统,结果表明,以甲醇-水或甲酸水为洗脱系统时,各成分的分离效果不理想,经优化后的乙腈-甲酸-水系统各成分的分离效果较好,各色谱峰的分离度和理论塔板数均符合要求。采用超高效色谱柱Thermo Syncronis C18、Acquity BEH C18进行分析,比较色谱峰形和分离度,皆具有较好的分离效果。
由于具有高灵敏度和高选择性的优点,MRM被广泛地应用于定量分析[15-16],本实验采用MRM方式对暖宫孕子胶囊中10个主要生物活性成分进行定量分析,可以避免其他成分的干扰,专属性强,重现性好,有效地提高药品质量控制水平。
样品测定结果表明,各批次间被测成分有一定差异,有必要对产品中多组分进行监控,以保证疗效。
| [1] |
史巧会. 暖宫孕子胶囊联合定坤丹治疗女性不孕的效果观察[J]. 临床合理用药, 2016, 9(8A): 102. SHI QH. Observation on the effect of Nuangong Yunzi capsules combined with Dingkundan on female infertility[J]. Chin J Clin Ration Drug Use, 2016, 9(8A): 102. |
| [2] |
赖雪梅, 顾华妍, 谭莉娜, 等. 暖宫孕子胶囊联合克罗米芬治疗排卵性不孕40例临床观察[J]. 中国药业, 2014, 23(22): 106. LAI XM, GU HY, TAN LN, et al. Clinical observation on Nuangong Yunzi capsules combined with clomiphene in treating ovulatory infertility in 40 cases[J]. China Pharm, 2014, 23(22): 106. |
| [3] |
董乙文, 李天雪, 褚朝森, 等. UPLC-MS/MS法同时定量测定补中益气丸中的15种化合物[J]. 药物分析杂志, 2017, 37(7): 1228. DONG YW, LI TX, CHU CS, et al. UPLC-MS/MS method for simultaneous determination of 15 components in Buzhong Yiqi pills[J]. Chin J Pharm Anal, 2017, 37(7): 1228. |
| [4] |
LIU P, LI ZH, QIAN DW, et al. Simultaneous determination of bioactive components in essential oil of Xiang-Fu-Si-Wu Formula in Beagle dog plasma by UPLC-MS/MS and its application to pharmacokinetics[J]. J Chromatogr B, 2013, 929: 63. DOI:10.1016/j.jchromb.2013.04.022 |
| [5] |
李广润, 宫丽丽, 吕亚丽, 等. 川续断皂苷Ⅵ药理作用研究进展[J]. 中国新药与临床杂志, 2014, 33(7): 477. LI GR, GONG LL, LÜ YL, et al. Research progress in pharma-cological effects of asperosaponin Ⅵ[J]. Chin J New Drugs Clin Rem, 2014, 33(7): 477. |
| [6] |
辛文妤, 宋俊科, 何国荣, 等. 黄芩素和黄芩苷的药理作用及机制研究进展[J]. 中国新药杂志, 2013, 22(6): 647. XIN WY, SONG JK, HE GR, et al. Progress in pharmacological study and the underlying mechanism of baicalein and baicalin[J]. Chin J New Drugs, 2013, 22(6): 647. |
| [7] |
张国锋, 许文东, 周海洋, 等. HPLC法测定暖宫孕子胶囊中芍药苷的含量[J]. 齐鲁药事, 2006, 25(10): 602. ZHANG GF, XU WD, ZHOU HY, et al. Determination of paeoniflorin in Nuangong Yunzi capsules by HPLC[J]. Qilu Pharm Aff, 2006, 25(10): 602. |
| [8] |
田静, 许亚玲, 任汝仙. 反相高效液相色谱法测定暖宫孕子丸浸膏中黄芩苷含量[J]. 中国药业, 2014, 23(21): 49. TIAN J, XU YL, REN RX. Determination of baicalin content in Nuangong Yunzi pill extract by RP-HPLC[J]. China Pharm, 2014, 23(21): 49. |
| [9] |
王卫锋, 李芳, 郝红梅, 等. 暖宫孕子丸质量控制研究[J]. 中医药导报, 2012, 18(3): 67. WANG WF, LI F, HAO HM, et al. Studies on quality control of Nuangong Yunzi pills[J]. Guiding J Tradit Chin Med Pharm, 2012, 18(3): 67. |
| [10] |
韩秀兰. HPLC法测定暖宫孕子丸中芍药苷的含量[J]. 中国药品标准, 2009, 10(6): 467. HAN XL. Content determination of paeoniflor in Nuangong Yunzi pills by HPLC[J]. Drug Stand China, 2009, 10(6): 467. |
| [11] |
马洪涛, 昝丹娅, 许世辉. 暖宫孕子丸质量标准的研究[J]. 安徽医药, 2008, 12(6): 497. MA HT, ZAN DY, XU SH. Studies on the quality critera for Nuangong Yunzi pills[J]. Anhui Med Pharm J, 2008, 12(6): 497. |
| [12] |
周锐. 高效液相色谱法测定暖宫孕子丸中芍药苷的含量[J]. 青海师范大学学报(自然科学版), 2007(3): 67. ZHOU R. Determination of paeoniflorin in Nuangong Yunzi pills by HPLC[J]. J Qinghai Norm Univ(Nat Sci), 2007(3): 67. |
| [13] |
张国锋, 崔新德, 许文东, 等. 暖宫孕子丸中白芍、黄芩薄层鉴别方法的研究[J]. 齐鲁药事, 2006, 25(3): 155. ZHANG GF, CUI XD, XU WD, et al. Identification methods research on white peony root and baikal skullcap root in Nuangong Yunzi pills by TLC[J]. Qilu Pharm Aff, 2006, 25(3): 155. |
| [14] |
薛峰, 李春娜, 李朋收, 等. 超声提取在中药化学成分提取中的应用[J]. 中国实验方剂学杂志, 2014, 20(18): 231. XUE F, LI CN, LI PS, et al. Application in ultrasonic extraction chemical constituents of traditional Chinese medicine[J]. Chin J Exp Tradit Med Form, 2014, 20(18): 231. |
| [15] |
祁昆, 王洋, 陈涛, 等. 液质联用在中药复方制剂研究中的应用[J]. 天津中医药大学学报, 2017, 36(5): 396. QI K, WANG Y, CHEN T, et al. Application of LC-MS in the research of traditional Chinese medicine prescriptions[J]. J Tianjin Univ Tradit Chin Med, 2017, 36(5): 396. DOI:10.11656/j.issn.1673-9043.2017.05.19 |
| [16] |
苏靖, 戴荣继. 液质联用技术在中药研究中的应用[J]. 生命科学仪器, 2014, 12(Z1): 38. SU J, DAI RJ. The application of liquid chromatography-mass spectrometry in the study of traditional Chinese medicine[J]. Life Sci Instrum, 2014, 12(Z1): 38. |
 2018, Vol. 38
2018, Vol. 38 