琥珀酸去甲文拉法辛(desvenlafaxine succinate,DVS)是选择性5-羟色胺(5-HT)与去甲肾上腺素(NE)再摄取抑制剂,能同时阻滞突触前5-HT和NE的再摄取,导致此2种神经递质水平的持续升高,并轻度抑制多巴胺(DA)的摄取而发挥抗抑郁作用,临床用于治疗成人的重症抑郁症(MDD)[1]。琥珀酸去甲文拉法辛缓释片(商品名Pristiq®)由美国惠氏公司(WYETH PHARMACEUTICALS INC.)生产,于2008年2月29日经美国FDA批准上市[2],目前尚未在中国上市。
按国家食品药品监督管理总局(SFDA)的化学药品注册分类改革工作方案,对Pristiq®的仿制属于注册分类3类,且要求该类药品应与原研药品为参比,其质量和疗效应一致。鉴于此,作为口服固体制剂的仿制药,本品的体外溶出研究是药学部分的重点内容[3-6]。
关于琥珀酸去甲文拉法辛缓释片的研究论文,目前多集中于有关物质、临床血药浓度检测方面[7-8],而对本品溶出方面的报道,特别是针对于本品缓释制剂特点的倾泻实验尚未见报道。本文通过对2个规格自研琥珀酸去甲文拉法辛缓释片和原研片(Pristiq®,美国惠氏)分别进行溶出曲线对比,以FDA溶出数据库中Pristiq®的溶出介质0.9%氯化钠溶液,为质量标准中的主介质,同时分别考察其他4种不同介质(水、pH 1.0盐酸溶液、pH 4.5磷酸盐缓冲液及pH 6.8磷酸盐缓冲液)中的体外释放行为的一致性、强力变化转速和不同浓度乙醇的倾泻条件下溶出曲线的一致性,结果2个规格自研制剂与原研参比制剂体外释放行为均基本一致,为本品仿制药研究与开发提供支持。
1 仪器与试药高效液相色谱仪(美国Waters e2695-2489,配有四元泵、在线脱气机、自动进样器、UV检测器和Empower工作站),溶出仪(美国DISTEK EVOLUTION 6300自动溶出仪;天津天大天发科技有限公司RCZ-8D溶出仪)。
琥珀酸去甲文拉法辛对照品(南京友杰医药科技有限公司,批号1589-031-7,含量99.94%,拟申报标准物质);琥珀酸去甲文拉法辛原料药(南京友杰医药科技有限公司,批号1411002,拟申报原料药);琥珀酸去甲文拉法辛缓释片自研制剂(华润双鹤药业股份有限公司,规格50 mg,批号15041502、15041402;规格100 mg,批号15041401、15041301);琥珀酸去甲文拉法辛缓释片参比制剂(美国惠氏WYETH PHARMACEUTICALS INC,规格50 mg,批号L12636、M28119;规格100 mg,批号L12648、M09973)
磷酸二氢铵(AR,批号20150205,国药集团化学试剂有限公司);氯化钠(AR,批号20140619,北京化工厂);乙腈(HPLC级,批号P6EA1H,Honeywell)乙醇(AR,批号20150915,北京化工厂);其余试剂均为分析纯。水为纯化水。
2 溶出度测定方法 2.1 色谱条件色谱柱:Kromasil 100-5C8(250 mm×4.6 mm,5 μm);流动相:0.1 mol·L-1磷酸二氢铵溶液(pH 4.4)-乙腈(80:20);检测波长:226 nm;柱温:30 ℃;流速:1.0 mL·min-1;进样量:10 μL。
2.2 溶出度测定法取样品6片,照溶出度与释放度测定法(《中华人民共和国药典》2015年版四部通则0931)第一法(篮法),将片剂放入篮内,分别以“3.2”项下的0.9%氯化钠溶液介质900 ml为溶出介质,转速为100 r·min-1,依法操作,分别在1、2、4、8、12、16、20、24 h取溶液5 mL,滤过,弃去初滤液2 mL,并即时补充相同温度、相同体积的溶出介质,取续滤液作为供试品溶液;另取琥珀酸去甲文拉法辛对照品约25 mg,精密称定,置25 mL量瓶中,加溶出介质适量超声使溶解并稀释至刻度,摇匀,精密量取1 mL,置10 mL量瓶中,加溶出介质稀释至刻度,摇匀,作为对照品溶液。
3 方法与结果 3.1 溶出度测定验证 3.1.1 专属性考察取50 mg空白辅料、100 mg空白辅料、自研制剂(规格50 mg,批号15041402;规格100 mg,批号15041301)及琥珀酸去甲文拉法辛对照品适量(约相当于1片量),按“2.2”项下溶出度测定法操作,滤过,精密量取上述各续滤液及溶出介质各10 μL,注入液相色谱仪,记录色谱图(图 1),其中为了更明晰主峰位置是否有干扰,对溶出介质和空白辅料图谱的纵坐标缩小约250倍,放大后更明确了无干扰的结果。结果表明,溶出介质及空白辅料对主成分的测定均无干扰。本品专属性良好。
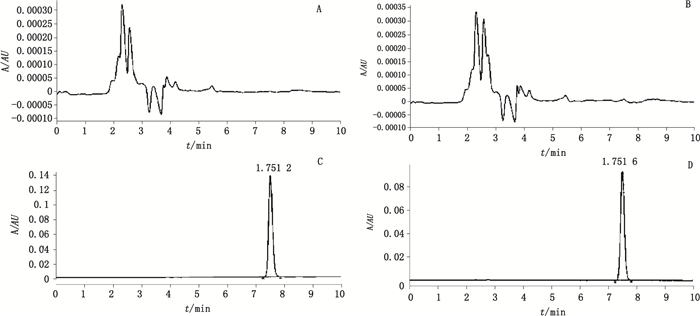
|
A.溶出介质(dissolution medium) B.空白辅料(blank excipients) C.对照品(reference substance) D.自研制剂(self-prepared preparation) 图 1 专属性考察结果 Figure 1 Results of specificity test |
精密称取琥珀酸去甲文拉法辛对照品25 mg,置25 mL量瓶中,加溶出介质适量,超声使溶解并稀释至刻度,摇匀,继续稀释得去甲文拉法辛质量浓度为4.996、24.98、49.96、79.94、99.92、149.88、199.84 μg·mL-1的对照品溶液。精密量取上述对照品溶液各10 μL,注入液相色谱仪,记录色谱图。以去甲文拉法辛质量浓度为横坐标,峰面积为纵坐标,进行线性回归,得线性方程:
| $ Y = 1.219 \times {10^7}X + 4.130 \times {10^3}\;\;\;r = 0.999\;7 $ |
表明本品在去甲文拉法辛质量浓度为4.996~199.84 μg·mL-1的范围内线性关系良好。
3.1.3 准确度考察精密称取琥珀酸去甲文拉法辛对照品适量,加入等量的空白辅料,用溶出介质配制成20%、60%、120%3种不同浓度的溶液,滤过,精密量取各续滤液10 μL,注入液相色谱仪,记录色谱图,每个浓度平行操作3份,计算回收率。结果见表 1,本品50 mg规格各水平下的平均回收率为99.6%,RSD为0.9%;100 mg规格每个水平下平均回收率99.4%,RSD为0.6%,表明本方法准确度良好。
|
|
表 1 回收率试验结果 Table 1 Results of recovery test |
精密称取对照品适量,分别加入等量空白辅料,配制50 mg、100 mg规格供试品100%浓度溶液各6份,按“2.2”项下操作,结果见表 2和表 3,RSD分别为0.58%、0.57%,表明本方法重复性良好。
|
|
表 2 50 mg规格重复性、中间精密度试验结果 Table 2 Results of repeatability test and intermediate precision test(50 mg) |
|
|
表 3 100 mg规格重复性、中间精密度试验结果 Table 3 Results of repeatability test and intermediate precision test(100 mg) |
由不同分析人员,于不同日期,采用不同的液相色谱仪,按照重复性试验方法,使用同一批样品配制6份供试品溶液,进行中间精密度试验。由表 2、3可知,RSD分别为0.47%、0.78%,表明本方法中间精密度良好。
3.1.5 溶液稳定性试验取“3.1.1”项下的对照品溶液和自制品供试品溶液(50 mg规格和100 mg规格)室温放置,分别在48 h内取样进行峰面积测定,考察琥珀酸去甲文拉法辛的溶液稳定性。结果见表 4,表明室温放置48 h内对照品溶液和供试品溶液稳定。
|
|
表 4 48 h内溶液稳定性结果 Table 4 Results of stability test for reference solution and test solution in 48 h |
取对照品溶液,在确定的色谱条件基础上,考察分别改变流速、柱温、色谱柱及流动相比例对测定的影响。色谱条件变化见表 5,在色谱条件有微小变化时,测定不受影响,表明此方法耐用性良好。
|
|
表 5 耐用性实验结果 Table 5 Results of robustness |
水:经脱气机处理后的纯化水;0.9%氯化钠溶液(主介质):称取氯化钠9.0 g,加脱气水溶解并稀释至1 000 mL,即得。pH 1.0盐酸溶液:精密量取浓盐酸9.0 mL,加水稀释至1 000 mL,摇匀,即得。pH 4.5磷酸盐缓冲液:精密称取磷酸二氢钾6.80 g,加水溶解并稀释至1 000 mL,摇匀,即得。pH 6.8磷酸盐缓冲液:精密称取磷酸二氢钾6.80 g,加入0.2 mol·L-1氢氧化钠溶液(取8.0 g氢氧化钠,加水溶解并稀释至1 000 mL,即得)112.0 mL,加水溶解并稀释至1 000 mL,摇匀,即得。
3.2.2 5种溶出介质37 ℃下溶液稳定性考察分别称取琥珀酸去甲文拉法辛对照品适量(相当于50 mg规格制剂所含主药量),按本品溶出度测定方法操作,分别以水、0.9%氯化钠溶液、pH 1.0、pH 4.5、pH 6.8溶液900 mL为溶出介质,置溶出仪中37 ℃恒温水浴,在0、4、22、26、48 h分别取样进行峰面积测定,考察37 ℃不同溶出介质中的溶液稳定性。结果见表 6,表明琥珀酸去甲文拉法辛分别在5种溶出介质中放置48 h稳定。
|
|
表 6 48 h内不同介质溶液中药物稳定性结果 Table 6 Results of stability test from different dissolution mediums in 48 h |
分别取两个规格的自研片与原研制剂,照中国药典溶出度与释放度测定法(通则0931第一法),测定5种不同溶出介质中的溶出曲线,转速100 r·min-1,在0,1,2,4,8,12,16,20,24 h分别取样,并采用相似性f2因子法评价。结果见图 2和3,f2因子汇总见表 7。由结果可知,5种不同溶出介质中,自研制剂与原研制剂的释放行为相似,具有一致性(f2因子均 > 50%)。
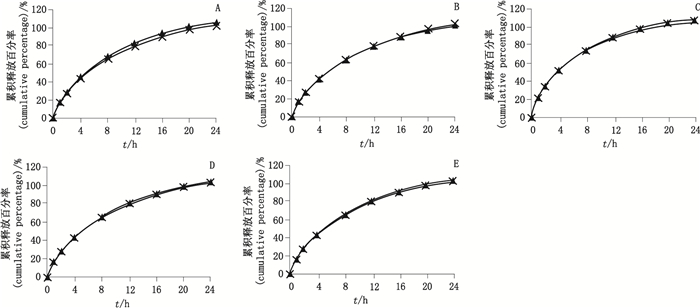
|
A.水(water) B. 0.9%氯化钠溶液(0.9% NaCl solution) C. pH 1.0盐酸溶液(pH 1.0 hydrochloride solution) D. pH 4.5磷酸盐缓冲溶液(pH 4.5 phosphate buffer) E. pH 6.8磷酸盐缓冲溶液(pH 6.8 phosphate buffer) 图 2 50 mg规格自研制剂(×)与原研制剂(▲)在不同介质中的溶出曲线对比(n=12) Figure 2 Comparison of release curve of self-prepared preparation(×)and reference preparation(▲)in 5 different dissolution mediums(50 mg) |
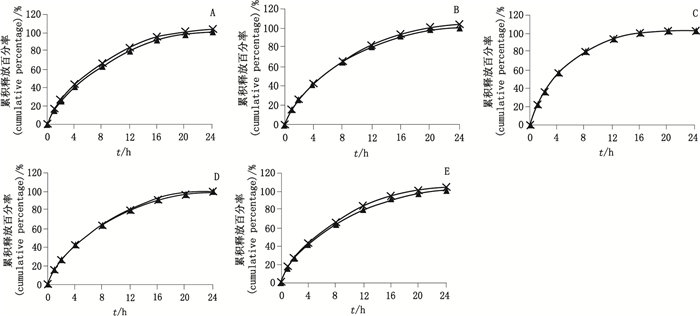
|
A.水(water) B. 0.9%氯化钠溶液(0.9% NaCl solution) C. pH 1.0盐酸溶液(pH 1.0 hydrochloride solution) D. pH 4.5磷酸盐缓冲溶液(pH 4.5 phosphate buffer) E. pH 6.8磷酸盐缓冲溶液(pH6.8 phosphate buffer) 图 3 100 mg规格自制制剂(×)和原研制剂(▲)在5种不同介质中的溶出曲线(n=12) Figure 3 Comparison of release curves of self-prepared preparation(×)and original preparation(▲)in 5 different dissolution mediums(100 mg) |
|
|
表 7 不同介质中的f2因子结果 Table 7 Results of f2 factor analysis |
Om Anand[10]指出,酒精会改变药物释放特性,导致药物过快释放,并改变药物体内暴露量,进而影响药物的安全的性和有效性。采用0.1 mol·L-1盐酸模拟胃液,分别用体积比(v/v)分别为0%、5%、20%、40%的乙醇-0.1 mol·L-1盐酸溶液模拟患者饮酒后的胃液[10-11]作为溶出介质,分别在0、15、30、45、60、75、90、105、120 min取溶液进行测定。
根据上述方法,采用0%、5%、20%、40%的乙醇-0.1 mol·L-1盐酸溶液为溶出介质,在0~2 h内每15 min取液5 mL,有机滤膜滤过,弃去2 mL初滤液,并即时补液,取续滤液作为供试品溶液。
另取琥珀酸去甲文拉法辛对照品约25 mg,精密称定,置25 mL量瓶中,加相应溶出介质适量超声使溶解并稀释至刻度,摇匀,作为对照品储备液。精密量取对照品储备液1 mL,置10 mL量瓶中,加溶出介质稀释至刻度,摇匀,制成每1 mL约含琥珀酸去甲文拉法辛0.1 mg的溶液,作为对照品溶液。
精密量取供试品溶液及对照品溶液各10 μL,注入液相色谱仪,记录色谱图,按外标法以峰面积分别计算每片在不同时间的累积溶出量。
结果见图 4,f2因子汇总见表 8。图 4中,随着乙醇浓度增大,所有制剂主药的溶出速率均呈现降低趋势,可见,乙醇能减弱本品制剂的释放。由表 8可知,在4种浓度乙醇-0.1 mol·L-1HCl介质溶液中,2个规格的自研制剂和原研制剂的f2因子均 > 80,基本重叠。表明本品自研制剂在乙醇倾泻实验的剧烈条件下,与原研制剂的体外溶出行为具有良好的一致性。
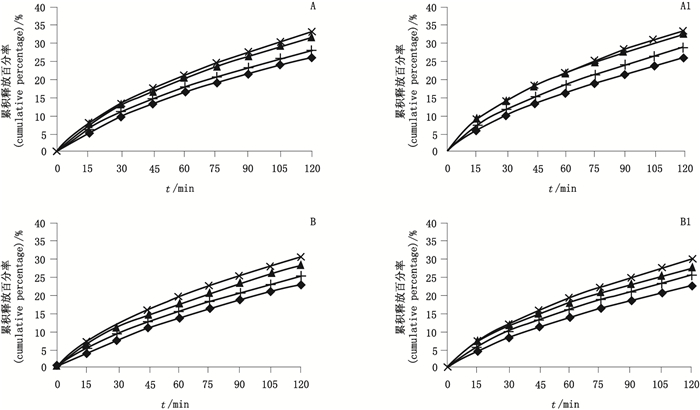
|
×— 0% ▲—5%乙醇(5%ethanol) +—20%乙醇(20%ethanol) ◆—40%乙醇(40%ethanol) A. 50 mg参比制剂(50 mg reference preparation) A1. 50 mg自研制剂(50 mg self-prepared preparation) B. 100 mg参比制剂(100 mg reference preparation) B1. 100 mg自研制剂(100 mg self-prepared preparation) 图 4 不同浓度乙醇-0.1 mol·L-1盐酸介质的溶出曲线对比(n=12) Figure 4 Comparison on release curve of preparation in various ethanol concentrations -0.1 mol·L-1 hydrochlorid acid medium |
|
|
表 8 不同浓度乙醇溶出介质中f2因子的结果 Table 8 Results of f2 factors analysis in various ethanol concentrations |
2个规格分别取自研片与原研制剂,照中国药典溶出度与释放度测定法(通则0931第一法),用0.9%氯化钠溶液作溶出介质,分别使用75、100、200 r·min-1 3种不同转速测定两者的溶出曲线,在0、1、2、4、8、12、16、20、24 h分别取样,并采用相似性f2因子法评价。结果见图 5,f2因子汇总见表 9。表明,与质量标准中的转速100 r·min-1对比,过低75 r·min-1和过高200 r·min-1的倾泻条件[6]转速下,自研制剂和参比制剂的释放行为均相似良好(f2因子均 > 50%),强力变化的转速对本品溶出曲线相似性无影响。同时表明,本品缓释片对转速的改变不敏感。
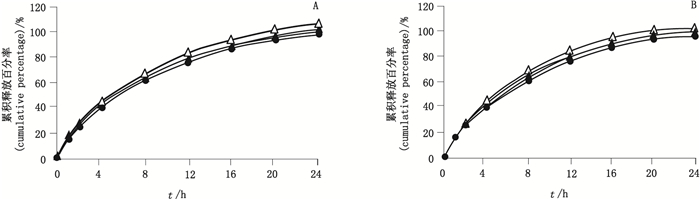
|
▲参比制剂(reference preparation)200 r·min-1 △自研制剂(self-prepared preparation)200 r·min-1 ◆参比制剂(reference preparation)100 r·min-1 ×自研制剂(self-prepared preparation)100 r·min-1 ●参比制剂(reference preparation)75 r·min-1 =自研制剂(self-prepared preparation)75 r·min-1 A. 50 mg B. 100 mg 图 5 自研制剂与参比制剂不同转速下的溶出曲线对比(n=12) Figure 5 Comparison on release curve of self-prepared preparation and reference preparation under different rotation speed |
|
|
表 9 不同转速下f2因子结果 Table 9 Results of f2 factors analysis under different rotation speed |
对缓释片而言,其缓慢非恒速释放药物的特性能使血药浓度平稳持久,避免或减小峰谷现象,提高药物的有效性。但同时,由于单位制剂的剂量加大,发生活性成分释放过量的几率增加,会造成相应的安全隐患。因此,在缓释片的药学研究阶段,溶出曲线的研究和与参比制剂的对比是重中之重。
本品溶出度方法参考FDA溶出数据库中参比制剂的方法设定,溶出介质为0.9%氯化钠溶液,转速为100 r·min-1。溶出度测定方法符合方法学验证考察要求。
采用5种不同溶出介质,对自研与参比制剂的体外溶出行为进行了对比,f2值均远大于50,表明两者体外溶出对比具有一致性。
由于缓释片的剂量远高于普通制剂,因此制剂的突释会造成剂量倾泻,增大用药风险。其中患者对酒精的摄入会改变缓释片释放时的胃液极性,引起活性成分倾泻,溶出行为异常[12-15],极端转速也会引起剂量倾泻现象。经过分别对乙醇及转速倾泻实验考察,在持续2 h的乙醇倾泻实验中,0、5%、20%和40%共4种浓度乙醇-0.1 mol·L-1盐酸溶液介质下,自研和参比制剂的溶出曲线均具有高度一致性,表明两者一致性良好。此外,随着乙醇比例增加,自研和参比制剂的溶出速率均有一定的降低,这与琥珀酸去甲文拉法辛易溶于水,略溶于乙醇的特性有关;而75 r·min-1和200 r·min-1极端转速下,自研与参比对比同样具有高度一致性,经与质量标准中100 r·min-1对比,转速对琥珀酸去甲文拉法辛缓释片的溶出无影响,本结论与缓释片稳定释放的需要相吻合,也与王静等人的实验结论[16]一致。
综上所述,本品自研制剂2个规格下,采用5种介质溶出曲线对比,特别是乙醇和强力变化转速倾泻实验对比,本品自研制剂与参比制剂具有高度体外一致性,为申报仿制药提供药学支持。
| [1] |
SORBERA LA, BOLOS J, SERRADELL N. Desvenlafaxine succinate:antidepressant treatment of postmenopausal syndrome 5-HT and norepinephrine reuptake inhibitor[J]. Drugs Future, 2006, 31(4): 304. DOI:10.1358/dof.2006.031.04.988570 |
| [2] |
李灵, 曹国颖, 毕开顺, 等. 琥珀酸去甲文拉法辛的药理及临床研究[J]. 中国新药杂志, 2009, 18(16): 1483. LI L, CAO GY, BI KS, et al. Pharmacological and clinical studies of desvenlafaxine succinate[J]. Chin J New Drugs, 2009, 18(16): 1483. DOI:10.3321/j.issn:1003-3734.2009.16.002 |
| [3] |
US Food and Drug Administration. Guidance for Industry: Dissolution Test of Immediate Release Solid Oral Dosage Form[EB/OL]. [2017-05-02]. http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm070237.pdf
|
| [4] |
张启明, 谢沐风, 宁宝明, 等. 采用多条溶出曲线评价口服固体制剂的内在质量[J]. 中国医药工业杂志, 2009, 40(1): 946. ZHANG QM, XIE MF, NING BM, et al. Evaluation of solid oral products by dissolution profiles in different mediums[J]. Chin J Pharm, 2009, 40(1): 946. |
| [5] |
冯毅, 朱波. 关于我国仿制药质量一致性评价的研究与建议[J]. 中国新药杂志, 2016, 25(1): 19. FENG Y, ZHU B. Study report on generic drug quality equivalence assessment[J]. Chin J New Drugs, 2016, 25(1): 19. |
| [6] |
谢沐风. 解读"口服固体制剂仿制药一致性评价技术手段-多条溶出曲线"[J]. 中国医药工业杂志, 2013, 44(4): 411. XIE MF. Multiple dissolution profiles, the agreement evaluation technology of oral solid dosage forms of generic drug[J]. Chin J Pharm, 2013, 44(4): 411. |
| [7] |
陈银霞, 杜江波, 张逸凡, 等. 中国男性健康志愿者口服去甲文拉法辛缓释片对映体选择性药动学研究[J]. 药学学报, 2015, 50(4): 486. CHEN YX, DU JB, ZHANG YF, et al. The enantioselective pharmacokinetic study of desvenlafaxine sustained release tablet in Chinese healthy male volunteers after oral administration[J]. Acta Pharm Sin, 2015, 50(4): 486. |
| [8] |
何丽娟, 孙连福, 宋倩男, 等. 梯度洗脱RP-HPLC法测定琥珀酸去甲文拉法辛中有关物质[J]. 药物分析杂志, 2016, 36(5): 887. HE LJ, SUN LF, SONG QN, et al. Gradient elution RP-HPLC method for the determination of the related substances in desvenlafaxine succinate[J]. Chin J Pharm Anal, 2016, 36(5): 887. |
| [9] |
国家食品药品监督管理总局. 化学药物口服缓释制剂药学研究技术指导原则. (2007. 10)[EB/OL]. [2017-05-02]. http://www.sda.gov.cn/WS01/CL1616/90933.html State Food and Drug Administration. Guidance for Design and Evaluation of the Extended Release Oral Dosage Forms of Chemical Drugs. (2007. 10)[EB/OL]. [2017-05-02]. http://www.sda.gov.cn/WS01/CL1616/90933.html |
| [10] |
ANAND O, LAWRENCE X, DALE P. Dissolution testing for generic drugs:an FDA perspective[J]. AAPS J, 2011, 13: 328. DOI:10.1208/s12248-011-9272-y |
| [11] |
US Food and Drug Administration. Information for Healthcare Professionals: Hydromorphone Hydrochloride Extended-Release Capsules(marketed as Palladone). (2005-07)[2017-05-02] https://www.fda.gov/drugs/drugsafety/postmarketdrugsafetyinformationforpatientsandproviders/ucm129288.htm
|
| [12] |
JEDINGER N, KHINAST J, ROBLEGG E. The design of controlled-release formulations resistant to alcohol-induced dose dumping:a review[J]. Eur J Pharm Biopharm, 2014, 87: 217. DOI:10.1016/j.ejpb.2014.02.008 |
| [13] |
MURRAY S, WOOLTORTON E. Alcohol-associated rapid release of a long-acting opioid[J]. JAMC, 2005, 173: 756. |
| [14] |
BRENNAN PL, SCHUTTE KK, MOOS RH. Pain and use of alcohol to manage pain:prevalence and 3-year outcomes among older problem and non-problem drinkers[J]. Addiction, 2005, 100(6): 777. DOI:10.1111/add.2005.100.issue-6 |
| [15] |
GOHEL M, BARIYA SH. Advanced formulation design of venlafaxine hydrochloride coated and triple-layer tablets containing hypromellose[J]. Pharm Dev Technol, 2009, 14(6): 650. DOI:10.3109/10837450902911911 |
| [16] |
王静, 王雄飞, 王洁敏, 等. 琥珀酸去甲文拉法辛缓释片的制备及体外释药特性研究[J]. 中国现代应用药学, 2016, 33(7): 912. WANG J, WANG XF, WANG JM, et al. Preparation of desvenlafaxine succinate sustained-release tablets and study of release behavior in vitro[J]. Chin J Mod Appl Pharm, 2016, 33(7): 912. |
 2018, Vol. 38
2018, Vol. 38 
