2. 常州市食品药品监督检验中心, 常州 213002
2. Changzhou Institute for Drug Control, Changzhou 213002, China
成盐是改善药物分子理化性质, 提高其成药性的有效手段之一,活性化合物可能是酸、碱或中性分子,如果是酸或碱,则可在不改变其化学结构的基础上,通过最后一步成盐来优化其理化性质、药动学性质等[1-2],提高成药性; 据统计,以盐酸盐形式成盐的药物最多,占53.4% [3]。在化学对照品标定中,通常采用质量平衡法对化学对照品进行赋值,而质量平衡法计算含量[含量=(1-杂质%)×(1-水分%-挥发性物质%-灰分%-成盐离子%)×100%][4]公式中虽含有成盐离子项,但通常无法采用HPLC色谱法直接测定成盐离子。以往此项经常采用Cl-检查来确定是否成盐,只能做到定性鉴别。对于成盐化合物,如果以碱基对其进行赋值,则需要准确测定成盐离子的含量;如果以成盐形式对其进行赋值,则必须保证该化合物是成盐完全的,否则采用质量平衡法赋值的结果将出现错误。因此,在实际标定工作中,需要建立一个通用、准确的检测方法对成盐情况进行测定。考虑到离子抑制色谱(IC)具有快速、方便, 灵敏度高,可同时分析多种离子化合物,分离柱的稳定性好,容量高,样品用量少,易实现自动化等优点[5],且该方法即可以测定样品中的无机离子[6-10],亦可用于测定样品中主成分的含量[11-13],因此,本文以维生素BT、盐酸克仑特罗、盐酸胺碘酮杂质Ⅰ为例,建立离子色谱法测定化学对照品中盐酸盐含量。经测定,该方法准确,灵敏度高,专属性强,可以作为一个通用的检测方法。
1 仪器与试药DIONEX ICS-3000离子色谱仪(美国Dionex公司)配有抑制性电导检测器、EGCIIKOH淋洗液自动发生装置和ASRS-300阴离子自动再电解抑制器,对照品维生素BT(批号101399-201402)、盐酸克仑特罗(批号100072-A 100072-B)与盐酸胺碘酮杂质Ⅰ(批号101399-201601)均来自于中国食品药品检定研究院,其原料均源于企业。盐酸克仑特罗USP对照品(批号F01214)购自美国药典委员会,Cl-标准溶液(批号GBW(E)080268,含量1 000 μg·mL-1,中国计量科学院),氢氧化钾淋洗液(Dionex EGC Ⅲ KOH,序列号130792941011),水为超纯水。
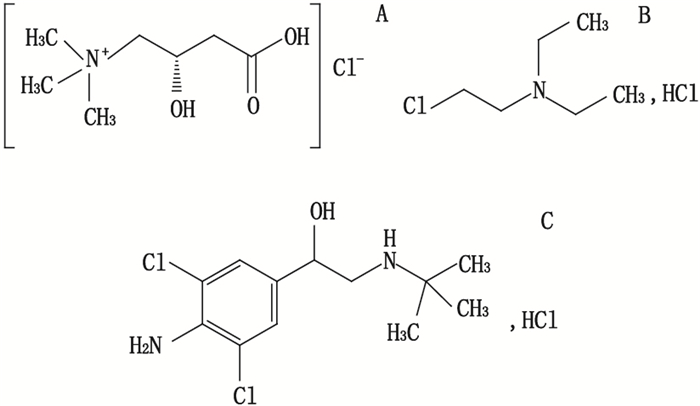
|
图 1 维生素BT(A)、盐酸胺碘酮杂质Ⅰ(B)与盐酸克仑特罗(C)的化学结构图 Figure 1 Chemical structures of vitamin BT (A), amiodarone hydrochloride impurity Ⅰ(B) and clenbuterol hydrochloride (C) |
采用DIONEXIonPacAS18(250 mm×4 mm)阴离子交换色谱柱,IonPac AG18(50 mm×4 mm)保护柱,以淋洗液发生器产生的22 mmol·L-1氢氧化钾溶液做流动相,流速1.0 mL·min-1,检测方式为电导检测器,检测池温度35 ℃,柱温30 ℃,进样体积10 μL,采用Chromeleon 6.8色谱工作站用于数据采集与处理,此条件下典型的色谱图见图 2。
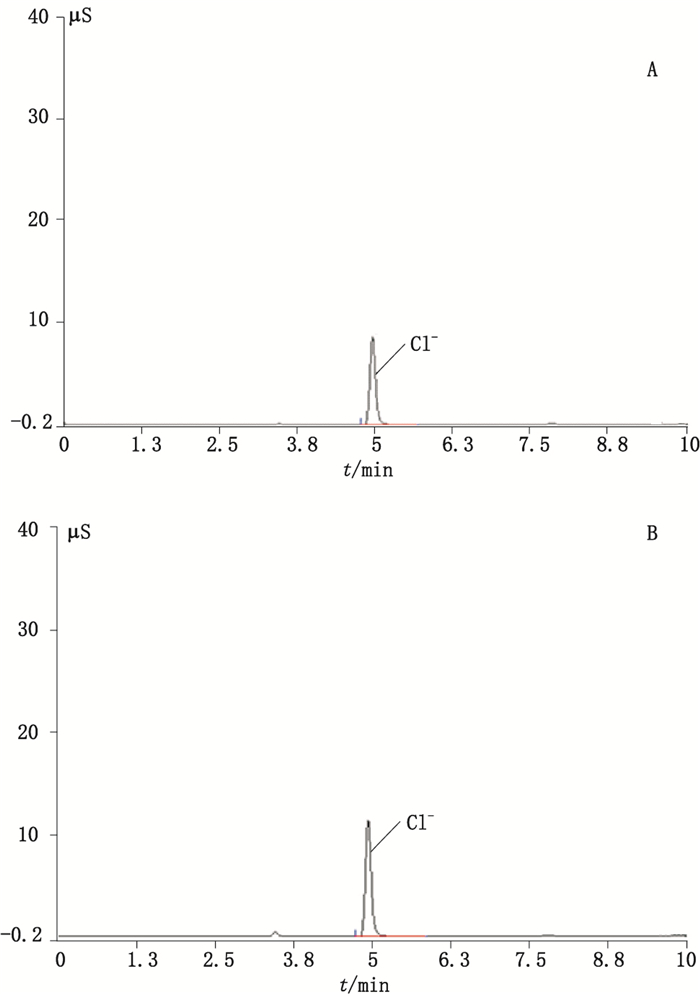
|
A.Cl-标准曲线溶液(solution for Cl-standard curve) B.盐酸克仑特罗(100072-A)溶液[(clenbuterol hydrochloride solution) 图 2 含量测定色谱图 Figure 2 Chromatograms of assay |
精密称取维生素BT、盐酸胺碘酮杂质Ⅰ与盐酸克仑特罗原料适量,加去离子水溶解并稀释至含Cl-质量浓度约为10 ug·mL-1,摇匀,即得对照品溶液。
2.3 方法学的考察 2.3.1 线性关系考察精密量取Cl-标准溶液4 mL,置100 mL量瓶中,用去离子水稀释并定容至刻度,作为标准曲线溶液①(相当于40 μg·mL-1),再精密量取标准曲线溶液①25、5、3、2、1 mL,分别置50、20、20、20、20 mL量瓶中,用去离子水稀释并定容至刻度作为标准曲线溶液②(相当于20 μg·mL-1)、③(相当于10 μg·mL-1)、④(相当于6 μg·mL-1)、⑤(相当于4 μg·mL-1)与⑥(相当于2 μg·mL-1)。
以标准曲线溶液①~⑥色谱图中峰面积A对质量浓度C进行线性回归,得回归方程:
| $ A=0.105 \ 0C-0.029 \ 5 \ \ \ \ r=0.999 \ 9 $ |
表明本品质量浓度在0.002~0.04 mg·mL-1范围内与峰面积呈良好的线性关系。
2.3.2 回收率试验精密称取盐酸克仑特罗(批号100072-A)对照品约12 mg至50 mL量瓶中,用去离子水溶解并定容至刻度,从中量取10 mL至量瓶中,分别加入Cl-标准曲线溶液①4、6与8 mL,用去离子水定容至25 mL,制成低、中、高3个水平的溶液各3份,将上述溶液按“2.1”项色谱条件进行测定,平均回收率分别为100.5%、99.6%与100.8%,RSD为1.3%(n=9)。
2.3.3 精密度与重复性试验取“2.3.1”项下标准曲线溶液④,连续进样6次,Cl-峰面积的RSD为1.5%;精密称取盐酸胺碘酮杂质Ⅰ适量,配制6份质量浓度约为13 μg·mL-1的溶液,测定Cl-含量分别为20.31%、20.76%、20.52%、20.60%、20.49%、20.03%,平均值为20.45%,RSD为1.2%(n=6)。结果表明精密度与重复性良好。
2.3.4 检测下限取Cl-标准曲线溶液,逐步稀释,按信噪比大于3计算,Cl-的检测下限为0.18 μg·mL-1。
2.4 样品测定取样品溶液,按“2.1”项色谱条件进行测定,典型色谱图见图 2,采用标准曲线法[14]计算样品中Cl-的含量,各样品中的Cl-含量的理论值按分子式中所含Cl-百分含量计,结果见表 1。
|
|
表 1 样品中Cl-的含量测定结果 Table 1 Results of the content of Cl- in the samples |
采用建立的离子色谱法测定维生素BT、盐酸胺碘酮杂质Ⅰ、盐酸克仑特罗(批号100072-A)原料与USP对照品中的Cl-含量均与其理论值基本一致,说明成盐完全;而盐酸克仑特罗(批号100072-B)原料中Cl-含量低于其理论值。作者在标定该批对照品原料时,采用USP对照品测定[15],分别按成盐形式与碱基计算其含量为101.90%与90.04%,对标结果偏高;采用对苯二酚为内标,氘代甲醇为溶剂,建立了一个新的含量测定方法(核磁定量法,见图 3)测定其含量,按成盐相对分子质量为313.65计算,结果为101.69%(RSD=0.49%,n=6),仍然偏高,按碱基相对分子质量277.15计算,结果为89.86%,与按碱基计算质量平衡法的结果90.57%基本一致。结合Cl-测定结果进行分析,可知由于100072-B批次成盐不完全,而采用HPLC法进行含量对标是以碱基的色谱峰进行计算的,因此结果偏高。此外还需要注意的是,在采用HPLC法测定含有盐酸盐的化合物(如维生素BT)时,需注意在检测波长较低时,如220 nm以下,盐酸会在溶剂峰附近有较明显的出峰,不要把此峰计入杂质。
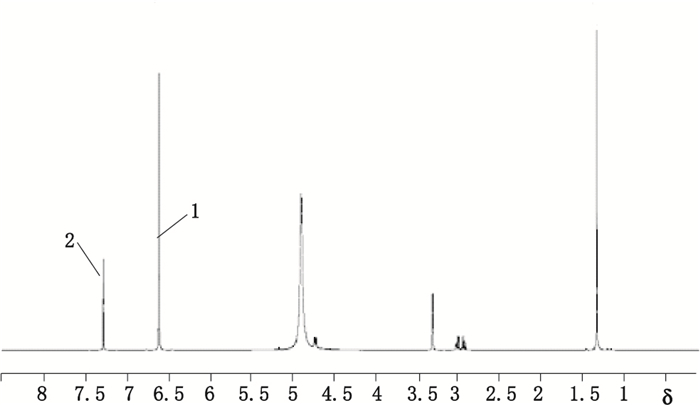
|
1.内标(IS) 2.盐酸克仑特罗苯环上的2个氢信号(2H of phenyl ring of clenbuterol hydrochloride) 图 3 盐酸克仑特罗氢谱中的各峰信号 Figure 3 Peak signals of clenbuterol hydrochloride in 1H-NMR spectrum |
在化学对照品标定过程中,需要采用多种方法对对照品的赋值进行分析和确证,采用离子色谱法测定对照品中的成盐离子的含量将为准确赋值提供另一项技术保证。
| [1] |
成燕. 盐酸阿扎司琼成盐工艺研究[J]. 上海医药, 2007, 28(4): 182. CHENGY. Study on salt-forming process of the Azastron hydrochloride[J]. Shanghai Med Pharma J, 2007, 28(4): 182. |
| [2] |
张卫, 陈年根, 黄剑, 等. 盐酸洛哌丁胺的合成及成盐工艺研究[J]. 广东化工, 2012, 39(232): 75. ZHANG W, CHEN NG, HUANG J, et al. Study on synthetic and salifying process of loperamide hydrochloride[J]. Guangdong Chem Ind, 2012, 39(232): 75. |
| [3] |
沈芳, 苏颀, 周伟澄. 成盐药物的研究与开发[J]. 药学进展, 2012, 36(4): 151. SHEN F, SU Q, ZHOU WC. Research and development of pharmaceutical salts[J]. Prog Pharm Sci, 2012, 36(4): 151. |
| [4] |
冯艳春, 刘书妤, 胡昌勤. 比阿培南标准物质的研制[J]. 中国抗生素杂志, 2010, 35(9): 679. FENG YC, LIU SY, HU CQ. Establishment of national reference standard of biapenem[J]. Chin J Antibiot, 2010, 35(9): 679. |
| [5] |
刘英, 李茜. 离子色谱在抗生素药物分析中的应用[J]. 药物分析杂志, 2012, 32(1): 179. LIU Y, LI Q. Application of ion chromatography method in analysis of antibiotics[J]. Chin J Pharm Anal, 2012, 32(1): 179. |
| [6] |
韩春霞, 梁立娜, 范慧红. 离子色谱法测定达肝素钠中的亚硝酸根[J]. 药物分析杂志, 2011, 31(11): 2173. HAN CX, LIANG LN, FAN HH. Determination of nitrite in dalteparin sodium by ion chromatography[J]. Chin J Pharm Anal, 2011, 31(11): 2173. |
| [7] |
钱敏, 耿志旺, 彭茗, 等. 离子色谱法测定头孢曲松钠中的钠离子含量以及成盐率[J]. 药物分析杂志, 2015, 35(3): 435. QIAN M, GENG ZW, PENG M, et al. Determination of sodium ion and salt-forming rate in ceftriaxone sodium by ion chromatography[J]. Chin J Pharm Anal, 2015, 35(3): 435. |
| [8] |
李继, 于海涛, 王莉, 等. 离子色谱法测定奥沙拉嗪钠原料药中甲磺酸的含量[J]. 药物分析杂志, 2013, 33(8): 1359. LI J, YU HT, WANG L, et al. Ion chromatography detection of residual methylsulfonic acid in olsalazine sodium raw medicine[J]. Chin J Pharm Anal, 2013, 33(8): 1359. |
| [9] |
杨倩, 袁雯玮. 离子色谱法测定盐酸平阳霉素中的氯离子[J]. 中国抗生素杂志, 2015, 40(7): 523. YANG Q, YUAN WW. Determination of chloridion in bleomycin A5 hydrochloride by ion chromatography[J]. Chin J Antibiot, 2015, 40(7): 523. |
| [10] |
冯光, 李苗. 离子色谱法测定口服补液盐散(Ⅱ)中总钠和钾的含量[J]. 药物分析杂志, 2013, 33(6): 1072. FENG G, LI M. IC determination of total sodium and potassium in oral rehydration salt powder(Ⅱ)[J]. Chin J Pharm Anal, 2013, 33(6): 1072. |
| [11] |
山广志, 宗艳平, 王晓. 离子色谱法测定三磷酸腺苷二钠制剂中主成分及有关物质的含量[J]. 色谱, 2012, 32(1): 179. SHAN GZ, ZONG YP, WANG X. Determination of principal components and related substances in adenosine disodium triphosphate preparation by ion chromatography[J]. Chin J Chromatogr, 2012, 32(1): 179. |
| [12] |
王棘, 杨宏伟, 刘晓菲. 离子色谱法测定伊班膦酸钠原料中伊班膦酸的含量[J]. 药物分析杂志, 2014, 34(12): 2257. WANG J, YANG HW, LIU XF. Determination of ibandronate in ibandronate sodium by ion chromatography[J]. Chin J Pharm Anal, 2014, 34(12): 2257. |
| [13] |
胡咪, 苏晓春, 贺冰, 等. 硫酸依替米星注射液中亚硫酸钠的离子色谱法测定[J]. 中国医药工业杂志, 2016, 47(5): 604. HU M, SU XC, HE B, et al. Determination of sodium sulfite in etimicin sulfate injection by ion chromatography[J]. Chin J Pharm, 2016, 47(5): 604. |
| [14] |
中华人民共和国药典2015年版. 四部[S]. 2015: 513 ChP 2015. Vol Ⅳ[S]. 2015: 513 |
| [15] |
BP 2014[S]. 2014: 1409
|
 2018, Vol. 38
2018, Vol. 38 
