2. 中国药科大学药物分析教研室, 南京 210009
2. Department of Pharmaceutical Analysis, China Pharmaceutical University, Nanjing 210009, China
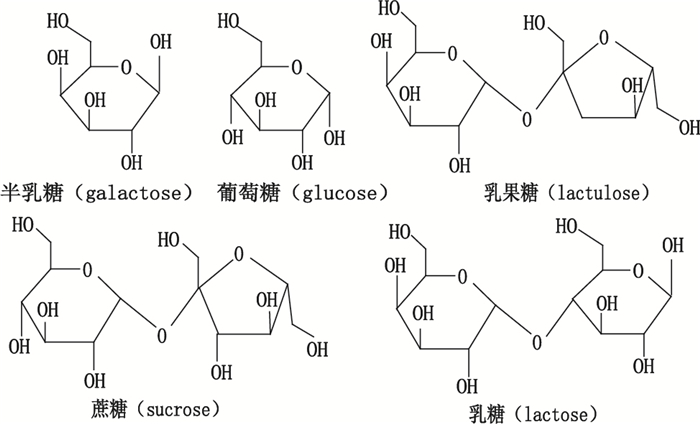
乳糖是天然存在于动物乳液中的还原性二糖,人乳中含5%~8%,牛乳中含4%~5%,由一分子葡萄糖和一分子半乳糖所构成(图 1),有变旋现象。在医药工业中,可用于药品的甜味剂和赋形剂,根据药品剂型需要可制成结晶乳糖、直压乳糖和预混乳糖辅料[1-3]。乳糖含量及有关物质反映了产品质量和营养价值。因此,建立一个简便快速、灵敏准确的分析方法,对于区别乳糖优劣和控制产品工艺等都有重要的指导作用。
|
图 1 半乳糖、葡萄糖、乳果糖、蔗糖和乳糖分子结构式 Figure 1 Molecular structural formula of galactose, glucose, lactulose, sucrose and lactose |
2015年版《中华人民共和国药典》(以下简称中国药典)[4]中乳糖含量和有关物质测定采用的是高效液相色谱-示差折光检测法(HPLC-RID),其灵敏度低,受环境影响波动较大,易出现基线不稳、色谱峰形较差、色谱柱使用寿命短等问题。
目前,国内外有关糖类检测方法的报道很多,大致分为两大类:一类是酶学方法[5],该法准确度和专属性较差,同时酶的来源与纯化也存在较大问题;另一类是色谱法,主要包括气相色谱法[6]、液质联用法[7-8]、离子色谱-脉冲安培检测法[9]、HPLC-RID法[4]和液相色谱蒸发光散射检测法[10-11]等。其中,气相色谱和液质联用法需要衍生处理,操作烦琐;离子色谱-脉冲安培检测器法仪器使用成本较高,稳定性较差,色谱条件严格;液相色谱法普遍使用RID法和蒸发光散射法测定乳糖含量及有关物质,大多存在衍生化处理,灵敏度低,重现性差等缺陷。乳糖分子极性较大,结构中没有强生色官能团,紫外吸收较弱,无法采用常用的反相液相色谱-紫外检测器进行准确的定性与定量测定[12]。电喷雾检测器(CAD)是近年来发展起来的一种新型检测器,灵敏度高,通用,其原理是基于雾化-气溶胶的HPLC检测器,通过Corona电晕针使氮气带电,而后将带电氮气与经干燥过的洗脱液中的溶质颗粒逆向充分混合,带电氮气的电荷转移,使溶质颗粒带电后,进入静电计检测电信号值。该检测信号响应不依赖于化合物的化学结构,与溶质质量成正比关系。CAD与紫外检测器、RID和蒸发光散射检测器相比,灵敏度高,重现性好,可直接分离测定单糖和二糖等低聚糖[12-18]。目前尚未见采用高效液相色谱-电喷雾检测器(HPLC-CAD)法同时测定乳糖含量及有关物质的文献报道。
本研究建立了测定乳糖含量及有关物质的HPLC-CAD法,专属性强,灵敏度较高,受环境影响波动较小,色谱峰形较优。与现行标准收载的方法相比较,样品分析量较小,对缩短色谱柱平衡时间和延长色谱柱使用寿命都极为有利。采用UPLC-Q-TOF质谱法对主要有关物质结构进行推定,并将HPLC-CAD法样品分析结果与示差折光检测器法测定结果进行比较,可为乳糖的质量控制提供新的技术手段。
1 材料 1.1 药品与试剂乳糖辅料(镇江市康富生物工程有限公司;批号:20140801、20140802、20140803);乳糖粗品(南京威尔化工有限公司提供);葡萄糖、半乳糖、蔗糖、乳果糖和乳糖对照品均购自中国食品药品检定研究院;乙腈(HPLC级,Thermo Fisher Scientific公司);超纯水(Millipore公司),其他未注明试剂均为分析纯。聚合物填料基质的氨基色谱柱,型号分别为Shodex Asahipak NH2P-50 4E(4.6 mm×250 mm,5 μm)和Grace Prevail Carbohydrate ES(4.6 mm×250 mm,5 μm)。
1.2 仪器UltiMate 3000高效液相色谱仪(Thermo Fisher Scientific公司,美国)、电喷雾式检测器(型号:Corona Veo SD,美国Thermo Fisher Scientific公司),色谱工作站:Chromeleon 7.0 SR10;UPLC-Q-TOF液质联用仪(Agilent和美国布鲁克公司);CPA225D、XS205DU型电子天平(德国Sartorius公司)。
2 方法与结果 2.1 色谱和质谱条件 2.1.1 色谱条件色谱柱为聚合物填料基质的氨基柱,型号分别为Shodex Asahipak NH2P-50 4E(4.6 mm×250 mm,5 μm)和Grace Prevail Carbohydrate ES(4.6 mm×250 mm,5 μm);流动相为乙腈-水(75:25);流速1.0 mL·min-1;柱温30 ℃;电喷雾检测器(雾化温度:35 ℃;幂率:1.15;采样频率:10 Hz;过滤常数:3.6 s);溶剂:50%乙腈;进样量20 μL。在此条件下,供试品溶液中主成分色谱峰形较好,不受其他成分干扰。
2.1.2 质谱条件离子化方式:ESI(+);质量扫描范围:m/z 50~1 000;毛细管电压4 500 V;干燥气(N2),流速7.0 L·min-1;干燥气压力:350 kPa;干燥气温度:180 ℃;流速1.0 mL·min-1;进样量:10 μL;分流比:7:3;柱温:30 ℃。
2.2 溶液的制备 2.2.1 系统适用性溶液精密称取半乳糖、葡萄糖、乳果糖、蔗糖和乳糖的对照品适量,置100 mL量瓶中,混合均匀,加50%乙腈溶解并稀释至刻度,作为系统适用性溶液。
2.2.2 系列对照品溶液取乳糖对照品约10. 0 mg,精密称定,置20 mL量瓶中,加50%乙腈溶解并稀释至刻度,摇匀,作为对照品储备液;精密吸取该储备液适量,加50%乙腈分别制成浓度为1.0、5.0、10.0、20.1、50.2、100.4 μg·mL-1的溶液,作为系列对照品溶液。
2.2.3 含量测定溶液供试品溶液:精密称取乳糖样品约100.0 mg,置100 mL量瓶中,加50%乙腈溶解并稀释至刻度,摇匀,精密量取1.0 mL,置50 mL量瓶中,加50%乙腈稀释定容至刻度,即得。
对照品溶液:精密吸取乳糖对照品储备液适量,置25.0 mL量瓶中,加50%乙腈稀释定容至刻度,摇匀,制得乳糖对照品溶液(20.0 μg·mL-1)。
2.2.4 有关物质溶液取乳糖样品约100.0 mg,精密称定,置50 mL量瓶中,加50%乙腈适量,超声(42 kHz)使溶解,用50%乙腈稀释至刻度,摇匀,作为有关物质测定用供试品溶液(2.0 mg·mL-1)。精密量取供试品溶液1.0 mL,置100 mL量瓶中,加50%乙腈稀释定容至刻度,作为对照溶液(20.0 μg·mL-1)。
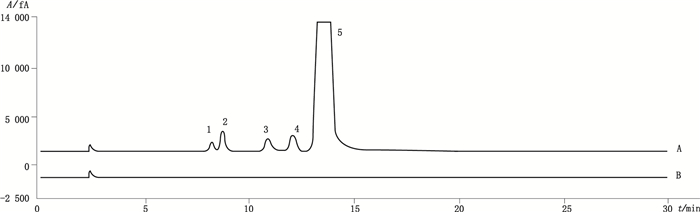
2.3 专属性 2.3.1 系统适用性试验精密吸取系统适用性性溶液及空白溶液各20 μL,注入液相色谱仪,记录色谱图(图 2),结果表明,溶剂对主峰无干扰,各已知杂质峰之间以及杂质峰与乳糖主峰之间均能有效分离,以乳糖色谱峰计算理论塔板数大于5 000,拖尾因子小于1.2。
|
1.半乳糖(galactose) 2.葡萄糖(glucose) 3.乳果糖(lactulose) 4.蔗糖(sucrose) 5.乳糖(lactose) 图 2 系统适用性溶液(A)、空白溶液(B)高效液相色谱图 Figure 2 HPLC chromatograms of resolution solution(A)and blank solution(B) |
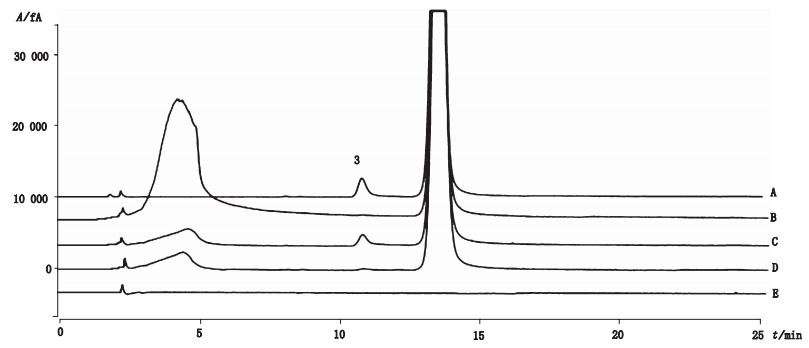
乳糖供试品经过酸(0.1 mol·L-1盐酸溶液)、碱(0.1 mol·L-1氢氧化钠溶液)、氧化(30% H2O2)和高温(105 ℃)破坏后,取破坏后溶液20 μL,注入液相色谱仪,依“2.1”项下色谱条件分离,记录色谱图(图 3)。结果显示,乳糖供试品在酸性和氧化破坏条件下较稳定,但在碱性或高温破坏下易使乳糖发生异构化反应生成乳果糖[19-20],经考察,该方法对乳糖有良好的专属性,对可能的降解产物及有关物质有良好的分离效果。
|
3.乳果糖(lactulose) A.高温破坏溶液(heat stress solution) B.氧化破坏溶液(oxidative stress solution) C.碱破坏溶液(alkali stress solution) D.酸破坏溶液(acid stress solution) E.空白溶液(blank solution) 图 3 破坏试验色谱图 Figure 3 The chromatograms of stress solution |
取“2.2.3”项下的同一供试品溶液,依“2.1”项下条件连续测定6次,记录乳糖色谱峰保留时间和峰面积。结果乳糖保留时间的RSD为0.06%,峰面积的RSD为1.1%,表明本法精密度良好。
2.4.2 重复性取同一批号乳糖样品6份,按“2.2.3”项下方法制备供试品溶液,按上述色谱条件以外标法测定含量。结果含量平均值为100.5%(n=6),RSD为0.90%。
2.5 检测下限(LOD)和定量下限(LOQ)取浓度为20.0 μg·mL-1乳糖对照品溶液,逐步稀释至合适浓度,按信噪比(S/N)约为3:1计算,乳糖的检测下限为8.03 ng,按信噪比(S/N)约为10:1计算,乳糖的定量下限为20.08 ng。
2.6 线性与范围精密吸取“2.2.2”项下的系列对照品溶液各20 μL,注入液相色谱仪,记录色谱图。以乳糖峰面积积分值(Y)为纵坐标,对照品溶液质量浓度(X)为横坐标,绘制工作曲线,得到回归方程:
| $ Y=33.265X+37.91 \ \ \ \ r =0.999 \ 8 $ |
结果表明,乳糖在1.0~100.4 μg·mL-1范围内呈良好的线性关系。
2.7 溶液稳定性取同一供试品溶液,分别于0、2、4、6、8、10、12 h进样分析。测得乳糖峰面积的RSD为1.7%,表明供试品溶液在12 h内稳定性良好。
2.8 耐用性本文采用了2款不同品牌聚合物氨基色谱柱Shodex Asahipak NH2P-50 4E和Grace Prevail carbohydrate ES。通过调节柱温、流速和流动相比例,考察乳糖主峰与可能的杂质之间的分离度及主峰的拖尾因子变化情况,结果表明,拖尾因子均小于1.2,蔗糖与乳糖峰间分离度均大于1.5,可见方法耐用性良好。
2.9 含量测定取乳糖样品按“2.2.3”项下方法制备供试品溶液和对照品溶液,每批样品制备2份,每份样品进样2次,按外标法以峰面积计算样品的含量。同时将测定结果与现行标准收载的HPLC-RID法进行对比,结果(表 1)表明,2种方法含量测定结果一致。
|
|
表 1 2种方法的含量测定结果(%) Table 1 Results of the determination of lactose content by two methods |
分别取乳糖样品,按“2.2.4”项下方法和2015年版中国药典收载的HPLC-RID法制备供试品溶液和对照溶液,分别进样分析。
实验对半乳糖、葡萄糖、乳果糖和蔗糖(结构式见图 1)与乳糖主成分的相对响应因子进行计算,分别为2.11、0.70、0.71和0.76。结果显示,半乳糖、葡萄糖和乳果糖对于乳糖的相对响应因子均超出0.9~1.1的范围。
已知杂质采用加校正因子的自身对照法来测定,未知杂质采用不加校正因子的自身对照法来测定,低于检测限的杂质可忽略不计。将HPLC-CAD和HPLC-RID 2种方法测定结果进行比较,结果(表 2)表明,HPLC-CAD法检出的杂质量及杂质个数均高于HPLC-RID法。
|
|
表 2 2种方法的有关物质测定结果(%) Table 2 Results of the determination of related substances by two methods |
查阅文献,未见有对乳糖中有关物质结构进行推定的报道,实验采用UPLC-Q-TOF法对乳糖辅料中的有关物质结构进行推定。
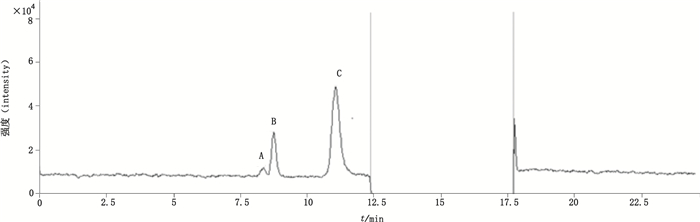
经过电喷雾正离子化UPLC-Q-TOF检测,通过HPLC上的保留时间及质谱图中的质荷比2个参数,推定在8.4 min左右洗脱的杂质A是半乳糖,在8.9 min左右洗脱的杂质B是葡萄糖,在11.3 min左右洗脱的杂质C是乳果糖。其中杂质峰A、B是乳糖的主要降解产物,杂质C是乳糖的同分异构体,见图 4和表 3。
|
图 4 乳糖样品的UPLC-Q-TOF提取离子色谱图 Figure 4 Extracted ion chromatogram of lactose sample by UPLC-Q-TOF |
|
|
表 3 乳糖质谱参数 Table 3 Parameters of mass spectra for lactose determination |
乳糖是一类强亲水性化合物,在ODS柱上保留较弱,难以与其他低聚糖成分分离测定。目前主要采用氨基色谱柱分析测定乳糖[5-7],根据填料和键合技术的不同,可将氨基色谱柱分为杂化氨基柱、硅胶氨基柱和聚合物氨基柱[11]。参考文献[10, 13]的实验结果,发现聚合物氨基色谱柱耐用性较好,实验考察色谱柱在连续进样超过300次后,柱效仍然大于5 000,且各色谱峰间分离度良好。故本文选择两款不同品牌聚合物氨基色谱柱Shodex Asahipak NH2P-50 4E和Grace Prevail carbohydrate ES进样分析筛选,综合考虑价格、寿命、耐用性、峰形等因素,选择Shodex Asahipak氨基柱进行方法建立。
3.2 流动相及样品溶剂的选择流动相中水相和有机相的比例对检测方法灵敏度、分离度和分析时间影响较大,增加水相比例有利于糖类的溶解,峰形比较尖锐,但不利于各组分间的分离。相反,增加有机相会使峰形变宽,分析时间延长[8]。本文选择乙腈-水(65:35、75:25、80:20)的不同配比作为流动相进行筛选。综合考虑上述因素,在保证各组分基本分离的情况下,争取提高灵敏度和缩短分析时间,最终选择乙腈-水比例为75:25的溶液作为流动相。
考虑到目标化合物的溶解行为和溶剂效应,实验针对乙腈和水的不同配比作为样品溶剂进行摸索,最终选定乙腈-水比例为50:50作为样品溶剂。在该溶剂体系下,乳糖溶解较好,且色谱信号较强,峰形较好。
3.3 检测器参数优化影响CAD的参数主要有3个:第一,雾化温度。CAD需要加热溶剂进行雾化,雾化程度对CAD响应信号也会产生一定影响,考察雾化温度LOW(35 ℃)和HIGH(50 ℃)2档,结果发现2档温度的背景噪音和信号响应并没有显著差异,选用35 ℃档作为雾化温度,更接近于洗脱的柱温条件,且不会产生因温差等造成的波动影响;第二,采样频率和过滤常数。比较不同的采集频率和过滤模式发现,随着采集频率和过滤常数的增加,基线噪音影响较小,色谱峰平滑度更好,最终选择10 Hz采样频率和3.6 s的过滤常数,该条件下获得的色谱图较为平滑,色谱峰采样点数量充足;第三,幂率(power function value,PFV)。PFV是CAD检测器所特有的线性校正参数,相当于线性校正因子,可提高检测器的“线性”响应,不同的化合物具有不同的最优PFV值,考察不同的PFV参数值(1.00、1.10、1.15),对乳糖对照品工作溶液进样分析,并对色谱峰面积和样品浓度进行线性拟合,结果见表 4。对比不同参数条件下的线性相关系数发现,乳糖分析时PFV参数为1.15线性最优。
|
|
表 4 PFV参数优化 Table 4 PFV parameter optimization |
在兼顾色谱柱保护、峰形和良好线性的基础上,本实验最终选择35 ℃雾化温度;10 Hz/3.6 s采集频率和过滤常数;1.15 PFV值作为最优仪器参数。
3.4 系统适用性溶液确定在样品分析时发现,乳糖辅料中可能存在半乳糖、葡萄糖和乳果糖等杂质,查阅现行标准收载的HPLC-RID法,只要求了乳糖与蔗糖之间的分离度,并未考察上述几种糖之间以及与主成分之间的分离情况。为了更好地控制乳糖辅料的质量,本研究在满足法定标准要求的基础上,将半乳糖、葡萄糖和乳果糖均列入系统适用性考察项目。由“2.3”的实验结果可见,本文建立的方法能有效分离半乳糖、葡萄糖、乳果糖和蔗糖,且不干扰主成分的测定。
3.5 样品含量和有关物质测定浓度的确定目前尚无法定标准和专门的书籍论述含量及有关物质测定浓度的确定。质量标准制定时,一般含量测定浓度的设定应在满足线性、准确度、精密度等方法学要求的基础上尽量采用低浓度。因为浓度越低越有利于色谱柱的保护,同时低浓度时峰面积小,峰柱效提高,对称性好,积分准确[21],故本文选择20.0 μg·mL-1作为含量测定的浓度。有关物质分析时,浓度越高越能反映样品中杂质存在的情况,但若设定过高,会产生峰严重拖尾、裂峰、柱超载和检测器超载等现象。参考药典标准中乳糖的含量和有关物质测定浓度的设定,本文选择2.0 mg·mL-1作为有关物质测定的浓度。
3.6 破坏实验峰分析破坏实验色谱图中5 min左右的峰可能是破坏溶液中的不挥发性物质。因为CAD对所有难挥发性化合物均有响应,而氧化、酸、碱等破坏溶液中的钠盐等均属于难挥发性化合物,且在色谱柱中保留较弱,因此在5 min左右洗脱出峰。但由图 3可见,该峰对乳糖主要破坏产物—乳果糖并不产生干扰。
3.7 与HPLC-RID法的比较将HPLC-CAD法与HPLC-RID法的灵敏度、色谱行为、分离效果及样品溶液浓度进行对比,详见表 5,结合2种方法的含量测定及有关物质分析结果,可见新建立的方法色谱行为较好,准确度高,分离能力较强,且灵敏度更高。
|
|
表 5 HPLC-CAD和HPLC-RID法比较 Table 5 The comparison of HPLC-CAD and HPLC-RID methods |
本研究建立了乳糖含量及有关物质的HPLC-CAD方法,并采用联用技术对主要有关物质的结构进行推定。与现行标准收载的方法比较,该法的专属性更强,灵敏度更高、色谱柱更好,具有一定的可行性和实用性,易于推广和应用。可为药用辅料乳糖的质量控制提供参考。
| [1] |
萧三贯. 最新国家药用辅料标准手册[M]. 北京: 中国医药科技出版社, 2006, 595. XIAO SG. The Latest National Pharmaceutical Excipients Standards Manual[M]. Beijing: Chinese Medical Science and Technology Electronic Publishing House, 2006, 595. |
| [2] |
魏奎, 谷庆芳. 乳糖在人体内的营养特性[J]. 食品研究与开发, 2012, 33(3): 187. WEI K, GU QF. Lactose in the human body's nutritional characteristics[J]. Food Res Dev, 2012, 33(3): 187. |
| [3] |
顾佳升, 夏静. 乳糖及其代谢障碍[J]. 乳业科学与技术, 2003, 27(1): 17. GU JS, XIA J. Lactose and its metabolic disorder[J]. Dairy Sci Technol, 2003, 27(1): 17. |
| [4] |
中华人民共和国药典2015年版. 四部[S]. 2015: 524 ChP 2015. Vol Ⅳ[S]. 2015: 524 |
| [5] |
于国平, 于广吉, 赵敏. 酶法测定乳糖[J]. 中国乳品工业, 1998, 26(5): 34. YU GP, YU GJ, ZHAO M. Enzyme method determination of lactose[J]. Chin Dairy Ind, 1998, 26(5): 34. |
| [6] |
BECKER M, LIEBNER F, ROSENAU T, et al. Ethoximation-silylation approach for mono-and disaccharide analysis and characterization of their identification parameters by GC/MS[J]. Talanta, 2013, 115(13): 642. |
| [7] |
ERIC CH, WAN, JIAN ZY. Determination of sugar compounds in atmospheric aerosols by liquid chromatography combined with positive electrospray ionization mass spectrometry[J]. J Chromatogr A, 2006, 1107(1): 175. |
| [8] |
HU Q, XU HB, LI SJ, et al. Simultaneous determination of lactulose, mannitol and lactose in urine with liquid chromatography tandem mass spectrometry (LC-MS/MS) method[J]. Chin J Mod Med, 2008, 18(13): 1810. |
| [9] |
XIONG JF, ZHOU GM, XU L, et al. Determination of glucose, sucrose and lactose in milk powder by ion chromatography[J]. Food Sci, 2012, 33(8): 176. |
| [10] |
梁纪军, 刘瑞芝, 汪玉梅, 等. 高效液相色谱-蒸发光散射法测定果维康VC含片中果糖、葡萄糖、蔗糖、乳糖、麦芽糖的含量[J]. 中国卫生检验杂志, 2008, 18(12): 2593. LIANG JJ, LIU RZ, WANG YM, et al. Determination of fructose, glucose, sucrose, lactose and maltose in Guoweikang VC tablets by HPLC-ELSD[J]. Chin J Health Lab Technol, 2008, 18(12): 2593. DOI:10.3969/j.issn.1004-8685.2008.12.056 |
| [11] |
CHEN QM, LIU WY. The application of HPLC-ELSD in the analysis of traditional Chinese medicine (TCM) sugar[J]. Chin Tradit Herb Drugs, 2008, 39(6): 955. |
| [12] |
YOU ZQ, YANG Y, XU QL, et al. Determination of fructose, galactose, glucose, sucrose, lactose, maltose in dairy products by HPLC-CAD[J]. Dairy Ind, 2015, 43(6): 55. |
| [13] |
MALGORZATA G, ANNA L, PIOTR S. Simultaneous separation and determination of erythritol, xylitol, sorbitol, mannitol, maltitol, fructose, glucose, sucrose and maltose in food products by high performance liquid chromatography coupled with charged aerosol detector[J]. Microchem J, 2014, 117(6): 77. |
| [14] |
杨勇, 吴琳琳, 罗弈, 等. HPLC-CAD法测定乳制品中果糖、葡萄糖、蔗糖、乳糖、半乳糖和麦芽糖的含量[J]. 中国食品添加剂, 2015, 9(9): 172. YANG Y, WU LL, LUO Y, et al. Determination of fructose, glucose, sucrose, lactose, galactose and maltose in dairy products by HPLC-CAD method[J]. China Food Add, 2015, 9(9): 172. |
| [15] |
林慧, 冯云, 颜春荣, 等. 糖类化合物分析方法研究进展[J]. 食品与药品, 2014, 16(6): 448. LIN H, FENG Y, YAN CR, et al. Progress in analysis methods for carbohydrates[J]. Food Drug, 2014, 16(6): 448. |
| [16] |
郑萍, 刘绿叶, 张艳海, 等. 采用混合模式色谱与电雾式检测器测定蛋白药物中的聚山梨醇酯20[J]. 药物分析杂志, 2013, 33(3): 465. ZHENG P, LIU LY, ZHANG YH, et al. Quantitation of polysorbate 20 in protein solutions using mixed-mode chromatography and charged aerosol detector[J]. Chin J Pharm Anal, 2013, 33(3): 465. |
| [17] |
周洁, 姜宏, 佐利民, 等. HPLC-CAD法测定替诺福韦酯类前药ODE-TFV中ODE残留[J]. 药物分析杂志, 2014, 34(8): 1481. ZHOU J, JIANG H, ZUO LM, et al. Determination of ODE residual amount in tenofovir ester prodrug ODE-TFV by HPLC-CAD[J]. Chin J Pharm Anal, 2014, 34(8): 1481. |
| [18] |
STYPULKA K, BLAZEWICZ Z, FIJALEK Z, et al. Determination of neomycin and related substances in pharmaceutical preparations by reversed-phase high performance liquid chromatography with mass spectrometry and charged aerosol detection[J]. J Pharm Biochem Anal, 2013, 76(25): 707. |
| [19] |
李凤林, 林明阳. 乳果糖制备方法与功能研究进展[J]. 饮料工业, 2012, 10(2): 9. LI FL, LIN MY. The function research progress and preparation method of lactulose[J]. Bever Ind, 2012, 10(2): 9. |
| [20] |
张中. 高纯度乳果糖的制备[D]. 无锡: 江南大学, 2010. ZHANG Z. Production of High Purity Lactulose[D]. Wuxi: Jiangnan University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10295-1011061074.htm |
| [21] |
谢沐风. 高效液相色谱法测定含量时关于确立色谱条件与溶液浓度的讨论[J]. 中国药品标准, 2008, 9(8): 288. XIE MF. Discussion about chromatographic conditions and solution concentration in content determination by HPLC[J]. Drug Stand China, 2008, 9(8): 288. |
 2018, Vol. 38
2018, Vol. 38 
