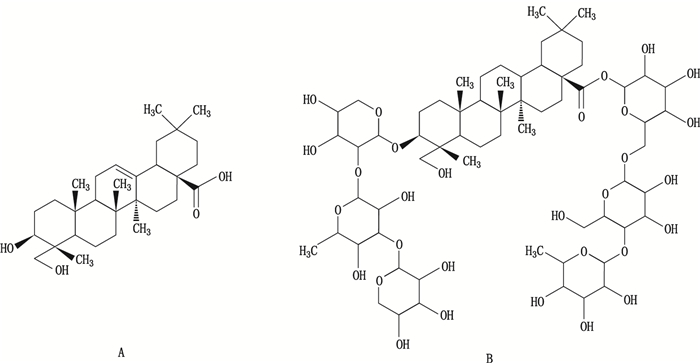
黑种草子(Nigellae Semen)为毛茛科(Raunnculaceae)黑种草属(Nigella)植物腺毛黑种草(Nigella glandulifera Freyn et Sint.)的干燥成熟种子,为中药及维吾尔族习用药(维吾尔族名:斯亚旦),在中国新疆、西藏、云南及地中海、埃及等地区都有分布。其性味甘、辛、温,有补肾健脑、通经、通乳、利尿等功效,用于耳鸣健忘、经闭乳少、热淋、石淋等症[1-2]。现代药理研究表明,黑种草子具有活血通经、抗血栓、抗炎镇痛、抗肿瘤及平喘祛痰等作用[3-12]。目前对于黑种草子的化学成分研究包括脂肪酸类、甾醇类、皂苷类、挥发油类、生物碱类、苯酚类及糖类[13-18]。黑种草子首次被收录于1977年版中国药典时仅有常规检查项,1985年版中国药典增加显微鉴别方法。虽然文献中以常春藤皂苷元或芦丁为指标成分的检测方法时有报道[19-22],但直到2010年版中国药典才首次以黑种草子中三萜皂苷类成分的酸水解产物常春藤皂苷元(结构式见图 1)为指标成分,增加薄层鉴别及高效液相含量测定方法,并沿用至2015年版中国药典。
|
图 1 常春藤皂苷元(A)和异株五加甲苷(B)结构式 Figure 1 Chemical structures of hederagenin(A)and sieboldianoside A(B) |
2015年版中国药典中黑种草子以常春藤皂苷元为指标成分进行质量控制,需要对样品进行水解,存在水解条件不易控制、水解不完全、水解产物不专一、耗时、专属性低等缺点。针对现行质量控制方法存在指标成分专属性不强、样品处理过程烦琐、检测成本高等缺陷,本文通过相关性研究,在不降低现有质量控制标准的基础上,建立了一个检验效率更高、检测成本更低、专属性好的黑种草子TLC定性和HPLC-ELSD定量质量标准方法。该方法不但可以作为黑种草子药材的质控方法,还可以用于复方制剂的质量控制(另文发表),实现了质控指标从药材到制剂的一致性,提高了分析结果的可靠性和科学性,为现行国家标准的提升提供更具科学性、合理性的试验依据。黑种草子中含量较高的异株五加甲苷结构式见图 1 [23]。
1 仪器与试药 1.1 仪器Agilent 1200高效液相色谱仪(包括1322A型在线真空脱气机、1311A型四元泵、1367B型自动进样器、1316A柱恒温箱、1315D型DAD检测器);Agilent 1260 Infinity蒸发光散射检测器;采用Boston Luna Clone C18色谱柱(4.6 mm×250 mm,5 μm),Boston Analytics公司;Linomat-Ⅵ薄层色谱自动点样仪,瑞士CAMAG公司,Reprostar 3薄层色谱摄影仪,瑞士CAMAG公司;Satorius BSA 124S-CW电子分析天平和Sartorius BT 25S电子分析天平为北京赛多利斯仪器系统有限公司产品。
1.2 试药异株五加甲苷自制(HPLC面积归一化法测定,纯度大于98%),常春藤皂苷元对照品由上海中药标准化研究中心提供(HPLC面积归一化法测定,纯度大于98%)。16批黑种草子药材分别从新疆、安徽亳州等地收集,由上海中药标准化研究中心吴立宏研究员鉴定为腺毛黑种草(Nigella glandulifera Freyn et Sint.)的干燥成熟种子,样品产地、批号等信息见表 1。乙腈、醋酸为色谱级,美国Fisher公司;水为超纯水,其他试剂均为分析纯。D101型大孔吸附树脂(批号:20140606),国药集团化学试剂有限公司。硅胶预制板(HSG 200 mm×100 mm),烟台市化学工业研究所“银龙HSG薄层色谱硅胶预制板”(批号:20150726)。
|
|
表 1 黑种草子样品信息 Table 1 Sample information of Nigellae Semen |
取异株五加甲苷、常春藤皂苷元的对照品,加甲醇溶解,分别制成每1 mL含1 mg异株五加甲苷、常春藤皂苷元的溶液,作为对照品溶液(1)和(2)。
2.1.2 供试品溶液及对照药材溶液制备取含量测定项下的溶液,作为供试品溶液(1)和(2),另取黑种草子对照药材1 g,按“2.2.2”项下方法制成对照药材溶液(1)和(2)。
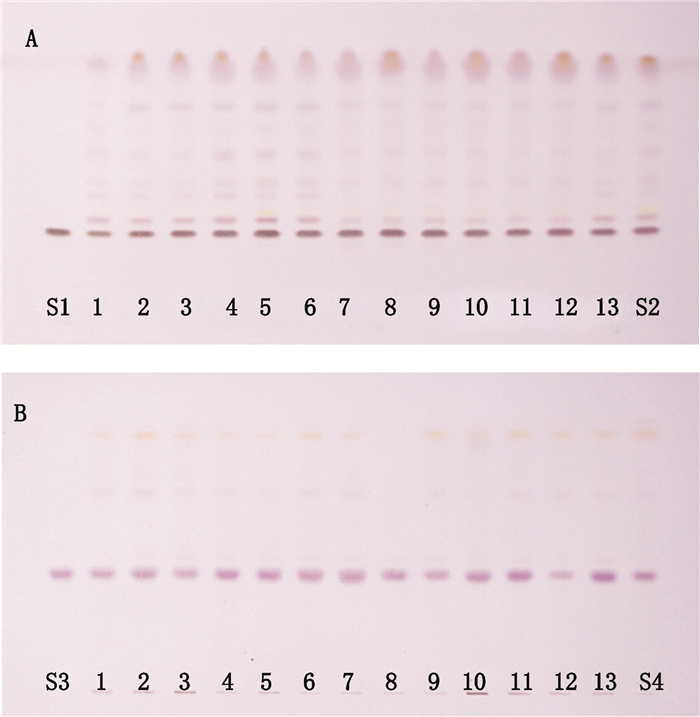
2.1.3 点样、展开吸取上述对照品溶液(1)5 µL,供试品溶液(1)和对照药材溶液(1)各10 µL,分别点于同一硅胶HSG薄层色谱板上,以正丁醇-水-醋酸(2.5:1:0.5)为展开剂,展开、取出、晾干,再喷以10%硫酸乙醇试液,置105 ℃加热至斑点显色清晰。在10%硫酸乙醇显色后,日光下检视,供试品在与异株五加甲苷对照品和对照药材色谱相应位置上,显相同颜色的斑点。结果表明,所建的薄层方法Rf值合适,各斑点间分离度良好,条带清晰,斑点丰富,可用于黑种草子的鉴别。结果见图 2-A。另外,按2015年版中国药典[1]中黑种草子“鉴别”项下TLC展开方法,吸取上述对照品溶液(2)5 µL,供试品溶液(2)和对照药材溶液(2)各10 µL,分别点于同一硅胶G薄层色谱板上,以环己烷-乙酸乙酯-冰醋酸(6:4:0.25)为展开剂展开,喷以10%硫酸乙醇溶液,在105 ℃加热至斑点显色清晰,置日光灯下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点或荧光斑点。结果见图 2-B。
|
1~13.黑种草子样品(samples of Nigellae Semen) S1.异株五加甲苷(sieboldianoside A) S2.本法制备黑种草子对照药材溶液(solution of Nigellae Semen reference drug processed by present method) S3.常春藤皂苷元(hederagenin) S4. 2015年版中国药典方法制备黑种草子对照药材溶液(solution of Nigellae Semen reference drug processed by method of 2015 ChP) A.本文方法(this method) B. 2015年版中国药典方法(method of 2015 ChP) 图 2 黑种草子TLC图 Figure 2 TLC chromatograms of Nigellae Semen |
结果表明,2种TLC鉴别方法的效果相当,但本文建立的“黑种草子TLC鉴别方法”的样品处理方法较中国药典方法更为简便,且具有与对照药材相比,斑点多、分离度好的优势,可以有效发挥对照药材的鉴别作用,较为全面地反映药材中皂苷类成分的信息。2015年版中国药典样品制备方法分为脱脂、提取和水解三步,耗时至少15 h;优化后的方法为脱脂和提取两步,时间缩短为6 h左右,大大提高了试验效率,节约了检测成本。此外,简化的方法还避免使用毒性较大的三氯甲烷试剂,减少对人体及环境造成的危害。新选取的指标成分能直观地反映药材的品质,比现行标准方法更能满足快速、准确地鉴别药材的要求。
2.2 HPLC含量测定 2.2.1 对照品储备液制备取异株五加甲苷对照品适量,精密称定,加甲醇制成每1 mL含异株五加甲苷3.022 mg的溶液,作为对照品储备液。
2.2.2 供试品溶液制备分别取样品(过三号筛)黑种草子1 g,精密称定,置索氏提取器中,加石油醚(60~90 ℃)适量,加热回流提取2 h,弃去石油醚液,药渣挥干,加甲醇适量,继续索氏回流提取4 h,回收溶剂至干,残渣加水15 mL溶解并分次转移至分液漏斗中,加水饱和的正丁醇振摇提取3次,每次20 mL,合并正丁醇液,回收溶剂至干,残渣加甲醇溶解并转移至5 mL量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,作为供试品溶液(1)。另按照2015年版中国药典[1]中黑种草子“含量测定”项下供试品溶液制备方法(较本文建立的供试品溶液制备方法增加了酸水解及三氯甲烷萃取2个步骤)处理黑种草子样品(过三号筛),制得供试品溶液(2)。
2.2.3 色谱条件色谱柱为Boston Luna Clone(4.6 mm×250 mm,5 μm),柱温30℃;以乙腈为流动相A,乙酸铵缓冲盐溶液[24]为流动相B,梯度洗脱,洗脱程序为0~10 min:19%A,10~20 min:19%→33%A,20~35 min:33%A;流速为1 mL·min-1;ELSD漂移管温度为45 ℃,载气压力为3.3×105 Pa,gain值6。
2.2.4 线性范围考察精密吸取对照品储备液,依次用甲醇稀释成异株五加甲苷质量浓度为0.023、0.141、0.653、1.088、1.813、3.022 mg·mL-1的一系列不同浓度的对照品溶液,吸取20 μL注入色谱仪进行测定。以进样浓度的自然对数值(X)为横坐标,峰面积的自然对数值(Y)为纵坐标,进行线性回归,得标准曲线方程:
| $ Y=1.107 \ 8X+2.426 \ 6 \ \ \ r=0.999 \ 6 $ |
结果表明,异株五加甲苷质量浓度在0.023~3.022 mg·mL-1范围内呈良好线性关系。
2.2.5 检测下限和定量下限取对照品储备液,采用逐步稀释方法,按“2.2.3”项下色谱条件测定。进样20 µL,信噪比为3:1时,检测下限(LOD)为9.023 µg·mL-1,信噪比为10:1时,定量下限(LOQ)为22.56 µg·mL-1。
2.2.6 精密度试验分别取高、中、低(异株五加甲苷1.813、1.088、0.653 mg·mL-1)3个质量浓度的对照品溶液,同1 d内连续进样6次,测得异株五加甲苷峰面积的RSD分别为1.3%、0.9%和1.5%,表明日内精密度良好。连续3 d进行测试,测得异株五加甲苷峰面积的RSD分别为1.2%、0.6%和0.7%,表明日间精密度良好。
2.2.7 重复性试验取黑种草子粉末(过三号筛,编号:4)约1 g,精密称定,平行6份,按“2.2.2”项下方法制备供试品溶液,进样10 µL。结果异株五加甲苷平均含量为16.45 mg·g-1,RSD为1.1%,说明方法重复性良好。
2.2.8 稳定性试验取黑种草子(编号:4)供试品溶液,分别在0、2、4、8、12、16、24和48 h各进样10 µL。结果异株五加甲苷峰面积的RSD为2.2%,表明供试品溶液在48 h内基本稳定。
2.2.9 加样回收率试验取异株五加甲苷对照品适量,精密称定,加甲醇溶解,制成质量浓度为3.006 mg·mL-1的对照品溶液。取已知含量(编号:1,异株五加甲苷含量为12.01 mg·g-1)的黑种草子约0.5 g,精密称定,按50%、100%和150%分别加入不同浓度的对照品溶液,按“2.2.2”项下方法制备溶液,进样10 µL,测定,计算加样回收率。结果见表 2。
|
|
表 2 加样回收率试验(n=9) Table 2 Results of recovery tests |
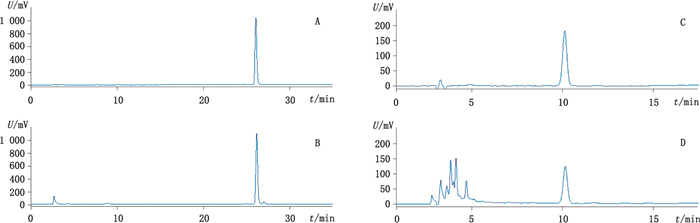
分别取不同来源的16批黑种草子样品,粉碎(过三号筛),称取约1 g,精密称定。每批平行2份,按“2.2.2”项下方法制备溶液,分别精密吸取对照品溶液20、10 µL和供试品溶液各10 µL,注入液相色谱仪,按外标两点法计算异株五加甲苷的含量。色谱图见图 3-A、B。测定结果显示,16批不同来源的黑种草子中异株五加甲苷的含量范围为1.28%~1.93%,平均含量为1.76%。取含量测定结果均值的80%作为黑种草子中异株五加甲苷的含量限度,暂定为:本品按干燥品计算,含异株五加甲苷不得少于1.40%。另按“2.2.2”项下方法处理16批黑种草子,照2015年版中国药典黑种草子“含量测定”项下色谱条件,分别精密吸取常春藤皂苷元对照品溶液与供试品溶液10 µL,注入液相色谱仪,测定这16批黑种草子中常春藤皂苷元的含量,色谱图见图 3-C、D。中国药典规定:按干燥品计算,黑种草子中常春藤皂苷元不得少于0.50%。各批黑种草子中异株五加甲苷和常春藤皂苷元的含量及合格率统计结果见表 3。
|
A.异株五加甲苷(sieboldianoside A) B.本法制备的黑种草子样品(Nigellae Semen sample processed by the present method) C.常春藤皂苷元(hederagenin) D. 2015年版中国药典方法制备的黑种草子样品(Nigellae Semen sample processed by the method in ChP 2015) 图 3 本文方法与中国药典2015年版方法条件下的黑种草子HPLC图 Figure 3 HPLC Chromatograms of Nigellae Semen processed by the present method and method in ChP 2015 |
|
|
表 3 不同批次黑种草子中异株五加甲苷、常春藤皂苷元含量测定结果(n=2) Table 3 Sieboldianoside A and hederagenin's content in16 batches of Nigellae Semen |
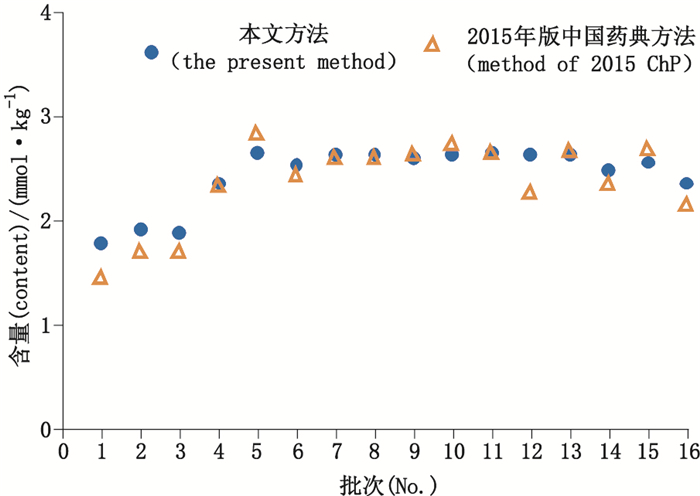
将16批次药材所含的异株五加甲苷含量,按摩尔浓度换算成常春藤皂苷元,并与水解法测定的总常春藤皂苷元摩尔浓度相比,结果基本一致(见图 4)。对结果进行分析发现:(1)水解法测定的常春藤皂苷元摩尔浓度的离散度较大,说明现行标准的样品处理方法可能有一定的不足,还需进一步研究;(2)黑种草子中富含以常春藤皂苷元为母核的三萜皂苷类成分,如α-常春藤皂苷、川续断皂苷乙、常春藤皂苷C和异株五加甲苷[24]。从摩尔浓度数据上看,以新旧2种方法的摩尔浓度计算其偏差,16批样品的范围在0~18.5%。水解法所得含量也仅是其中一部分三萜皂苷类成分水解所得常春藤皂苷元,存在水解不完全或水解产物不专一的问题。
|
图 4 2种方法下不同批次黑种草子中常春藤皂苷元摩尔浓度 Figure 4 Content of hederagenin in 16 batches of samples determined by the two methods |
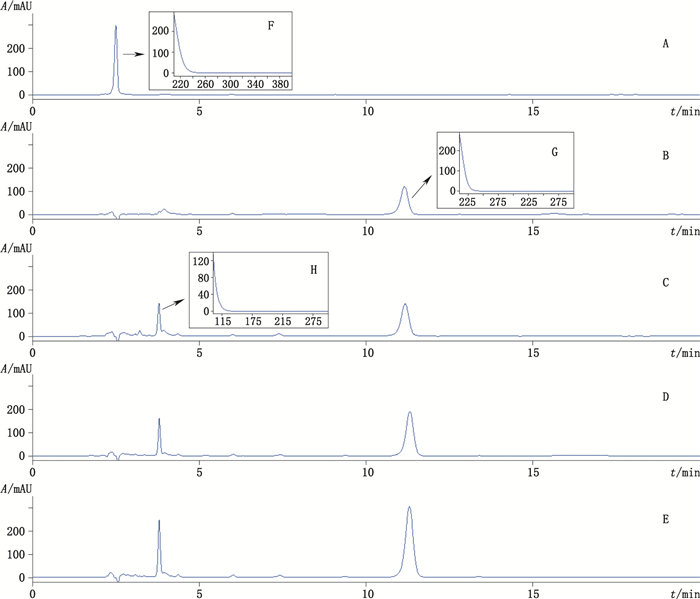
前期研究发现,黑种草子中皂苷类成分含量虽然较高,但药材本身可能不含常春藤皂苷元,是以含糖的皂苷形式存在。见图 5。经对黑种草子中含量最高的成分跟踪分离和鉴定,该成分为异株五加甲苷[13],结构如图 1-B所示。
|
A.异株五加甲苷(sieboldianoside A) B.常春藤皂苷元(hederagenin) C.水解样品1(sample 1 hydrolyzed from sieboldianoside A) D.水解样品2(hydrolyzed sample 2) E.水解样品3(hydrolyzed sample 3) F.异株五加甲苷紫外光谱图(UV spectrum of sieboldianoside A) G.常春藤皂苷元紫外光谱图(UV spectrum of hederagenin) H. 1号峰紫外光谱图(UV spectrum of peak 1) 图 5 异株五加甲苷水解样品HPLC图 Figure 5 HPLC Chromatograms of hydrolyzed sieboldianoside A |
以2015年版中国药典中黑种草子供试品的水解方法,根据1号黑种草子样品中测得的异株五加甲苷含量的50%、100%、150%,称取异株五加甲苷对照品,测定其转化为常春藤皂苷元的含量,计算转化率。结果见表 4。结果发现,异株五加甲苷虽然完全被水解,但水解产物却有2个,除常春藤皂苷元外尚生成另一未知成分(图 5-C的1号峰),该成分在黑种草子上述色谱条件下未见,经紫外光谱图(图 5-H)推测该峰可能也是皂苷类成分。
|
|
表 4 异株五加甲苷转化为常春藤皂苷元的转化率测定结果(n=2) Table 4 Conversion rates of sieboldianoside Aconverting to hederagenin |
研究结果表明,无论异株五加甲苷取样量是多少,在上述条件下,现行黑种草子标准样品处理的酸水解条件都无法将其水解完全,除转化为常春藤皂苷元外,尚有其他皂苷类成分生成,生成的产物不专一(见图 5),其水解转化率均在59%~63%左右,且存在低浓度转化率高于高浓度的趋势。黑种草子来源广泛,各成分的量与种类存在差异,因此,现行标准中以水解产物常春藤皂苷元来评价黑种草子的质量,除缺乏专属性外,尚存在转化率不稳定的缺陷。
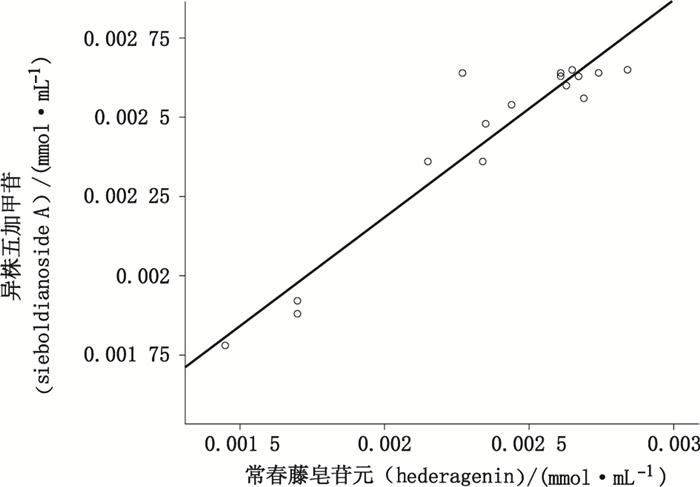
2.3.3 黑种草子2种方法含量结果相关性分析相关性分析可用于对2个或多个具备相关性的变量元素进行分析,从而衡量2个变量因素的相关密切程度。采用SPSS 13.0统计软件对各批黑种草子中异株五加甲苷含量和常春藤皂苷元含量进行相关性分析,结果见图 6。2种方法测定结果的Pearson相关系数为0.952(极强相关),P<0.001,具有统计学意义。
|
图 6 异株五加甲苷和常春藤皂苷元含量相关性分析图 Figure 6 Correlation analysis of sieboldianoside A and hederagenin content |
结果表明,2种方法测定结果呈高度正相关,即异株五加甲苷含量较高的黑种草子中常春藤皂苷元的含量也较高,说明目前2015年版中国药典采用水解法得到的常春藤皂苷元主要来自含量较高的异株五加甲苷。因此,本文方法能够对黑种草子药材品质进行评价。
3 讨论 3.1 2015年版中国药典方法存在的问题黑种草子中富含以常春藤皂苷元为母核的皂苷类成分,如α-常春藤皂苷、川续断皂苷乙、常春藤皂苷C和异株五加甲苷[25]。2015年版中国药典黑种草子标准中,采用样品通过水解转化为常春藤皂苷元间接评价药材品质的方法,缺乏专属性。异柱五加甲苷模拟中国药典水解试验的结果表明,其水解转化率均在59%~63%左右。在相同的水解条件下,异柱五加甲苷自身可能存在浓度低比浓度高时,其转化率有增高的趋势,对来源广泛的黑种草子,因其本身所含成分种类及量的不同,以水解转化产物常春藤皂苷元来间接评价黑种草子的质量,会带来定量不准确的潜在风险。
3.2 指标成分的选择本法针对黑种草子现行标准质控方法存在的缺陷,选择黑种草子药材中本身含量高、活性好[12]的异株五加甲苷为新的指标成分,建立HPLC-ELSD法测得3批黑种草子中异株五加甲苷含量低于1.40%,不符合暂时规定的含量限度,与中国药典测定结果相比没有误判情况的出现,说明与常春藤皂苷元相比,异株五加甲苷更能直接反映药材本身的真伪情况,更具科学性。
3.3 检测器与供试品溶液制备方法的选择本研究以异株五加甲苷为指标成分,采用蒸发光散射检测器检测,与现行标准采用210 nm波长检测常春藤皂苷元相比,具有其他成分干扰小,检测灵敏度高,重复性和稳定性好的优点。2015年版中国药典黑种草子质量控制方法的样品处理方法复杂,耗时耗力,样品制备过程至少15 h;本方法缩短至6 h左右。
3.4 方法的应用前景本研究为黑种草子中国药典标准的提升提供了试验依据,也为其他处方中有黑种草子的复方制剂的质量控制提供了方法参考。所建立的方法具有操作简便,检测效率高,专属性强的特点,不仅可以用于黑种草子药材的品质评价,同样可以用于含其制剂的品质评价,如已用于维药复方木尼孜其颗粒的质量控制[26],较2015年版中国药典中黑种草子的质量控制标准具有一定的优势。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 6 ChP 2015. Vol Ⅰ[S]. 2015: 6 |
| [2] |
中华人民共和国卫生部药品标准. 维吾尔药分册[S]. 1998 Drug Specifications Promulgated by the Ministry of Public Health. P. R. China. Uigher Medicine[S]. 1998 |
| [3] |
郭景珍, 郝海峰, 任丽娟, 等. 黑种草子油对大鼠体外血栓形成和抗血小板聚集的作用[J]. 中药药理与临床, 2000, 16(5): 20. GUO JZ, HAO HF, REN LJ, et al. Effects of Neiglla glanelulifera oil on rat thrombus formation and platelet aggregation[J]. Pharmacol Clin Chin Mater Med, 2000, 16(5): 20. |
| [4] |
章丹丹, 凌霜, 张洪平, 等. 黑种草子不同组分抑制亚硝酸盐积累、血小板聚集和血管收缩的体外实验研究[J]. 中成药, 2013, 35(7): 1376. ZHANG DD, LING S, ZHANG HP, et al. The inhibitory effect of different fractions from Nigellae Semen in vitro on nitrite accumulation, platelet aggregation and vasoconstriction[J]. Chin Tradit Pat Med, 2013, 35(7): 1376. |
| [5] |
王原来, 杨晓露, 卞卡, 等. 黑种草子抑制乳腺癌细胞增殖的组分筛选及机制分析[J]. 时珍国医国药, 2013, 24(6): 1289. WANG YL, YANG XL, BIAN K, et al. Study on the active constituents and anti-proliferation mechanisms of Nigellae Semen[J]. Lishizhen Med Mater Med Res, 2013, 24(6): 1289. |
| [6] |
艾尼娃尔·艾克木, 阿不来提·买买提明, 单莲莲, 等. 维吾尔药瘤果黑种草子对艾氏腹水瘤肿瘤小鼠的抗癌及抗氧化作用[J]. 新疆医科大学学报, 2014, 37(3): 269. AINIWAER AIKEMUL, ABULAITI MAIMAITIMING, SHAN LL, et al. On antioxidant and anticancer role in transplanted EAC tumor mice by Uyghur medicine fruit Nigella[J]. J Xinjiang Med Univ, 2014, 37(3): 269. |
| [7] |
于明, 刘玲玲, 徐鑫, 等. 新疆特色维药瘤果黑种草籽的抗氧化活性研究[J]. 中国酿造, 2014, 33(11): 110. YU M, LIU LL, XU X, et al. Antioxidant activity of Xinjiang Uighur medicine Nigella sativa L.seeds[J]. China Brew, 2014, 33(11): 110. DOI:10.11882/j.issn.0254-5071.2014.11.025 |
| [8] |
陈雪莲, 谢玲, 耿东升, 等. 瘤果黑种草子提取物对支气管平滑肌解痉作用的研究[J]. 时珍国医国药, 2014, 25(2): 268. CHEN XL, XIE L, GENG DS, et al. Study on bronchial smooth muscle spasmolytic action of Nigella glandulifera extract[J]. Lishizhen Med Mater Med Res, 2014, 25(2): 268. |
| [9] |
章丹丹, 聂绪强, 潘会君, 等. 黑种草子总皂苷对炎症介质及ERK/MAPK信号转导通路的影响[J]. 中国中药杂志, 2010, 35(19): 2594. ZHANG DD, NIE XQ, PAN HJ, et al. Study on effect of total saponins from Semen Nigellae on inflammatory mediators and ERK/MAPK pathway in stimulated macrophage[J]. China J Chin Mater Med, 2010, 35(19): 2594. |
| [10] |
王林林, 史玉柱, 徐芳, 等. 瘤果黑种草子总皂苷治疗类风湿性关节炎的作用研究[J]. 中药药理与临床, 2014, 30(3): 78. WANG LL, SHI YZ, XU F, et al. Evaluation on arthritis of total sapionins from Nigella glandulifera seeds[J]. Pharmacol Clin Chin Mater Med, 2014, 30(3): 78. |
| [11] |
TIAN Z, LIU YM, CHEN SB, et al. Cytotoxicity of two triterpenoids from Nigella glandulifera[J]. Molecules, 2006, 11(9): 693. DOI:10.3390/11090693 |
| [12] |
孙璐. 维药斯亚旦抗肝癌有效成分研究[D]. 天津: 天津理工大学, 2014 SUN L. Studies on the Anti-hepatoma Constituents of Nigella Glandulifera[D]. Tianjin: Tianjin University of Technology, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10060-1015510590.htm |
| [13] |
郝海峰, 任丽娟, 陈玉武. 黑种草子化学成分研究[J]. 药学学报, 1996, 31(9): 689. HAO HF, REN LJ, CHEN YW. Studies on the chemical constituents of seeds from Nigella Glandulifera[J]. Acta Pharm Sin, 1996, 31(9): 689. |
| [14] |
耿东升, 张淑锋, 兰建国, 等. 瘤果黑种草子挥发油的化学成分分析及百里醌的定量[J]. 中国中药杂志, 2009, 22(34): 2287. GENG DS, ZHANG SF, LAN JG, et al. Analysis on chemical components of volatile oil and determination of thymoquinone from seeds of Nigella Glandulifera[J]. China J Chin Mater Med, 2009, 22(34): 2287. |
| [15] |
赵军, 徐芳, 刘亚婷, 等. 维药瘤果黑种草子化学成分研究[J]. 中药材, 2012, 35(12): 1956. ZHAO J, XU F, LIU YT, et al. Studies on chemical constituents of Nigella glandulifera[J]. J Chin Med Mater, 2012, 35(12): 1956. |
| [16] |
LIU YM, SUN L, LIU QH, et al. Dolabellane-type diterpene alkaloids from Nigella glandulifera[J]. Biochem Syst Ecol, 2013, 49: 43. DOI:10.1016/j.bse.2013.03.003 |
| [17] |
LIU YM, JIANG YH, LIU QH, et al. Indazole-type alkaloids from the seeds of Nigella glandulifera[J]. Phytochem Lett, 2013, 6(4): 556. DOI:10.1016/j.phytol.2013.07.002 |
| [18] |
SUN L, LIU YM, CHEN BQ, et al. New phenolic compounds from the seeds of Nigella glandulifera and their inhibitory activities against human cancer cells[J]. Bioorg Med Chem Lett, 2015, 25: 3864. DOI:10.1016/j.bmcl.2015.07.055 |
| [19] |
李正洪, 彭霞, 姜明辉, 等. 傣药黑种草籽质量标准研究[J]. 中国民族民间医药, 2009, 18(7): 166. LI ZH, PENG X, JIANG MH, et al. Study on quality specification of seeds of Nigella glandulifera Freyn et Sint[J]. Chin J Ethnomed Ethnopharm, 2009, 18(7): 166. |
| [20] |
王园姬, 陈文骆, 从艳, 等. 维药瘤果黑种草子质量标准研究[J]. 中成药, 2012, 32(7): 1268. WANG YJ, CHEN WL, CONG Y, et al. Study on quality specification of Nigella glandulifera[J]. Chin Tradit Pat Med, 2012, 32(7): 1268. |
| [21] |
史荣梅, 耿东升, 李新霞. HPLC法测定瘤果黑种草子中常春藤皂苷元及齐墩果酸含量[J]. 解放军药学学报, 2012, 28(3): 245. SHI RM, GENG DS, LI XX. Determination of hederagenin and oleanic acid in seeds of Nigella Glandulifera by HPLC[J]. Pharm J Chin PLA, 2012, 28(3): 245. |
| [22] |
艾尼娃尔·艾克木, 张坚. HPLC法测定维药黑种草子中芦丁的含量[J]. 新疆医学, 2008, 38(9): 246. AINIWAER AIKEMUL, ZHANG J. Determination of rutin in seeds of Nigella Glandulifera by HPLC[J]. Xinjiang Med J, 2008, 38(9): 246. |
| [23] |
冯羽. 维族药斯亚坦有效成分研究[D]. 天津: 天津理工大学, 2013. FENG Y. Studies on the Effective Constituents of Nigella Glandulifera[D]. Tianjin: Tianjin University of Technology, 2013 |
| [24] |
杨雅迪, 程雪梅, 王长虹, 等. 维药骆驼蓬子药材质量标准研究[J]. 中国药学杂志, 2014, 49(2): 106. YANG YD, CHENG XM, WANG CH, et al. Research on quality specification of the seeds of Peganum harmala L.of a Uygur traditional medicine[J]. Chin Pharm J, 2014, 49(2): 106. |
| [25] |
YUN Q, LIU QW, HE CY, et al. UPLC-Q-TOF/MS characterization, HPLC fingerprint analysis and species differentiation for quality control of Nigella glandulifera Freyn et Sint seeds and Nigella sativa L.seeds[J]. Anal Methods, 2014, 6(13): 4845. DOI:10.1039/c4ay00775a |
| [26] |
韦悦, 程娟娟, 程雪梅, 等. 维吾尔药复方木尼孜其颗粒剂的质量控制方法研究[J]. 药物分析杂志, 2017, 37(10): 1805. WEI Y, CHENG JJ, CHENG XM, et al. Study on quality of Uyghur medicine compound Muniziqi granules[J]. Chin J Pharm Anal, 2017, 37(10): 1805. |
 2018, Vol. 38
2018, Vol. 38 
