2. 云南希康生物科技有限公司, 昆明 650217;
3. 浙江康恩贝制药股份有限公司, 浙江省中药制药技术重点实验室, 杭州 310052
2. Yunnan Xikang Biological Technology Co., Ltd., Kunming 650217, China;
3. Zhejiang Conba Pharmaceutical Co., Ltd., Zhejiang Provincial Key Laboratory of traditional Chinese Medicine Pharmacecutical Technology, Hangzhou 310052, China
银杏叶是银杏科植物银杏(Ginkgo biloba L.)的干燥叶,具有活血止痛、敛肺平喘、化湿止泻的功效,主要用于治疗冠心病、咳喘病、高脂血症、心绞痛等[1]。银杏是最具经济价值的植物之一[2],以银杏叶及其产品为主的生产销售公司较多,且在全国拥有多个规模较大的种植基地,因此对银杏叶质量控制尤为重要,它是银杏全产业链中的重要环节,对于采收、加工及销售具有重要的指导意义。
已有研究表明,银杏叶中黄酮内酯含量受温度、降水量、气候条件等因素影响较大,随着生长周期变化,其黄酮含量逐渐下降[3],内酯含量逐渐上升,且银杏叶种植基地分布众多,采收时间不一而同,仅参考文献[4-6]不能获得合理的采收时间,快速检测确定最佳的采收时间,最大程度地保证银杏叶的质量及其价值显得尤为重要。
目前已有的银杏叶检测方法样品前处理过程较为复杂,时间和试剂消耗较大,且不能实现在线监测[7-11]。中国药典标准规定的银杏叶检测方法及指标近10年来都没有发生较大变化,其他检测方法也参差不齐[12-15],对于一些急需检测数据的环节,如银杏叶采收时间、采购产地的确定等,不能及时提供数据。此外,对于大量种植的实验样品或银杏叶生产过程监控,都需要快速及时准确地获得相应的检测数据,这是目前检测方法的缺陷所在。因此,如何快速、及时、准确地测定是目前银杏叶检测急需解决的问题。
本实验旨在探索可行的快速检测银杏叶中总黄酮醇苷含量的方法,为实现快速确定基地采收时间、采购产地和时间、银杏叶入库、银杏叶及提取物生产过程监控等奠定基础,服务于银杏全产业链建设,以期为2020年版中国药典修订提供可靠依据。
1 仪器与试药Agilent 1200高效液相色谱仪(美国安捷伦有限公司)、DK-S26水浴锅(上海精宏科技有限公司)、BS210S电子天平(北京赛多利斯天平有限公司)、超声波清洗器(上海申生科技有限公司)。
甲醇(上海凌峰化学试剂有限公司,分析纯,批号20160317);甲醇(德国Merk公司,色谱纯,批号I844207633);盐酸(永华化学科技有限公司,分析纯,批号20160329);磷酸(上海凌峰化学试剂有限公司,分析纯,批号20160217);银杏叶(云南沾益近3年树龄的银杏树,批号20170206)。对照品槲皮素(批号100081-200907,纯度96.5%)、异鼠李素(批号110860-201410,纯度99.9%)和山柰酚(批号110861-201611,纯度95.5%)购自中国食品药品检定研究院。
2 方法与结果[1] 2.1 样品前处理试验实验中的总黄酮醇苷是由槲皮素、山柰酚、异鼠李素三者之和再乘以2.51的系数计算而得。
2.1.1 回流提取溶剂量考察取银杏叶粉末约1 g,分别加甲醇-25%盐酸(4:1)溶液25、50、80、150 mL,90 ℃水浴加热回流1 h,迅速冷却,25 mL溶剂量转移至50 mL量瓶中,50、80 mL转移至100 mL量瓶中,150 mL转移至250 mL量瓶中,加甲醇至刻度,摇匀,过0.45 μm有机滤膜,HPLC检测。结果显示,当溶剂量为25、50、80、150 mL时,总黄酮醇苷含量分别为1.274%、1.394%、1.435%、1.434%。总黄酮醇苷的含量随着溶剂用量的增加而升高,溶剂用量80 mL时,到达平台,因此选择80mL作为溶剂量。
2.1.2 回流提取时间考察取银杏叶粉末约1 g,加入甲醇-25%盐酸(4:1)溶液80 mL,90 ℃水浴分别加热回流15、30、45、60、120 min,迅速冷却,转移至100 mL量瓶中,加甲醇至刻度,摇匀,过0.45 μm有机滤膜,HPLC检测。结果显示,当反应时间为15、30、45、60、120 min时,总黄酮醇苷含量分别为1.128%、1.381%、1.460%、1.441%、1.416%。总黄酮醇苷含量随着提取时间的延长而升高,45 min以后趋于平稳,后开始逐渐下降。因此选择45 min作为提取时间。
2.1.3 回流提取温度考察取银杏叶粉末约1 g,加入甲醇-25%盐酸(4:1)溶液80 mL,分别在70、80、90、100 ℃水浴加热回流45 min,迅速冷却,转移至100 mL量瓶中,加甲醇至刻度,摇匀,过0.45 μm有机滤膜,HPLC检测。结果显示,当反应温度为70、80、90、100 ℃时,总黄酮醇苷含量分别为1.269%、1.490%、1.472%、1.440%。总黄酮醇苷含量随着回流温度的升高而增加,80~100 ℃几乎无差异,RSD为1.7%,考虑中国药典方法水解回流温度为90 ℃,故本研究也选择90 ℃作为水解温度。
2.2 方法学验证试验 2.2.1 检测方法色谱柱为Zorbax SB-C18柱(4.6 mm×250 mm,5 μm,十八烷基硅烷键合硅胶为填充剂),以甲醇-0.4%磷酸溶液(50:50)为流动相,检测波长360 nm,理论板数按槲皮素峰计算应不低于2 500。等度洗脱30 min,流速为1 mL·min-1,柱温30 ℃,进样体积10 μL。在上述色谱条件下,各组分分离度良好,见图 1。
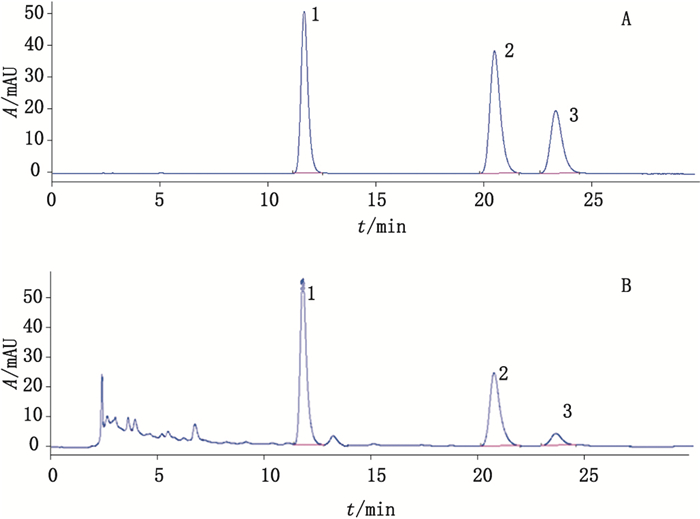
|
1.槲皮素(quercetin) 2.山柰酚(kaempferol) 3.异鼠李素(isorhamnetin) 图 1 混合对照品(A)和样品(B)色谱图 Figure 1 HPLC chromatograms of mixed reference substances (A) and sample(B) |
取银杏叶中粉约1 g,精密称定,置回流瓶中,加甲醇-25%盐酸(4:1)溶液80 mL,90 ℃水浴加热回流45 min,迅速冷却,转移至100 mL量瓶中,并加甲醇至刻度,摇匀,即得。
2.2.2.2 混合对照品溶液精密称取槲皮素15.78 mg、山柰酚10.87 mg,置同一10 mL量瓶中,加甲醇超声溶解并稀释至刻度,摇匀,制成槲皮素、山柰酚混合储备液;异鼠李素9.72 mg置50 mL量瓶中,用甲醇超声溶解并稀释至刻度,摇匀,制成异鼠李素储备液。取槲皮素、山柰酚混合储备液2 mL,异鼠李素储备液2 mL,置同一50 mL量瓶中,用甲醇稀释至刻度,摇匀,制成槲皮素、山柰酚、异鼠李素质量浓度分别为0.063 1、0.043 5、0.007 8 mg·mL-1的混合对照品溶液。
2.2.3 线性关系考察将“2.2.2.2”项下的槲皮素、山柰酚、异鼠李素混合对照品溶液(C1)再分别稀释5倍(C2)、10倍(C3)、25倍(C4)、40倍(C5)、50倍(C6)、100倍(C7),将C1至C7分别进样10 μL,以各成分进样量为横坐标,峰面积为纵坐标,进行线性回归,得槲皮素、山柰酚、异鼠李素的回归方程,见表 1。结果表明,槲皮素、山柰酚、异鼠李素在相应范围内线性关系良好。
|
|
表 1 银杏叶中3种成分回归方程 Table 1 Regression equation of 3 kinds of ingredients in Ginkgo biloba |
取银杏叶粉末约0.5 g,共6份,精密称定,分别加入相当于供试品中所含槲皮素、山柰酚、异鼠李素的量的对照品溶液,按“2.2.2.1”项下供试品制备方法制备,HPLC检测。结果见表 2,槲皮素、山柰酚、异鼠李素的平均加样回收率分别为95.4%、93.8%、92.0%,2015年版中国药典药品质量标准分析方法验证指导原则规定,样品待测定成分含量大于0.01%小于0.1%时,回收率限度为85%~110%,槲皮素、山柰酚、异鼠李素乘以2.5的系数前的含量分别为0.32%、0.2%、0.04%,符合限度规定,且3种成分的RSD分别为0.94%、1.1%、1.1%,均小于3%,说明该方法回收率较好。
|
|
表 2 银杏叶中3种化学成分回收率(n=6) Table 2 Recoveries of 3 ingredients in Ginkgo biloba |
按照“2.2.2.1”项下方法,由不同实验员,在不同时间制备供试品溶液,并用不同仪器进行检测,计算总黄酮醇苷含量,结果显示,6次测定总黄酮醇苷含量RSD为1.1%,小于2%,槲皮素、山柰酚、异鼠李素的RSD分别为1.3%、1.1%、1.6%,小于2%,中间精密度良好,表明该方法精密度良好。
2.2.5.2 仪器精密度试验取混合对照品溶液,按“2.2.1”项下条件,连续进样6次,结果槲皮素、山柰酚、异鼠李素峰面积的RSD分别为0.25%、0.34%、0.42%。表明仪器精密度良好。
2.2.6 重复性试验取同一批次银杏叶粉末(批号20170206)约1 g,精密称定,平行6份,按照“2.2.2.1”项下方法制备供试品溶液,HPLC检测,计算含量。结果6份样品中总黄酮醇苷的含量为1.437%,RSD为1.7%,小于2%;槲皮素、山柰酚、异鼠李素的含量分别为0.316 1%、0.210 8%、0.045 7%,RSD分别为1.5%、1.6%、3.9%,符合中国药典限度规定(含量在0.01%级,RSD≤4即可),表明该方法重复性良好。
2.2.7 稳定性试验按照“2.2.2.1”项下方法制备供试品溶液1份,分别在0、2、4、6、8、12、24 h进行测定,结果显示,总黄酮醇苷含量RSD为0.72%,槲皮素、山柰酚、异鼠李素的含量RSD分别为0.75%、0.81%、2.63%,均小于3%,表明该对照品溶液和样品溶液在室温放置24 h,稳定性良好。
2.2.8 耐用性试验 2.2.8.1 色谱柱考察按照“2.2.2.1”项下方法制备供试品溶液1份,分别用Kromasil 100-5C18色谱柱、ZORBAX Eclipse XDB-C18色谱柱、ZORBAX Eclipse SB-C18色谱柱分析测定,供试品溶液中槲皮素、山柰酚、异鼠李素分离度较好,总黄酮醇苷含量RSD为1.8%,表明该方法色谱柱耐用性较好。
2.2.8.2 柱温考察按照“2.2.2.1”项下方法制备供试品溶液1份,在“2.2.1”项下条件基础上,调整柱温为25、30、35 ℃时分析测定,供试品溶液中槲皮素、山柰酚、异鼠李素分离度较好,总黄酮醇苷含量RSD为0.59%,表明该方法受色谱柱温度影响较小。
2.2.8.3 流速考察按照“2.2.2.1”项下方法制备供试品溶液1份,在“2.2.1”项下条件基础上,调整流速为0.8、1.0、1.2 mL·min-1时分析测定,供试品溶液中槲皮素、山柰酚、异鼠李素分离度较好,总黄酮醇苷含量RSD为2.4%,表明流动相流速对该方法影响较小。
2.3 银杏叶中总黄酮醇苷含量测定收集15批银杏叶,分别用2015年版中国药典规定的检测方法及本试验建立的方法同时测定银杏叶总黄酮醇苷含量,每批样品平行2份,结果见表 3。2种方法测定结果无显著差异。
|
|
表 3 15批银杏叶药典法与快速法测定结果比较 Table 3 The comparison results of simultaneous determination of the fast determination method and ChP method for 15 batches of Ginkgo biloba |
本研究基于2015年版中国药典方法,建立了银杏叶总黄酮醇苷含量快速测定方法,色谱条件与药典方法一致。主要对前处理方法进行改进,省去了三氯甲烷除杂及甲醇提取步骤,直接用甲醇-25%盐酸(4:1)的溶液进行提取,考察溶剂用量、提取时间及提取温度,并对该方法进行方法学考察及耐用性试验,保证该方法准确可行,更好地应用于银杏叶研究。
结果表明,该方法简便可行,稳定可靠,重复性好,用该方法测定的样品结果与药典法测定结果无明显差异,可以用于银杏叶质量研究试验。快速检测银杏叶的方法不仅节省时间和溶剂,极大地提高了实验效率,减少资源浪费和环境污染,也为银杏种植生产的过程监控奠定了基础,为2020年版中国药典修订提供了可靠依据。
本试验只是针对快速测定银杏叶总黄酮醇苷做了初步研究,15批样品验证试验结果与中国药典方法相比,结果略高,后期将继续收集不同产地、不同时间采收的样品进行测定,寻找中国药典法前处理过程中总黄酮醇苷的损失部位、损失成分及损失量,以期为药典修订提供更完善的资料。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 316 ChP 2015. VolⅠ[S]. 2015: 316 |
| [2] |
李月娣. 银杏价值及其产业现状分析[J]. 长春大学学报, 2017, 27(2): 32. LI YD. Analysis of value of Ginkgo Biloba and its industry status[J]. J Changchun Univ, 2017, 27(2): 32. |
| [3] |
丁飞, 袁觉, 王昆荣, 等. 不同采集期不同林龄不同部位银杏叶黄酮含量测试[J]. 安徽林业科技, 2015, 41(3): 21. DING F, YUAN J, WANG KR, et al. Measurements of the flavonoid content in leaves of Ginkgo biloba from different periods, ages and parts[J]. Anhui Forest Sci Technol, 2015, 41(3): 21. |
| [4] |
YU N, HE CH, AWUTI G, et al. Simultaneous determination of six active compounds in Yixin Badiranjibuya granules, a traditional Chinese medicine, by RP-HPLC-UV method[J]. J Anal Methods Chem, 2015, 2015(2): 1. |
| [5] |
van BEEKA TA, MONTOROB P. Chemical analysis and quality control of Ginkgo biloba leaves, extracts, and phytopharmaceuticals[J]. J Chromatogr A, 2009, 1216(11): 2002. DOI:10.1016/j.chroma.2009.01.013 |
| [6] |
许龙. 鲜银杏叶不同处理方式黄酮类成分比较研究[D]. 长沙: 湖南中医药大学, 2009 XU L. Research on Flavonoids by Using Different Ways to Deal with Fresh Ginkgo biloba[D]. Changsha: Hunan Univ Chin Med, 2009 http://cdmd.cnki.com.cn/Article/CDMD-10541-2009243644.htm |
| [7] |
余启荣, 晏利之, 谭湘湘. HPLC法测定银杏叶提取物中总黄酮醇苷的含量[J]. 首都师范大学学报, 2009, 30(2): 32. YU QR, YAN LZ, TAN XX. HPLC determination of total flavonoids in the Ginkgo Biloba extracts[J]. J Cap Norm Univ, 2009, 30(2): 32. |
| [8] |
韩立路, 孙兴力, 龙红萍. HPLC法快速测定银杏叶中银杏总黄酮醇苷含量[J]. 中国医药指南, 2009, 7(12): 5. HAN LL, SUN XL, LONG HP, et al. HPLC rapid determination of the total flavonol glycoside in Ginkgo Biloba[J]. China Guide Med, 2009, 7(12): 5. DOI:10.3969/j.issn.1671-8194.2009.12.001 |
| [9] |
王京辉, 陈晶, 王萌萌, 等. 银杏叶对照提取物中7种黄酮醇苷类化合物的定量研究[J]. 中国中药杂志, 2015, 40(20): 4018. WANG JH, CHEN J, WANG MM, et al. Determination of 7 flavonol glycosides in Ginkgo biloba reference extracts[J]. China J Chin Mater Med, 2015, 40(20): 4018. |
| [10] |
陈凡. 银杏叶提取物的HPLC-DAD-ELSD指纹图谱研究[J]. 药物分析杂志, 2011, 31(3): 534. CHEN F. HPLC-DAD-ELSD study on the finger print chromatograms of Ginkgo biloba extracts[J]. Chin J Pharm Anal, 2011, 31(3): 534. |
| [11] |
吕尚, 周海滨, 汪俊, 等. 基于近红外光谱的银杏叶提取液总黄酮醇苷快速检测研究[J]. 药物分析杂志, 2017, 37(5): 927. LÜ S, ZHOU HB, WANG J, et al. Rapid determination of total flavone glycosides in extraction of ginkgo leaf based on near-infrared spectroscopy[J]. Chin J Pharm Anal, 2017, 37(5): 927. |
| [12] |
李法齐, 刘晓媛, 季晓晖. HPLC测定银杏叶中黄酮含量[J]. 广东化工, 2015, 42(16): 201. LI FQ, LIU XY, JI XH. HPLC determination of flavonoids in Ginkgo leaves[J]. Guangdong Chem, 2015, 42(16): 201. DOI:10.3969/j.issn.1007-1865.2015.16.099 |
| [13] |
赖宇红, 童惠贞, 冼彦芳, 等. 中国药典水解测定银杏黄酮的改进建议[J]. 药物分析杂志, 2009, 29(7): 1163. LAI YH, TONG HZ, XIAN YF, et al. The revision advices on quantification of flavonoid aglycones in EGB recorded in ChP[J]. Chin J Pharm Anal, 2009, 29(7): 1163. |
| [14] |
宋唯唯, 刘芬芬, 刘彩红. 高效液相色谱法测定银杏叶提取物中总黄酮醇苷含量[J]. 泰山医学院学报, 2016, 37(1): 33. SONG WW, LIU FF, LIU CH. HPLC determination of total flavone glycosides in Ginkgo biloba extracts[J]. J Taishan Med Coll, 2016, 37(1): 33. |
| [15] |
ZHANG J, YUE L, HAYAT K, et al. Purification of flavonoid from Gingko biloba extract by zinc complexation method and its effect on antioxidant activities[J]. Sepd Purif Technol, 2009, 71(3): 273. |
 2018, Vol. 38
2018, Vol. 38 
