异烟肼, 化学名4-吡啶甲酰肼, 是结核病联合治疗中的首选药。本品相对分子质量小(137.14), 口服后几乎完全吸收, 生物利用度达90%[1-2]。杂质谱的分析是评价药物质量的重要指标之一[3]。2015年版《中华人民共和国药典》(ChP 2015)异烟肼与异烟肼片现行标准中有关物质测定方法为不加校正因子的主成分自身对照法[4], USP 39异烟肼中列出了4种已知杂质, 定量方法为加校正因子的主成分自身对照法[5], 均为HPLC等度洗脱。笔者结合异烟肼的合成工艺和强力降解试验, 对异烟肼及其片剂中可能产生的杂质进行研究, 建立HPLC梯度洗脱分析方法, 测定异烟肼及国内外20家企业异烟肼片的有关物质含量, 并对结果进行分析, 为异烟肼及异烟肼片质量一致性评价中有关物质的分析研究提供依据。
1 仪器与试药Waters e2695/2998高效液相色谱仪; HITACHI Chromaster高效液相色谱仪; Lambda35紫外-可见分光光度计; METTLER AE163电子天平; METTLER FiveEasy Plus酸度计。
异烟肼对照品(100578-201502, 中国食品药品检定研究院, 99.8%); 异烟肼原料(T2014100, 天津汉德威药业有限公司); 乳糖对照品(100058-201204, 中国食品药品检定研究院, 94.7%); 乳糖一水合物(L101850716A545, 德国美剂乐); USP39规定的4种已知杂质:异烟酸(W6QJI-FP, > 99.0%)、异烟酰胺(FGE01-DAEO, > 99.0%)、4-氰基吡啶(52BZB-OP, > 98.0%)均来自梯希爱(上海)化成工业发展有限公司, 2-吡啶甲酰肼(#F1512073, Aladdin Industrial Corporation, > 98.0%)[5]; 异烟肼合成起始物4-甲基吡啶(6D7HC-PA, 梯希爱(上海)化成工业发展有限公司, > 98.0%)[6], 异烟肼合成副产物三氮唑(Y20150428-XYP, 浙江新赛科药业有限公司, ≥98.5%)。
20家企业生产的异烟肼片, 规格为100 mg。其中FDA规定的参比制剂美国山德士公司2批[7], 日本第一三共株式会社1批, 国内A、B、C、D、E、F、G、H、I、J、K、L、M、N、O、P、Q、R企业各1批。
甲醇为色谱纯, 水为超纯水, 盐酸为优级纯, 磷酸二氢钾、氢氧化钠、醋酸钠、冰醋酸、磷酸氢二钠均为分析纯。
2 方法与结果 2.1 色谱条件与系统适用性ODS色谱柱(型号:CAPCELL PAK ADME; 填料:金刚烷键合基团; 规格:4.6 mm×250 mm, 5 µm; 生产:资生堂公司)。流动相A为0.05 mol·L-1的磷酸二氢钾溶液(用磷酸调节pH至6.0±0.05), 流动相B为甲醇, 按表 1进行梯度洗脱, 柱温为35 ℃, 检测波长为262 nm, 流速为1.0 mL·min-1, 进样量为20 µL。
|
|
表 1 流动相梯度洗脱程序 Table 1 The gradient elution program of mobile phase |
称取异烟肼对照品100 mg, 乳糖对照品20 mg, 加水100 mL溶解后, 置于水浴中反应1 h, 按上述色谱条件测定, 异烟肼与相邻杂质峰的分离度应大于1.5, 理论塔板数按异烟肼峰计算应大于5 000。
2.2 溶液的制备 2.2.1 对照品溶液精密称取异烟肼对照品及异烟酸、异烟酰胺、2-吡啶甲酰肼、4-氰基吡啶和4-甲基吡啶各20 mg, 置100 mL量瓶中, 加水溶解并稀释至刻度, 摇匀; 精密称取三氮唑约20 mg, 置100 mL量瓶中, 加20 mL甲醇, 微温使溶解, 用水稀释至刻度, 摇匀, 作为对照品储备液。再精密量取各对照品储备液5 mL, 置同一200 mL量瓶中, 加水稀释至刻度, 摇匀, 作为对照品溶液。
2.2.2 供试品溶液精密称取异烟肼原料及异烟肼片, 加水适量振摇溶解, 制成异烟肼质量浓度为1mg·mL-1的溶液, 滤过, 即得。
2.2.3 对照溶液精密量取“2.2.2”供试品溶液1 mL, 置200 mL量瓶中, 加水稀释至刻度, 摇匀, 即得自身对照溶液。
2.3 方法学验证 2.3.1 专属性为考察异烟肼原料的杂质谱, 可能的降解产物及色谱条件的选择, 采用酸、碱、氧化及高温对异烟肼原料进行强力降解试验。结果在不同破坏条件下, 各降解产物峰均能与异烟肼峰完全分离, 空白辅料峰无干扰, 表明该方法专属性良好(图 1)。
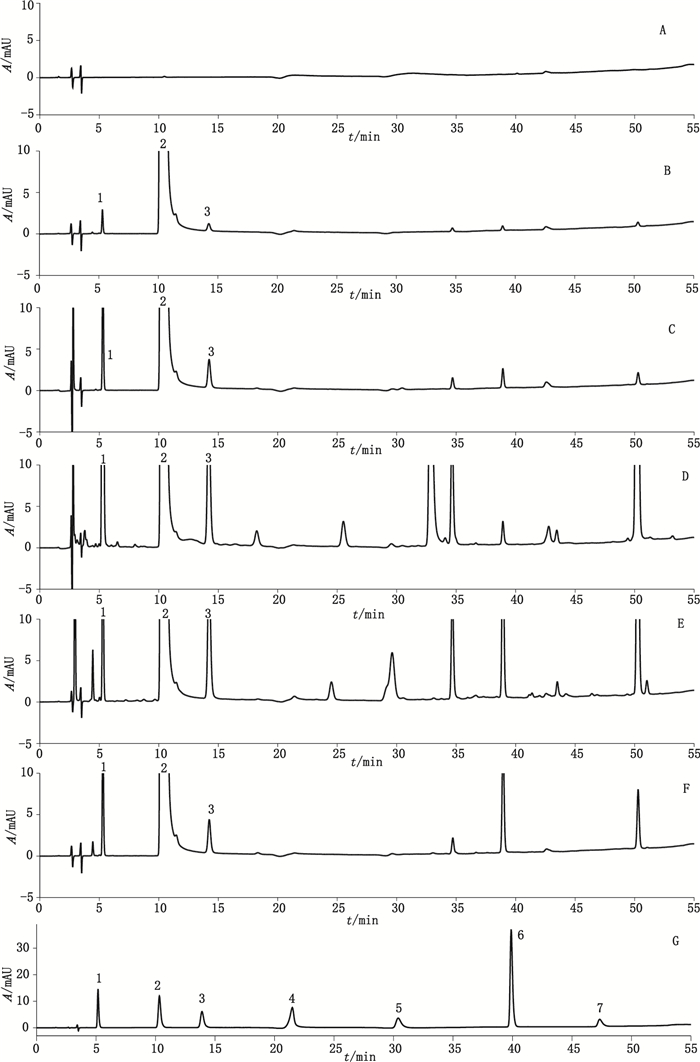
|
1.异烟酸(isonicotinic acid) 2.异烟肼(isoniazid) 3.异烟酰胺(isonicotinamide) 4.2-吡啶甲酰肼(2-isoniazid) 5.4-氰基吡啶(4-cyanopyridine) 6.三氮唑(three nitrogen triazole) 7.4-甲基吡啶(4-methylpyridine)
A.空白辅料溶液(excipients) B.异烟肼原料供试品溶液(negative control solution of isoniazid) C.酸破坏溶液(acid destroyed solution) D.碱破坏溶液(alkali destroyed solution) E.氧化破坏溶液(oxidation destroyed solution) F.高温破坏溶液(high temperature destroyed solution) G.混合对照品溶液(mixed reference substances solution) 图 1 专属性试验HPLC色谱图 Figure 1 The HPLC chromatograms for specificity |
取“2.1.1”项下对照品储备液, 分别精密量取0.5、1、2、3、4、5、6、10 mL, 置200 mL量瓶中, 加水稀释制成不同浓度线性溶液。以质量浓度为横坐标, 峰面积为纵坐标, 绘制标准曲线, 求得回归方程, 结果见表 2。以各杂质的出峰时间与异烟肼出峰时间之比计算相对保留时间, 以标准曲线法计算6种杂质相对于主峰异烟肼的相对校正因子(f), 结果见表 2。
|
|
表 2 异烟肼及已知杂质线性范围与校正因子 Table 2 Linear range and relative response factor of the known impurities and isoniazid |
取对照品溶液, 连续进样6次, 测得异烟肼及各杂质峰面积RSD(n=6)均小于1.0%, 保留时间RSD(n=6)均小于0.5%, 表明该方法精密度良好。
2.3.4 重复性取供试品溶液6份, 进样。测得异烟酸含量分别为2.12、2.10、2.20、2.14、2.10、2.06 µg·mL-1(RSD=2.3%), 保留时间为5.166、5.168、5.167、5.166、5.168、5.166 min(RSD=0.02%); 异烟酰胺含量分别为1.26、1.27、1.28、1.31、1.22、1.30 µg·mL-1(RSD=2.6%); 保留时间为13.908、13.914、13.901、13.905、13.905、13.912 min(RSD=0.04%); 各未知杂质含量RSD均小于3.0%, 保留时间RSD均小于0.5%。表明该方法重复性良好。
2.3.5 检出限取“2.1.1”项下对照品溶液, 逐级稀释至S/N约3~5, 计算异烟肼及各杂质对照品的检出限。结果异烟酸、异烟酰胺、2-吡啶甲酰肼、4-氰基吡啶、三氮唑、4甲基吡啶的检出限分别为0.5、0.5、2、5、0.5、5、5 ng。
2.3.6 稳定性取供试品溶液, 分别于0、2、4、6、8 h进样, 测得各杂质含量的RSD均小于3.0%, 保留时间的RSD(n=6)均小于0.5%, 表明供试品溶液在8 h内稳定性良好。
2.3.7 回收率分别精密量取“2.2.1”项下异烟酸、异烟酰胺、2-吡啶甲酰肼、4-氰基吡啶、4-甲基吡啶、三氮唑的对照品储备液各4、5、6 mL, 置200 mL量瓶中, 每个浓度制备3份, 取有关物质和含量已知的异烟肼片供试品溶液, 精密量取5 mL, 置上述200 mL量瓶中, 平行9份, 并加水稀释至刻度, 摇匀, 制得低、中、高3个浓度的供试品溶液, 分别相当于自身对照溶液浓度的80%(L1)、100%(L2)、120%(L3)。按外标法和校正因子法分别计算回收率, 6种杂质的平均回收率为92.5%~110.0%, RSD < 3%。结果见表 3。
|
|
表 3 加样回收率结果(%, n=9) Table 3 Results of recovery test |
取20家企业的异烟肼片及异烟肼原料, 按“2.2.2”项下制备供试品溶液, 按“2.1.1”项下色谱条件进样测定有关物质含量, 已知杂质按加校正因子的主成分自身对照法计算, 未知杂质按不加校正因子的自身对照法计算。
结果共检出8种杂质, 其中已知杂质3种:异烟酸、异烟酰胺、三氮唑, 其余5种均为未知杂质, 按照出峰顺序将未知杂质命名为杂质Ⅰ、杂质Ⅱ、杂质Ⅲ、杂质Ⅳ、杂质Ⅴ, 见图 2。与强制破坏试验结果对比, 其中除杂质Ⅱ为美国山德士特有杂质外, 其他4种均为异烟肼降解产生的杂质。
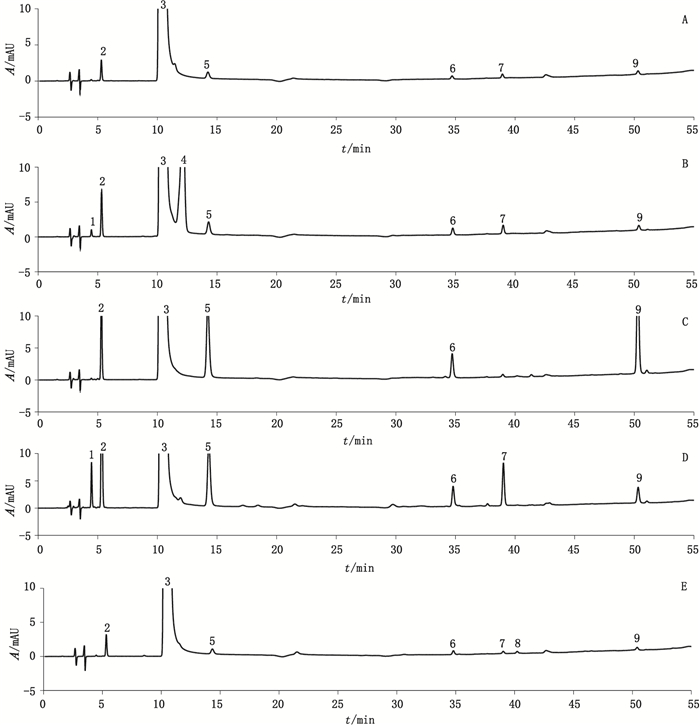
|
1.杂质Ⅰ(impurity Ⅰ) 2.异烟酸(isonicotinic acid) 3.异烟肼(isoniazid) 4.杂质Ⅱ(impurity Ⅱ) 5.异烟酰胺(isonicotinamide) 6.杂质Ⅲ(impurity Ⅲ) 7.杂质Ⅳ(impurity Ⅳ) 8.三氮唑(three nitrogen triazole) 9.杂质Ⅴ(impurity Ⅴ) A.异烟肼原料(raw material isoniazid:T2014100) B.美国山德士公司(U.S.Sandoz:ME130402) C.企业H(manufacturers H:140901) D.企业C(manufacturers C:A150101) E.日本第一三共(Daiichi Sankyo Japan:CJA0169) 图 2 供试品溶液典型色谱图 Figure 2 Typical HPLC chromatograms of test solution |
结果显示, 异烟肼原料中仅异烟酸含量达到0.05%, 其余均低于ICH 3QA原料报告限度0.05%[8]; 异烟肼片最大日服量为300 mg, 参照ICH 3QB原则对杂质报告限度0.1%的要求[9], 单个杂质在0.1%以上的结果均列入表 4。日本第一三共、A、B、E、J、M、N、Q企业的片剂仅异烟酸在0.1%~0.3%之间, 其余单个杂质均低于0.1%;美国山德士的制剂中除一个特有杂质(杂质Ⅱ)外, 异烟酸、异烟酰胺的量在0.1%~0.2%之间, 其他单个杂质均低于0.1%;H企业片剂中异烟酸、异烟酰胺、杂质Ⅲ、杂质Ⅴ, 杂质量在0.1%~0.75%之间; C企业杂质检出最多, 异烟酸、异烟酰胺、杂质Ⅰ、杂质Ⅲ、杂质Ⅳ、杂质Ⅴ, 含量在0.1%~1.35%之间; 其余D、F、G、I、K、L、O、P、R 9家企业的片剂单个杂质均在0.1%以下, 未列入表中。
|
|
表 4 异烟肼及其片剂有关物质测定结果(%) Table 4 The determination results of related substances of isoniazid and isoniazid tablets |
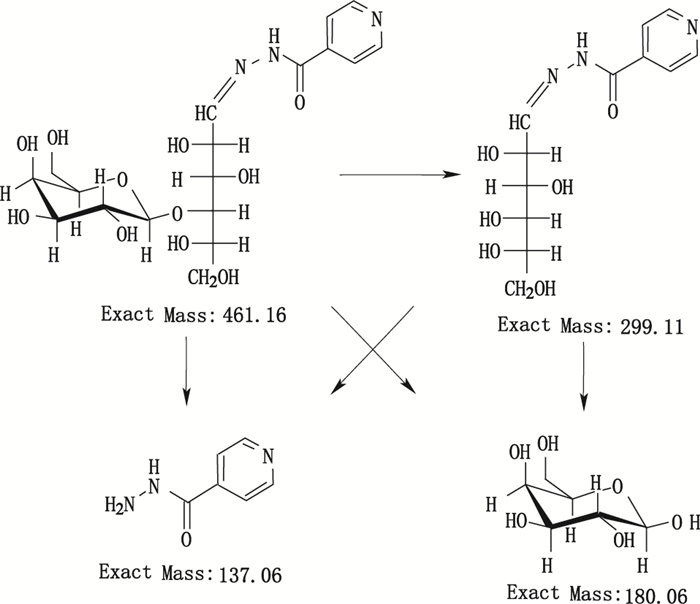
美国山德士所产异烟肼片中含有1个特有工艺杂质—杂质Ⅱ, 2批样品的量分别为1.6%、3.1%。该制剂处方中加入了辅料乳糖, 国内制剂均不含此辅料。结合处方与降解试验, 推测杂质Ⅱ与异烟肼合成及氧化降解无关, 可能与辅料乳糖有关。本文进行了异烟肼原料与辅料乳糖的相容性试验, 结果异烟肼与乳糖经强酸、强碱、高温、氧化等强力破坏试验后, 均产生了1个新的化合物X, 其中经30%过氧化氢氧化破坏2 h后产生量最大。该化合物X与杂质Ⅱ的色谱行为一致(图 3), 两者MS谱、MS2谱均相同(图 4)。MS:m/z 462.2([M+H]+), m/z 484.2([M+Na]+), m/z 500.2([M+K]+), MS2:m/z 300.3、m/z 138.1、m/z 180.1, 其裂解过程见图 5。确定两者为同一结构化合物:乳糖异烟腙, 相对分子质量为461.16[1,10]。
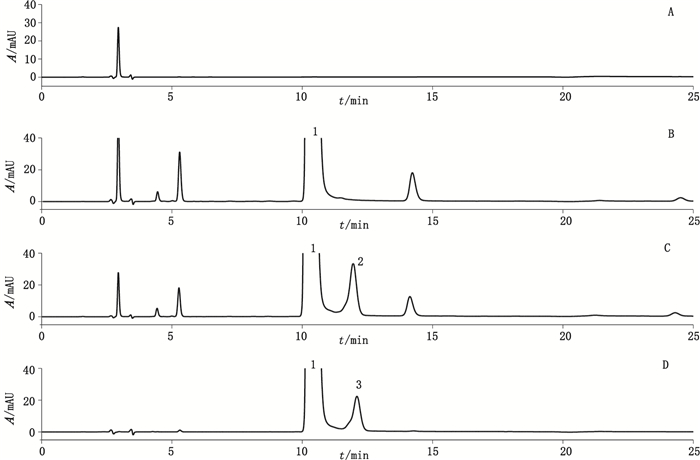
|
1.异烟肼(isoniazid) 2.化合物X(compound X) 3.杂质Ⅱ(impuritiesⅡ) A.辅料乳糖(supplementary material lactose) B.异烟肼原料(raw material isoniazid) C.异烟肼和乳糖反应物(isoniazid with lactose) D.美国山德士异烟肼片(isoniazid tablets from Sandoz.) 图 3 异烟肼与乳糖氧化破坏试验对比色谱图 Figure 3 The HPLC chromatograms of isoniazid with lactose after oxidation destroyed |
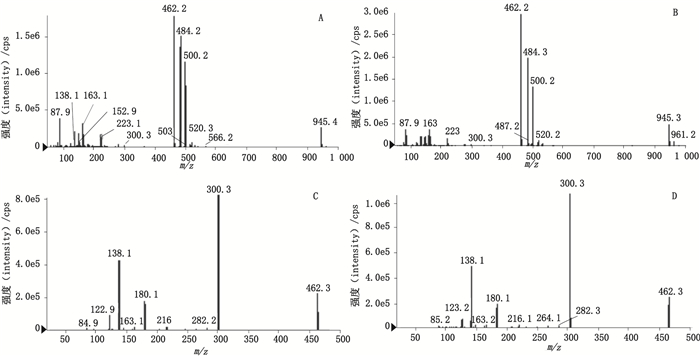
|
图 4 杂质Ⅱ和化合物X的MS谱(A、B)、MS2谱(C、D)图 Figure 4 MS(A, B)and MS2(C, D)spectra of impurityⅡ and compound X |
|
图 5 乳糖异烟腙MS-MS谱裂解过程 Figure 5 Proposed fragmentation pathways for the [M+H]+ ion of lactose isohydrazone(m/z 462) |
本研究对梯度洗脱的色谱条件进行了考察, 结果柱温为28~32 ℃、流速为0.9~1.1 mL·min-1、流动相pH 5.8~6.2时, 杂质峰与其他成分峰达到基线分离, 色谱行为良好。考虑到异烟肼片一致性评价中原料和制剂中杂质的比较, 若采用美国山德士所产异烟肼片作为参比制剂或制剂辅料中有乳糖时, 因异烟肼与乳糖异烟腙较难分离, HPLC方法须进行系统适用性试验且分离度应达到要求。
3.2 原辅料相容性产物—乳糖异烟腙美国山德士所产异烟肼片为FDA规定的参比制剂, 辅料中含乳糖, 异烟肼与乳糖不相容, 发生了Maillard反应:还原糖与胺类基团的反应, 是最典型的药物与辅料的化学作用[11-12]。产生了1个新的杂质:乳糖异烟腙, 含量高达3.1%。USP 39中只对异烟肼原料的杂质进行了控制, 并未对异烟肼片中杂质进行控制, 而文献资料表明, 乳糖异烟腙也具有药物活性, 可杀灭结核菌, 但是其活性远低于异烟肼[1, 10]。按照ICH杂质研究决策树, 美国山德士异烟肼片中乳糖异烟腙的含量远远超出了ICH中Q3B的质控限度, 需要对此杂质进行安全性评价, 为其限度制定提供依据[9]。含胺基类药物在选择辅料时, 应避免使用还原糖的辅料, 而对于异烟肼BCSⅢ、BDDCSⅠ类[2, 13], 最小规格为50 mg的片剂来说, 在处方中添加辅料乳糖是否是一个必要的选择?当我们选用美国山德士异烟肼片作为我国进行异烟肼片质量一致性评价的参比制剂时, 如何控制制剂中乳糖异烟腙的含量将成为制剂工艺需要重点关注的问题之一。
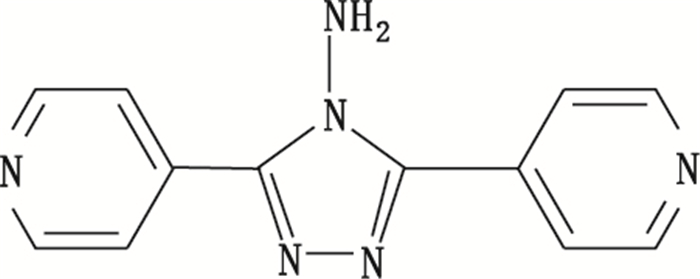
3.3 异烟肼原料合成工艺杂质—三氮唑三氮唑是由原料生产企业浙江新赛科药业有限公司合成, 在原料生产过程中异烟肼分子之间缩合产生的副产物(结构见图 6), 在强力破坏试验中并未产生。属于合成路线标记杂质, 该杂质产生量的大小取决于合成路线和合成工艺中关键控制参数的优化水平, 以及日常生产稳态控制水平[14], 因此应严格控制异烟肼原料合成工艺中的各个参数。
|
图 6 三氮唑结构式 Figure 6 The structure of the three nitrogen triazole impurity |
从检测结果来看, 国内多数企业异烟肼片杂质控制良好, 各杂质总和不大于0.5%。异烟酸、异烟酰胺在原料和国内外企业制剂中均检出, 其中个别企业制剂中的含量超过了ICH 3QB中的鉴定杂质限度0.2%[9], 尤其C企业的异烟酸高达1.35%, 提示个别企业制剂工艺质量控制有待进一步加强。对比H企业的供试品色谱图(图 2-C)与异烟肼原料高温降解图(图 1-F), 可发现两者的有关物质种类非常相似, 且高温降解杂质—杂质Ⅴ的量较大, 由于H企业地处广东, 提示该企业原料或制剂可能长时间受到环境温度、湿度影响而产生降解。企业要进一步开展杂质Ⅴ的结构确认和风险评估, 以确定是否需要针对该杂质进行限度控制。
| [1] |
BECKER C, DRESSMAN JB, AMIDON GL, et al. Biowaiver monographs for immediate release solid oral dosage forms:isoniazid[J]. J Pharm Sci, 2007, 96(3): 522. DOI:10.1002/jps.20765 |
| [2] |
CHI YW, LESLIE ZB. Predicting drug disposition via application of BCS:transport/absorption/elimination interplay and development of a biopharmaceutics drug disposition classification system[J]. Pharm Res, 2005, 22(1): 11. DOI:10.1007/s11095-004-9004-4 |
| [3] |
胡昌勤. 化学药品杂质谱控制的现状与展望[J]. 中国新药杂志, 2015, 24(15): 1727. HU CQ. Current situation and the trend in impurity profiling of chemical drugs[J]. Chin J New Drugs, 2015, 24(15): 1727. |
| [4] |
中华人民共和国药典2015年版. 二部[S]. 2015: 413 ChP 2015. Vol Ⅱ[S]. 2015: 413 |
| [5] |
USP 39. Vol 2[S]. 2016, Official Monographs: 4408
|
| [6] |
陈震. 异烟肼原料药的杂质分析和控制的探讨[J]. 中国临床药理学杂志, 2010, 26(10): 793. CHEN Z. Discussion about the analysis and control of impurities in isoniazid[J]. Chin J Clin Pharmacol, 2010, 26(10): 793. DOI:10.3969/j.issn.1001-6821.2010.10.020 |
| [7] |
FDA. Model Quality Overall Summaries[EB/OL]http://www.fda.gov/Drugs/DevelopmentApprovalProcess/How Drug sare Developed and Approved/Approval Applications/Abbreviated. New Drug Application ANDA Generics/ucm120971. htm.
|
| [8] |
Q3a(R2): Impurities in New Drug Substances, International Conference on Harmonization of Technical Requirements for the Registration of Pharmaceuticals for Human Use[EB/OL]Geneva, 2006. http://www.ich.org
|
| [9] |
Q3b(R2): Impurities in New Drug Products(Revised Guideline), International Conference on Harmonization of Technical Requirements for the Registration of Pharmaceuticals for Human Use[EB/OL]Geneva, 2006. http://www.ich.org
|
| [10] |
RAO KV, KAILASAM S, MENON NK, et al. Inactivation of isoniazid by condensation in a syrup preparation[J]. B World Health Organ, 1971, 45(5): 625. |
| [11] |
SERAJUDDIN A, THAKUR AB, GHOSHAL RN, et al. Selection of solid dosage form composition through drug-excipient compatibility testing[J]. J Pharm Sci, 1999, 88(7): 696. DOI:10.1021/js980434g |
| [12] |
曹筱琛, 贾飞, 陶巧凤. 药物与辅料相容性研究进展[J]. 中国现代应用药学, 2013, 30: 223. CAO XC, JIA F, TAO QF. Progress in the study of drug-excipient compatibility in dosage forms[J]. Chin J Mod Appl Pharm, 2013, 30(2): 223. |
| [13] |
LESLIE ZB, FABIO B, TUDOR IO. BDDCS applied to over 900 drugs[J]. AAPS J, 2011, 13(4): 519. DOI:10.1208/s12248-011-9290-9 |
| [14] |
郝杰, 张哲峰, 毕小平. 原料药杂质研究与控制浅析[J]. 中国现代应用药学, 2015, 32(6): 757. HAO J, ZHANG ZF, BI XP. Analysis of nethod for testing and controlling the impurity of crude drug[J]. Chin J Mod Appl Pharm, 2015, 32(6): 757. |
 2018, Vol. 38
2018, Vol. 38 
