2. 奥克胜美生物科技有限公司, 北京 100085;
3. 第四军医大学, 西安 710032
2. OnkoRx Ltd., Beijing 100085, China;
3. The Fourth Military Medical University, Xian 710032, China
胃泌素(gastrin, GAS)为一类胃肠道激素(包括酰胺化胃泌素34、甘氨酸延伸型胃泌素34、酰胺化胃泌素17、甘氨酸延伸型胃泌素17、胃泌素原)[1-2], 通过结合相应受体发挥促进胃酸分泌与胃肠道粘膜生长作用[3-4], 异常情况下, 过量表达的胃泌素17 s与胃泌素原可通过自分泌、旁分泌或内分泌方式, 导致多种消化系肿瘤(包括胃癌[5-7]、肠癌[8-10]、胰腺癌[11-12]、食管癌[13]等)的发生发展。现有治疗此类肿瘤的传统化疗方法抑瘤作用特异性低, 毒副作用大, 疗效差, 所以, 研发抑瘤作用特异性高, 毒副作用小, 疗效好的新型药物与方法具有重要临床意义。
本研究通过筛选可自分泌胃泌素并表达胃泌素受体的肿瘤细胞系, 应用可同时特异性拮抗胃泌素17 s与胃泌素原的新型抗胃泌素疫苗(GAS-TT)所制备的抗胃泌素抗体, 研究抗胃泌素抗体及其联合传统化疗药对该肿瘤细胞系的抑瘤作用与特点。
1 材料酶标仪(BIO-TEK INSTRUMENTS公司, 型号SynergyHT); 蛋白电泳仪(BIO-RAD公司, 型号BIO-RAD 300);Western blot转印仪(BIO-RAD公司); 凝胶成像系统(ProteinSimple公司, 型号FluorChem HD2);生物安全柜(Thermo Fisher公司, 型号1389);二氧化碳培养箱(三洋公司, 型号15AC); 离心机(VWR公司, 型号37001-294)。
DMEM培养基(Gibco公司, 货号11965118);胎牛血清(Gibco公司, 货号10099141);胰酶(Gibco公司, 货号25300054);MTT(Amresco公司, 货号0793);氟尿嘧啶注射液(天津金耀氨基酸有限公司, 规格为0.25 g:10 mL); 顺铂注射液(Hospira公司, 规格为50 mg:50 mL); 磷酸盐缓冲液(Gibco公司, 货号10010031);甘氨酸延伸型胃泌素17(上海强耀生物科技有限公司, 规格为1 mg·管-1); 酰胺化胃泌素17(上海强耀生物科技有限公司, 规格为1 mg·管-1); GAS抗体(Santa cruz公司, 货号sc-28302);牛血清白蛋白(Calbiochem/EMD Biosciences公司, 货号126575);TS抗体(Life technology公司, 货号18-0405);CCK-BR抗体(Santa cruz公司, 货号sc-33221);GST-π抗体(Santa cruz公司, 货号sc-66000);细胞裂解液(Sigma公司, R0278);聚丙烯酰胺凝胶(Sigma公司, 货号PCG2003);二甲亚砜(500 mL·瓶-1, 国药集团化学试机有限公司, 货号30072418);洗膜缓冲液(Sigma公司, 货号T9039);甘氨酸(Amresco公司, 货号0167);PVDF膜(Amresco公司, 货号E578);甲醇(分析纯, 国药集团化学试机有限公司, 货号10014118);人胃癌细胞系SGC7901(奥克胜美生物科技有限公司); 人结肠癌细胞系SW620(第四军医大学药学院生物技术中心)。
2 方法 2.1 Western blot法检测相关蛋白 2.1.1 细胞总蛋白的制备细胞孵育完成, 弃培养液, 磷酸盐缓冲液漂洗细胞2次, 消化收集细胞, 室温离心(1 000 r·min-1, 5 min); 磷酸盐缓冲液洗涤细胞3次, 重悬细胞, 细胞计数, 各组取约5×105个细胞, 置冰浴; 各管加300 μL裂解液裂解细胞, 吹打混匀, 冰浴30 min; 离心(12 000 r·min-1, 8 min), 取上清, Bradford法测定蛋白浓度; 根据各样品浓度取适量样品, 加入等量蛋白加样缓冲液, 于沸水中煮5 min, 以备SDS-PAGE电泳。
2.1.2 蛋白的免疫印迹鉴定配制聚丙烯酰胺凝胶(6%积层胶, 8%分离胶); 进样30 μL蛋白样品, 电压80 V, 跑到溴酚蓝离底边约为1 cm处; 薄膜和滤纸切成分离胶大小, 将滤纸、凝胶、PVDF膜在转膜液(25 mmol·L-1三羟甲基氨基甲烷, 192 mmol·L-1甘氨酸, 20%甲醇)中浸泡15~30 min, 电压100 V, 转膜120 min; 转膜结束, 取出PVDF膜, 置于5%脱脂牛奶中, 封闭40 min; 洗膜缓冲液洗3次, 每次10 min, 加入一抗(1:500), 室温孵育2 h, 洗膜缓冲液洗3次, 每次10 min; 加入二抗, 4 ℃孵育过夜, 洗膜缓冲液洗3次, 10 min·次-1; 加入底物显色液, 室温避光显色1~2 min, 暗室显色, 全膜压片, 曝光采图。
2.2 MTT法检测细胞活力 2.2.1 细胞培养用二氧化碳培养箱(37%、5%CO2)经DMEM完全培养基(10%胎牛血清、1%双抗)培养肿瘤细胞, 待细胞生长旺盛并处于对数生长期, 经胰酶消化, 用DMEM完全培养基配制成1×104个·mL-1的细胞悬液, 96孔板中每孔加入200 μL, 培养24 h, 待细胞贴壁。
2.2.2 加药孵育细胞贴壁完成, 弃去孔内培养基。用DMEM不完全培养基将酰胺化胃泌素17(amidated gastrin 17, G17)、甘氨酸延伸型胃泌素17(glycine-extend gastrin 17, gly-G17)、抗胃泌素抗体(anti-gastrins antibody, anti-GAS Ab)、顺铂(cisplatin)、氟尿嘧啶(fluorouracil)稀释至所需浓度(即为供试品溶液), 每孔加入供试品溶液200 μL, 阴性对照为相应溶剂, 培养48~72 h。
2.2.3 显色培养完成, 各孔内加入磷酸盐缓冲液配制的MTT溶液(5 mg·mL-1)20 μL, 培养4 h, 离心(1 000 r·min-1, 5 min), 弃上清, 每孔加入二甲亚砜200 μL, 充分振荡15 min, 用酶标仪读取双波长(A570 nm读取波长/A630 nm参比波长)吸收度OD值。
2.2.4 计算方法细胞活力=(供试品组吸收度值/阴性对照组吸收度值)×100%
半数抑制浓度(half-inhibition concentration, IC50)即细胞活力为50%时的供试品溶液浓度。
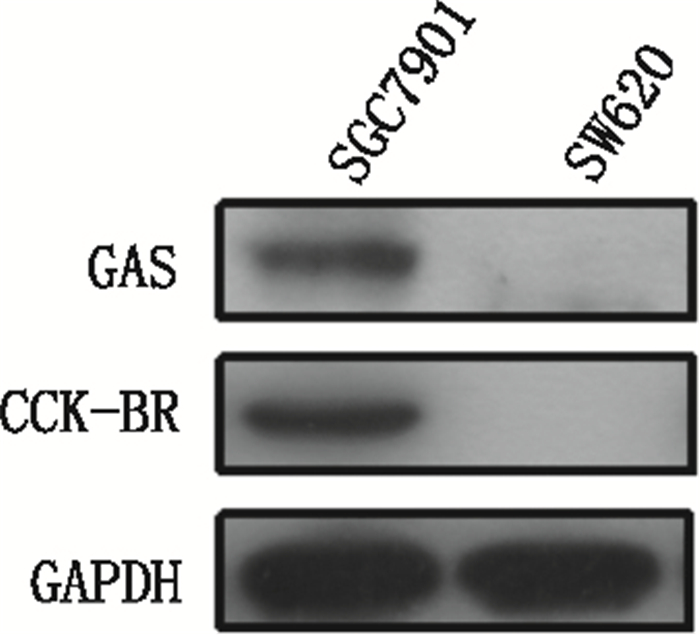
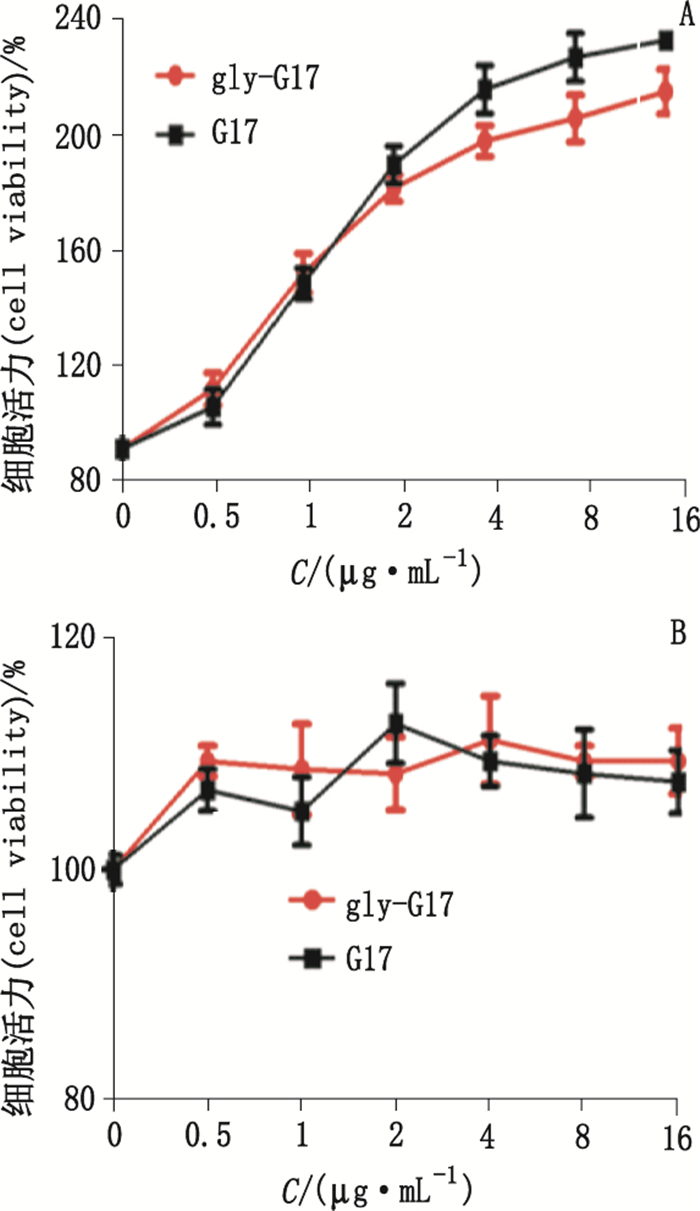
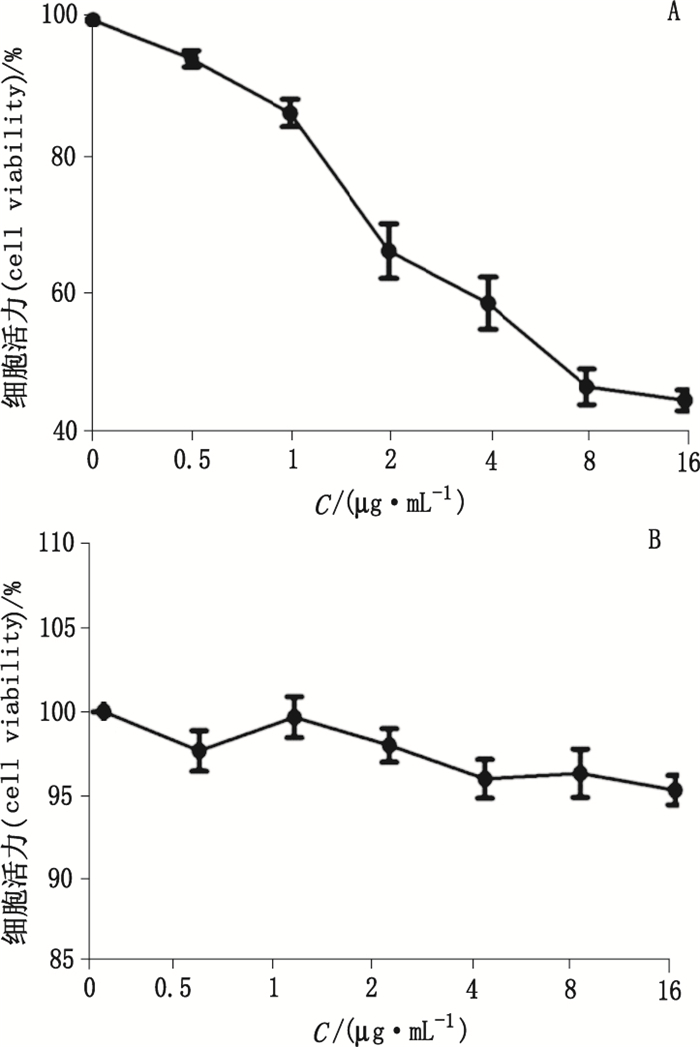
3 结果 3.1 肿瘤细胞系SGC7901的生长具有胃泌素依赖性采用Western blot法检测肿瘤细胞系(SGC7901、SW620)中GAS、胃泌素受体(cholecystokinin B receptor, CCK-BR)的表达。结果显示SGC7901可表达GAS、CCK-BR(见图 1); 且经MTT法证实胃泌素17 s可显著促进其生长(见图 2); 抗胃泌素抗体可显著抑制其生长(见图 3); 而不表达GAS、CCK-BR的SW620, 其生长不受胃泌素17 s与抗胃泌素抗体的影响(见图 2、3)。结果表明SGC7901的生长具有胃泌素依赖性, 其可通过自分泌胃泌素促进自身生长。
|
图 1 肿瘤细胞系(SGC7901、SW620)表达GAS、CCK-BR结果 Figure 1 Expression of GAS and CCK-BR in the tumor cell lines of SGC7901 and SW620 |
|
图 2 G17、gly-G17促进SGC7901(A)、SW620(B)生长结果(n=4) Figure 2 Promotion effect of G17 and gly-G17 on the growth of SGC7901(A)and SW620(B)(n=4) |
|
图 3 anti-GAS Ab抑制SGC7901(A)、SW620(B)生长结果(n=4) Figure 3 Inhibition effect of anti-GAS Ab on the growth of SGC7901(A)and SW620(B)(n=4) |
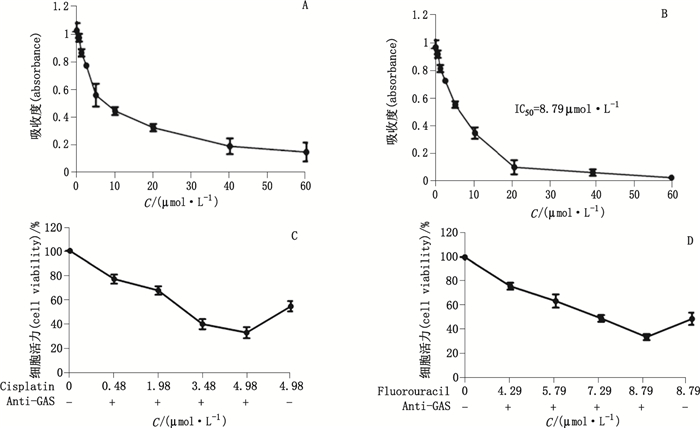
采用MTT法检测单用化疗药对肿瘤细胞SGC7901的抑制作用, 以及抗胃泌素抗体联合化疗药对肿瘤细胞SGC7901的抑制作用(见图 4)。通过比较单用化疗药与抗胃泌素抗体联合化疗药抑瘤方法中各化疗药的IC50, 结果显示抗胃泌素抗体均可降低各化疗药的IC50, 表明抗胃泌素抗体可提高肿瘤细胞对化疗药的敏感性。
|
图 4 顺铂(A)、氟尿嘧啶(B)、顺铂+抗胃泌素抗体(C)、氟尿嘧啶+抗胃泌素抗体(D)抑制SGC7901生长结果(n=4) Figure 4 Inhibition effect of cisplatin(A), fluorouracil(B), cisplatin+anti-GAS Ab(C)and fluorouracil+anti-GAS Ab(C)on the growth of SGC7901(n=4) |
采用Western blot法检测抗胃泌素抗体对SGC7901中耐药性相关蛋白(GST-π、TS)的表达影响。结果显示抗胃泌素抗体可抑制SGC7901内相关耐药蛋白(GST-π、TS)的表达(见图 5), 进而提高细胞对化疗药敏感性。
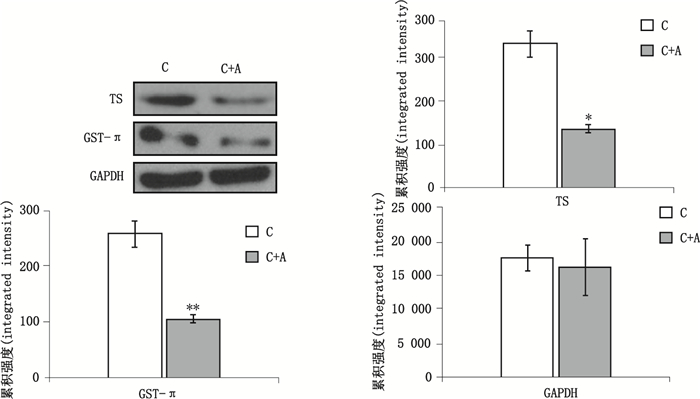
|
C.化学疗法(denotes chemotherapeutics) C+A.化学疗法+抗胃泌素抗体(denotes chemotherapeutics+anti-GAS Ab) *:P < 0.05 vs C; **:P < 0.01 vs C 图 5 抗胃泌素抗体影响SGC7901内耐药相关蛋白TS、GST-π表达结果(n=3) Figure 5 Effect of anti-GAS Ab on the expression of drug resistance proteins TS, GST-π in SGC7901(n= 3) |
肿瘤细胞模型应根据肿瘤的病理生理机制与药物作用机制进行选择, 以便正确阐明药物的药效作用。因相关肿瘤细胞中胃泌素基因的突变导致其可自分泌胃泌素, 胃泌素与相应受体结合后发挥类生长激素样作用, 促进肿瘤的发生发展。理论上抗胃泌素抗体仅对可自分泌胃泌素及相应受体, 且细胞生长具有胃泌素依赖性的肿瘤细胞有抑制作用。
通过选择可表达胃泌素及相应CCK-BR的肿瘤细胞系SGC7901作为体外模型, 本实验结果显示胃泌素可显著促进其生长, 抗胃泌素抗体可显著抑制其生长; 而不表达胃泌素及相应受体的肿瘤细胞系SW620, 胃泌素对其生长无显著影响, 抗胃泌素抗体对其无抑制作用。结果表明SGC7901的生长具有胃泌素依赖性, 也进一步证实胃泌素分子是影响其生长的关键靶点。
4.2 抗胃泌素抗体提高SGC7901对化疗药敏感性的机制肿瘤是一种多基因参与及多步骤发展的全身性、系统性疾病, 恶性增殖与基因组稳定性丧失是肿瘤细胞的基本特征, 如何找到与细胞增殖及基因组稳定性关系最为密切的靶点, 是研发分子靶向药物的关键。
抗胃泌素抗体抑瘤作用与机制研究结果显示, 该抗体可抑制肿瘤细胞内相关耐药蛋白的表达, 进而稳定肿瘤细胞, 提高肿瘤细胞对化疗药(顺铂、氟尿嘧啶)的敏感性。上述结果也表明胃泌素分子是影响SGC7901基因组稳定性的重要靶点。
4.3 抗胃泌素抗体及其联合化疗药抑瘤作用的特点本实验结果以及我们开展的体内实验结果[14]均表明, 抗胃泌素抗体与化疗药联合应用可发挥协同抑瘤作用:一方面, 该抗体能稳定肿瘤细胞, 提高肿瘤对化疗药的敏感性, 且基本无毒性; 另一方面, 因化疗药毒性大, 且其本身可加剧肿瘤细胞基因组的不稳定性, 进而增加肿瘤的耐药性, 通过与分子靶向药物联合应用, 降低其使用剂量, 可进一步增加肿瘤细胞的稳定性, 并在保证疗效的同时降低毒性。
| [1] |
BUNDGAARD JR, REHFELD JF. Post translational processing of progastrin[J]. Results Probl Cell Differ, 2010, 50(1-3): 207. |
| [2] |
CHUECA E, LANAS A, PIAZUELO E. Role of gastrin-peptides in Barrett's and colorectal carcinogenesis[J]. World J Gastroenterol, 2012, 18(45): 6560. DOI:10.3748/wjg.v18.i45.6560 |
| [3] |
DOCKRAY GJ, VARRO A, DIMALINE R, et al. The gastrins:their production and biological activities[J]. Annu Rev Physiol, 2001, 63: 119. DOI:10.1146/annurev.physiol.63.1.119 |
| [4] |
KOVAC S, ANDERSON GJ, BALDWIN GS. Gastrins, iron homeostasis and colorectal cancer[J]. Biochim Biophys Acta, 2011, 1813(5): 889. DOI:10.1016/j.bbamcr.2011.02.007 |
| [5] |
MISHRA P, SENTHIVINAYAGAM S, RANGASAMY V, et al. Mixed lineage kinase-3/JNK1 axis promotes migration of human gastric cancer cells following gastrin stimulation[J]. Mol Endocrinol, 2010, 24(3): 598. DOI:10.1210/me.2009-0387 |
| [6] |
PATEL O, MARSHALL KM, BRAMANTE G, et al. The C-terminal flanking peptide(CTFP)of progastrin inhibits apoptosis via a PI3-kinase-dependent pathway[J]. Regul Peptide, 2010, 165(2-3): 224. DOI:10.1016/j.regpep.2010.08.005 |
| [7] |
XU W, CHEN GS, SHAO Y, et al. Gastrin acting on the cholecystokinin2 receptor induces cyclooxygenase-2 expression through JAK2/STAT3/PI3K/Akt pathway in human gastric cancer cells[J]. Cancer Lett, 2013, 332(1): 11. DOI:10.1016/j.canlet.2012.12.030 |
| [8] |
PATERSON AC, MACRAE FA, PIZZEY C, et al. Circulating gastrin concentrations in patients at increased risk of developing colorectal carcinoma[J]. J Gastroenterol Hepatol, 2014, 29(3): 480. DOI:10.1111/jgh.12417 |
| [9] |
WESTWOOD DA, PATEL O, BALDWIN GS. Gastrin mediates resistance to hypoxia-induced cell death in xenografts of the human colorectal cancer cell line LoVo[J]. Biochim Biophys Acta, 2014, 1843(11): 2471. DOI:10.1016/j.bbamcr.2014.06.016 |
| [10] |
MASIA-BALAGUE M, IZQUIERDO I, GARRIDO G, et al. Gastrin-stimulated Gα13 activation of Rgnef protein(ArhGEF28)in DLD-1 colon carcinoma cells[J]. J Biol Chem, 2015, 290(24): 15197. DOI:10.1074/jbc.M114.628164 |
| [11] |
HARRIS JC, GILLIAM AD, MCKENZIE AJ, et al. The biological and therapeutic importance of gastrin gene expression in pancreatic adenocarcinomas[J]. Cancer Res, 2004, 64(16): 5624. DOI:10.1158/0008-5472.CAN-04-0106 |
| [12] |
CAYROL C, BERTRAND C, KOWALSKI-CHAUVEL A, et al. αV integrin:A new gastrin target in human pancreatic cancer cells[J]. World J Gastroenterol, 2011, 17(40): 4488. DOI:10.3748/wjg.v17.i40.4488 |
| [13] |
BEALES IL, OGUNWOBI OO. Glycine-extended gastrin inhibits apoptosis in Barrett's oesophageal and oesophageal adenocarcinoma cells through JAK2/STAT3 activation[J]. J Mol Endocrinol, 2009, 42(4): 305. |
| [14] |
HE Q, GAO H, GAO M, et al. Anti-gastrins antiserum combined with lowered dosage cytotoxic drugs to inhibit the growth of human gastric cancer SGC7901 cells in nude mice[J]. J Cancer, 2015, 6(5): 448. DOI:10.7150/jca.11400 |
 2018, Vol. 38
2018, Vol. 38 
