2. 上海药物合成工艺过程工程技术研究中心, 上海 201203
2. Shanghai Engineering Research Center of Pharmaceutical Process, Shanghai 201203, China
富马酸沃诺拉赞(vonoprazan fumarate, TAK-1)主要用于胃溃疡、十二指肠溃疡、糜烂性食管炎的治疗以及幽门螺杆菌的根除治疗[1-6]。目前, 国内外药典尚未收载该品种, 文献报道的相关分析方法较少。Yoneyama等[7]建立了同时分离沃诺拉赞与4个人血浆代谢产物的分析方法;Liu等[8]建立了同时分离沃诺拉赞与6个有关物质的分析方法, 但这些方法均不适用于本品合成路线(图 1)的杂质控制。
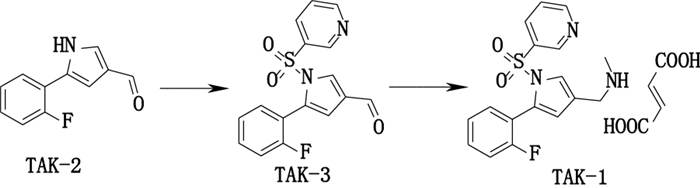
|
图 1 TAK-1合成路线 Figure 1 The synthetic route of TAK-1 |
为较全面了解沃诺拉赞原料生产、贮存过程中可能引入的杂质, 本文根据前期研究[9-10], 分别从其生产工艺和降解途径入手, 分析其可能引入原料药相关的4个有关物质(图 2): 5-(2-氟苯基)-1-(吡啶-3-磺酰基)-1H-吡咯-3-甲醛(TAK-3), 5-(2-氟苯基)-1-(吡啶-3-磺酰基)-1H-吡咯-3-甲醇(TAK-A), 富马酸二[5-(2-氟苯基)-1-(吡啶-3-磺酰基)-1H-吡咯-3-甲基]甲胺(TAK-B)及5-(2-氟苯基) -1H-吡咯-3-甲胺(TAK-C)。本研究建立了HPLC法测定TAK-1原料药中的有关物质, TAK-1与上述已知有关物质和未知杂质分离良好。本法能有效分离并快速检出各有关物质, 方法简便可行, 为TAK-1的质量控制提供参考。
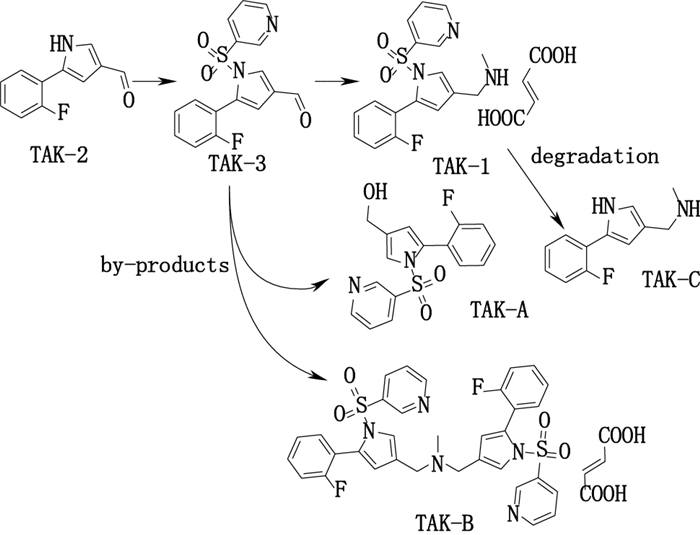
|
图 2 TAK-1有关物质来源 Figure 2 The sources of related substance in TAK-1 |
戴安中国有限公司Dionex U3000高效液相色谱仪;梅特勒-托利多公司Mettller Toledo XS205十万分之一天平;上海天恒医疗器械有限公司GZXGF-DH9123A-JBS电热恒温鼓风干燥箱。
TAK-1样品(批号20160609, 20160623, 20160703)、TAK-1对照品(批号160313, 纯度99.96%)及杂质TAK-3(纯度98.26%)、TAK-A(纯度96.81%)、TAK-B(纯度97.89%)、TAK-C(纯度98.70%)的对照品均由上海医药工业研究院化学制药新技术中心合成提供;乙腈为色谱纯(百灵威科技有限公司), 其余试剂均为分析纯(国药集团化学试剂有限公司), 试验用水为超纯水。
2 方法与结果 2.1 色谱条件色谱柱: Waters Symmetry C18柱(4.6 mm×250 mm, 5 μm);流动相:流动相A为磷酸盐缓冲液(0.02 mol·L-1磷酸氢二钾溶液, 用磷酸调pH至5.0), 流动相B为乙腈, 梯度洗脱(0~20 min, 20%B→80%B;20~22 min, 80%B;22~23 min, 80%B→20%B;23~32 min, 20%B);流速: 1.0 mL·min-1;检测波长: 235 nm;柱温: 30 ℃;进样量: 10 μL。
2.2 溶液的配制 2.2.1 对照品储备液及对照品溶液分别精密称取TAK-1对照品及杂质TAK-3、TAK-A、TAK-B、TAK-C的对照品适量, 用乙腈-水(2:8, v/v)溶解并稀释, 制成质量浓度均为10 μg·mL-1的各对照品储备液;精密量取各对照品储备液均1 mL, 分别置10 mL量瓶中, 用乙腈-水(2:8, v/v)稀释定容, 即得质量浓度均为1 μg·mL-1的各对照品溶液。
2.2.2 系统适用性溶液分别精密称取TAK-1对照品及杂质TAK-3、TAK-A、TAK-B、TAK-C的对照品适量, 用乙腈-水(2:8, v/v)溶解并稀释, 制成每1 mL中含TAK-1 1 mg及各杂质均为1 μg的混合溶液, 即得。
2.2.3 供试品溶液精密称取TAK-1样品10 mg, 置10 mL量瓶中, 用乙腈-水(2:8, v/v)溶解并定容, 制成1 mg·mL-1的溶液, 即得。
2.3 系统适用性试验取系统适用性溶液, 按“2.1”项下色谱条件进样测定, 记录色谱图, 见图 3;TAK-1主峰与各杂质峰能达到良好分离, 各色谱峰间的分离度均大于2.0, 理论塔板数以沃诺拉赞计大于24 000。
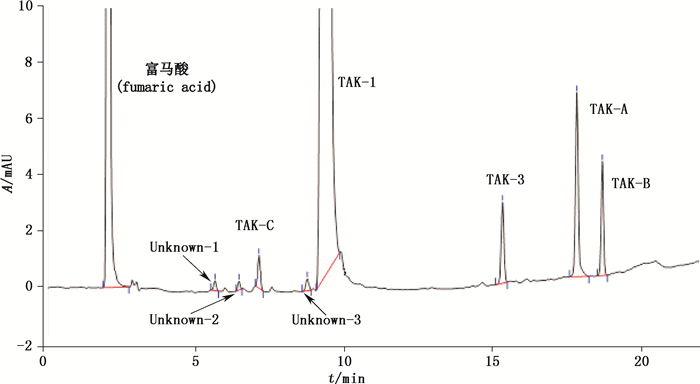
|
图 3 系统适用性谱图 Figure 3 The chromatogram of system suitability |
取TAK-1样品(批号20160609)50 mg共7份, 分别置10 mL量瓶中, 进行不同条件下的降解试验, 试验条件依次为: (a) 未经破坏样品;(b) 加乙腈-水(2∶8, v/v)2 mL溶解, (4 500±500)lx光照48 h;(c) (4 500±500)lx光照48 h;(d) 加乙腈-水(2∶8, v/v)2 mL溶解, 60 ℃加热48 h;(e) 60 ℃加热48 h;(f) 加乙腈-水(2∶8, v/v)2 mL溶解后, 加10%过氧化氢溶液2 mL, 60 ℃放置10 h;(g) 加乙腈-水(2∶8, v/v)2 mL溶解后, 加0.1 mol·L-1氢氧化钠溶液2 mL, 室温放置24 h后, 以0.1 mol·L-1盐酸溶液中和;(h) 加乙腈-水(2∶8, v/v)2 mL溶解后, 加1 mol·L-1盐酸溶液2 mL, 60 ℃加热24 h后, 以1 mol·L-1氢氧化钠溶液中和。上述7种条件下的供试品均用乙腈-水(2∶8, v/v)定容至刻度, 按“2.1”项下色谱条件测定。色谱图见图 4。
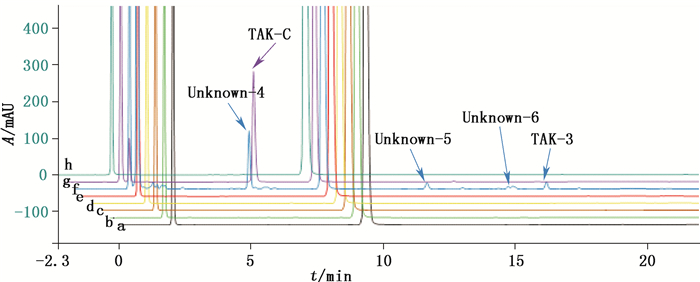
|
a.未破坏溶液(unbreakable sample) b.溶液光照破坏(sample solution destroyed by light) c.样品光照破坏(sample destroyed by light) d.溶液高温破坏(solution destroyed by high temperature) e.样品高温破坏(sample by destroyed high temperature) f.氧化破坏(oxidative destruction) g.碱破坏(alkali destruction) h.酸破坏(acid destruction) 图 4 强制降解试验结果 Figure 4 Results of forced degradation test |
图 4表明, 本品在固态状态下, 对高温、光照较稳定, 杂质个数、总量无明显变化。在60 ℃加热条件下, 主峰纯度因子为999;光照条件下, 新增有关物质为0.15%, 主峰纯度因子为999。本品在溶液状态下, 对高温、光照、酸条件较稳定, 杂质个数、总量无明显变化;对氧化、碱有不同程度的降解。在高温条件下, 新增有关物质0.05%, 主峰纯度因子999;光照条件下, 新增有关物质0.13%, 主峰纯度因子999;在酸破坏条件下, 新增有关物质0.08%, 主峰纯度因子1 000;碱破坏条件下, 本品主要降解产生TAK-C, 新增有关物质9.44%, 主峰纯度因子1 000;在氧化破坏条件下, 本品主要降解产生保留时间6.580 min处的未知杂质, 还伴有少量TAK-3及保留时间13.310 min和16.550 min的未知杂质产生, 有关物质12.47%, 主峰纯度因子1 000。强制降解试验说明富马酸沃诺拉赞原料药在碱性和氧化条件下不稳定。
在上述条件下, 各杂质峰与主峰均能良好分离, 主峰纯度高, 物料保持平衡。说明此方法专属性好, 能够有效检测样品中的降解产物。
2.5 线性关系考察精密量取各对照品储备液适量, 用乙腈-水(2:8, v/v)逐步稀释制成质量浓度分别为0.2、0.5、0.8、1.0、1.2、1.6、2.0 μg·mL-1的系列混合对照品溶液, 按“2.1”项下色谱条件进样测定。以质量浓度C(μg·mL-1)对峰面积A进行线性回归, 得回归方程和相关系数r;分别以沃诺拉赞的回归方程的斜率比上各杂质回归方程斜率, 得各杂质的相对校正因子, 具体结果见表 1。由结果可知, 各有关物质的校正因子均在0.2~5.0范围内, 可用加校正因子的主成分自身对照法计算含量。
|
|
表 1 杂质相对校正因子和线性关系考察结果 Table 1 Impurity relative correction factor and linear relationship results |
取各对照品储备液逐级稀释, 按“2.1”项下色谱条件进样测定, 结果TAK-1、TAK-3、TAK-A、TAK-B、TAK-C的检测下限(S/N=3)分别为101.3、98.7、97.3、101.0、97.6 ng·mL-1, 定量下限(S/N=10)分别为202.6、197.4、194.6、202.0、195.2 ng·mL-1。
2.7 精密度试验取各对照品溶液, 按“2.1”项下色谱条件, 连续进样测定6次, 得沃诺拉赞、TAK-3、TAK-A、TAK-B、TAK-C峰面积的RSD(n=6)分别为0.03%、0.67%、0.74%、0.58%、0.83%。
2.8 重复性试验按“2.2.2”项下方法配制每1 mL含原料药1 mg及各杂质均为1 μg的混合溶液6份, 按“2.1”项下色谱条件进样分析;计算各已知杂质和未知杂质含量, 考察方法重复性。经计算, 各杂质含量均在95%~105%之间, RSD均小于2.0%, 重复性良好。
2.9 各有关物质的回收率试验精密称取各杂质的对照品均约10 mg, 置同一100 mL量瓶中, 加乙腈-水(2:8, v/v)溶解并稀释至刻度, 摇匀, 即得混合杂质对照品储备液;另精密称取批号为20160609的样品约10 mg, 共9份, 分别置10 mL量瓶中, 平均分成3组, 每组分别加入混合杂质对照品储备液80、100、120 μL, 用乙腈-水(2:8, v/v)溶解并稀释至刻度, 摇匀, 即得低、中、高浓度的供试溶液;按“2.1”项下色谱条件进样分析, 结果TAK-3、TAK-A、TAK-B、TAK-C的平均回收率分别为102.6%、99.0%、101.6%、98.5%, RSD分别为0.78%、0.31%、1.2%、0.29%。
2.10 溶液稳定性取系统适用性溶液, 于室温条件下放置, 分别于溶液制备后0、2、6、10、16 h按“2.1”项下色谱条件进样分析, 考察溶液稳定。结果表明, 待测溶液在室温下放置, 溶液较为稳定, 主峰及各杂质峰面积的RSD < 2.0%。
2.11 样品测定取3批TAK-1原料药, 分别按“2.2.3”项下方法制备供试品溶液, 进样测定。采用加校正因子的主成分自身对照法计算已知杂质含量, 采用不加校正因子的主成分自身对照法计算未知杂质含量。TAK-A未检测出, 其他有关物质测定结果见表 2。
|
|
表 2 有关物质测定结果(%) Table 2 Determination results of related substances |
对于氧化降解产生的保留时间为6.580 min的含量为6.35%的主要未知杂质进行初步定性研究, 采用UPLC-MS方法进行相对分子质量的确定, 以推测可能的化学结构。
3.1 UPLC-MS条件色谱条件:采用Waters ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm, 1.7 μm), 以乙腈为流动相A, 0.1%乙酸+2 mmol·L-1醋酸铵溶液为流动相B, 梯度洗脱(0~1.5 min, 85%B→30%B;1.5~2 min, 30%B→ 10%B;2.0~2.5 min, 10%B;2.5~2.51 min, 10%B→85%B;2.51~4.0 min, 85%B), 流速1.0 mL·min-1, 检测波长220 nm, 进样量10 μL。质谱条件:采用ESI离子源, 正离子扫描方式, 喷雾电压4 000 V, 雾化气压103 kPa, 雾化气流6 L·min-1, 加速电压135 V, 毛细管温度320 ℃, 质谱全扫描范围m/z 100~1 000。
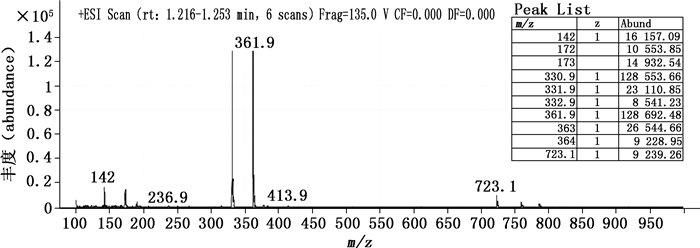
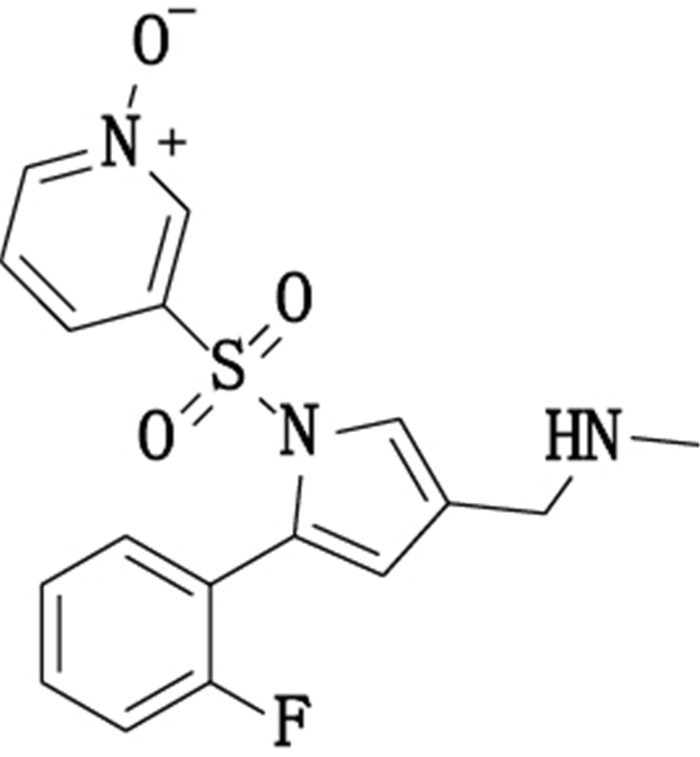
3.2 结构分析取“2.4”项下氧化样品的HPLC进样溶液1.0 mL, 置于10 mL量瓶中, 用乙腈-水(15:85, v/v)稀释至刻度, 摇匀, 进样分析, 得到的HPLC色谱图与采用“2.1”项下条件得到的图谱相似, 可明确定位氧化降解6.58 min未知杂质, 质谱图见图 5。该杂质的分子离子峰[M+H]+为m/z 361.9, 与沃诺拉赞分子比较, 相对分子质量多16, 可能为1个氧原子, 并结合沃诺拉赞的氧化位点, 推测该化合物为1-[5-(2-氟苯基)-1-(N-氧化物吡啶-3-基-磺酰基)-1H-吡咯-3-基]-N-甲基甲胺(图 6)。另有m/z 330.9的峰为其去-NHCH3离子峰。
|
图 5 未知杂质的质谱图 Figure 5 Mass spectrum of unknown impurity |
|
图 6 氧化降解杂质(unknown-4)的可能结构 Figure 6 Possible structure of oxidative degradation of impurities (unknown-4) |
TAK-1及其有关物质的溶液经二极管阵列检测器(DAD)在200~400 nm范围内扫描, 综合各化合物UV光谱图上的最大吸收波长及其检出情况, 确定检测波长为235 nm。DAD结果显示, 各化合物峰纯度因子大于999。
4.2 流动相添加物及pH选择TAK-1、TAK-B、TAK-C结构中均含有氨基, 呈碱性, 在强酸条件下易解离呈离子状态, 保留较弱;在pH为6的流动相中各峰保留加强, 但TAK-1和TAK-C峰拖尾;采用pH为5的磷酸盐缓冲液为流动相的组分, TAK-1和TAK-C峰拖尾改善, 各峰分离度符合要求。
4.3 耐用性考察根据以上色谱条件, 分别考察了不同品牌色谱柱[GL Inertsil ODS 3V柱(4.6 mm×250 mm, 5 μm)、Agilent Poroshell 120 EC-C18柱(4.6 mm×250 mm, 5 μm)]、柱温(25、35 ℃)以及流动相A的pH (pH 4.5、pH 5.5)和流动相起始比例(15:85;25:75);结果表明上述条件下各组分均能得到较好的分离, 证明该方法耐用性较好。
4.4 小结本研究以HPLC法测定TAK-1的有关物质;结果显示, 此HPLC法专属性强, 灵敏度高, 选择性好, 仅用1套分析方法便可检测全部杂质, 简化分析步骤, 大大缩短分析时间, 可作为TAK-1质量控制的有效方法。另外, 本研究通过LC-MS推测1个未知杂质(unknown-4)的结构, 结果显示该杂质为沃诺拉赞的氧化降解杂质。
| [1] |
OTAKE K, SAKURAI Y, NISHIDA H, et al. Characteristics of the novel potassium-competitive acid blocker vonoprazan fumarate (TAK-438)[J]. Adv Ther, 2016, 33(7): 1140. DOI:10.1007/s12325-016-0345-2 |
| [2] |
黄群刚, 朱启华, 徐云根. 可逆型质子泵抑制剂最新研究进展[J]. 药学进展, 2016, 40(6): 445. HUANG QG, ZHU QH, XU YG. Research advances in reversible proton pump inhibitors[J]. Prog Pharm Sci, 2016, 40(6): 445. |
| [3] |
乔元, 黄剑林, 徐媛, 等. 沃诺拉赞富马酸盐与传统质子泵抑制药临床疗效对比研究进展[J]. 药物流行病学杂志, 2017, 26(11): 786. QIAO Y, HUANG JL, XU Y, et al. Research progress in the comparison of the clinical effect between vonoprazan fumarate and traditional potassium-competitive acid blocker[J]. Chin J Pharmacoepidemiol, 2017, 26(11): 786. |
| [4] |
王威, 李金平, 赵宗禹. 沃诺拉赞在治疗幽门螺杆菌感染中的应用现状[J]. 国际消化病杂志, 2017, 37(5): 297. WANG W, LI JP, ZHAO ZY. Application status of vonoprazan in the treatment of Helicobacter pylori infection[J]. Int J Dig Dis, 2017, 37(5): 297. |
| [5] |
陆慧, 陈祥峰. 胃酸相关疾病治疗新药富马酸沃诺拉赞[J]. 药学与临床研究, 2016, 24(5): 395. LU H, CHEN XF. Pharmacological and clinical studies of vonoprazan fumarate[J]. Pharm Clin Res, 2016, 24(5): 395. |
| [6] |
杨君义. 钾离子竞争性酸阻滞剂-沃诺拉赞[J]. 中国新药与临床杂志, 2016, 35(8): 547. YANG JY. Potassium-competitive acid blocker-vonoprazan[J]. Chin J New Drugs Clin Rem, 2016, 35(8): 547. |
| [7] |
YONEYAMA T, TESHIMA K, JINNO F, et al. A validated simultaneous quantification method for vonoprazan (TAK-438F) and its 4 metabolites in human plasma by the liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2016, 1015-1016: 42. DOI:10.1016/j.jchromb.2016.01.051 |
| [8] |
LIU L, CAO N, MA X, et al. Identification, characterization, and high-performance liquid chromatography quantification of process-related impurities in vonoprazan fumarate[J]. J Sep Sci, 2016, 39(7): 1232. DOI:10.1002/jssc.v39.7 |
| [9] |
余倩盈, 刘育, 姚凯, 等. 富马酸沃诺拉赞的合成工艺[J]. 中国医药工业杂志, 2016, 47(11): 1348. YU QY, LIU Y, YAO K, et al. Synthesis of vonoprazan fumaric acid[J]. Chin J Pharm, 2016, 47(11): 1348. |
| [10] |
余倩盈, 刘育, 姚凯, 等. 富马酸沃诺拉赞有关物质的合成和结构确定[J]. 中国医药工业杂志, 2017, 48(3): 372. YU QY, LIU Y, YAO K, et al. Preparation and structural confirmation of the related substances of vonoprazan fumarate[J]. Chin J Pharm, 2017, 48(3): 372. |
 2018, Vol. 38
2018, Vol. 38 
