2. 贵州省食品药品检验所, 贵阳 550004;
3. 贵州医科大学, 贵阳 550004;
4. 遵义医学院, 遵义 563000
2. Guizhou Provincial Food and Drug Inspection Institute, Guiyang 550004, China;
3. Guizhou Medical University, Guiyang 550004, China;
4. Zunyi Medical College, Zunyi 563000, China
咳速停糖浆作为特色苗药, 其处方包括罂粟壳、麻黄、百尾参、虎耳草、吉祥草、桔梗、桑白皮、黄精、枇杷叶9味药材, 具有补气养阴、润肺止咳、益胃生津的功效, 主要用于感冒及急、慢性支气管炎引起的咳嗽及咽干、咳痰、气喘等症。处方中的麻黄具有发汗散寒、宣肺平喘、利水消肿的作用, 盐酸麻黄碱、盐酸伪麻黄碱作为麻黄的主要有效特征成分[1], 属于拟肾上腺类药物, 是国家规定需要严格控制的毒麻类成分[2];又由于该制剂中含有麻醉药品罂粟壳, 若对其用量控制不当, 久服易成瘾, 其主要成分为吗啡、磷酸可待因、盐酸罂粟碱, 可用于止痛、止咳[3-4], 三者均为罂粟壳中的有效成分, 同时也属于强成瘾性成分[5]。2味药材中含有的5个生物碱是咳速停糖浆治疗感冒及咳嗽、气喘等症的主要有效成分, 为了确保制剂的安全性及有效性, 必须控制其含量。目前, 已有大量文献报道[6-17]麻黄、罂粟壳及其不同制剂的含量测定, 其中罗奕等[18]采用HPLC法同时测定咳速停胶囊中4个成分含量, 刘绪林等[19]采用离子对色谱法测定咳速停颗粒中吗啡的含量, 朱平川等[20]采用UPLC-MS/MS法测定速停糖浆中3种兴奋剂类生物碱, 左琳等[21]采用HPLC法测定咳速停糖浆中盐酸麻黄碱的含量。
咳速停糖浆的现有质量标准[22]中只对吉祥草、桔梗、桑白皮3味药材进行薄层鉴别, 含量测定项中仅对罂粟壳中的吗啡及麻黄中的盐酸麻黄碱进行测定。其质量标准简单, 无法控制产品的质量, 确保临床用药安全、有效。因此, 本实验采用HPLC法测定咳速停糖浆中5个生物碱(吗啡、盐酸麻黄碱、盐酸伪麻黄碱、磷酸可待因、盐酸罂粟碱)含量, 以完善、提升咳速停糖浆的质量控制水平。同时, 本实验简化了样品前处理及色谱条件。
1 仪器、试剂与试药 1.1 仪器岛津公司LC-20AD高相液相色谱仪(DAD检测器, LC solution软件工作站), 月旭科技(上海)股份有限公司Welch Ultimate®AQ-C18色谱柱(4.6 mm×250 mm, 5 μm;填料:十八烷基硅烷键合硅胶), 北京科伟永兴仪器有限公司HH-6型电热恒温水浴锅, 梅特勒-托利多仪器上海有限公司XS105DU型电子分析天平。
1.2 试剂与试药吗啡(批号171201-201123)、盐酸麻黄碱(批号171241-201508)、盐酸伪麻黄碱(批号171237-200807)、磷酸可待因(批号171203-201005)、盐酸罂粟碱(批号171214-200404)均购买于中国食品药品检定研究院;磷酸、乙腈、甲醇为色谱纯, 其他试剂均为分析纯, 水为超纯水;10批咳速停糖浆、9味药材(吉祥草、百尾参、枇杷叶、虎耳草、桔梗、黄精、麻黄、桑白皮、罂粟壳)均由贵州百灵有限公司提供, 药材由贵州省食品药品检验所中药标本馆李杨老师鉴定, 根据处方自制阴性样品。
2 方法和结果 2.1 溶液制备 2.1.1 对照品储备液精密称取吗啡0.003 74 g, 置于10 mL量瓶中, 盐酸麻黄碱0.005 06 g, 置于5 mL量瓶中, 盐酸伪麻黄碱0.009 36 g, 置于5 mL量瓶中, 磷酸可待因0.003 58 g, 置于20 mL量瓶中, 盐酸罂粟碱0.000 79 g, 置于20 mL量瓶中, 分别加甲醇溶解并稀释至刻度, 摇匀, 制得吗啡374 µg·mL-1, 盐酸麻黄碱1 012 µg·mL-1, 盐酸伪麻黄碱1 872 µg·mL-1, 磷酸可待因179 µg·mL-1, 盐酸罂粟碱39.5 µg·mL-1的溶液, 即得各个对照品储备液。
2.1.2 混合对照品储备液精密吸取“2.1.1”项下的各对照品储备液均1 mL, 置于同一25 mL量瓶中, 加入0.1%磷酸水溶液稀释定容至刻度, 摇匀, 制得吗啡14.96 µg·mL-1, 盐酸麻黄碱40.48 µg·mL-1, 盐酸伪麻黄碱74.88 µg·mL-1, 磷酸可待因7.16 µg·mL-1, 盐酸罂粟碱1.58 µg·mL-1的混合溶液, 即得。
2.1.3 供试品溶液准确量取咳速停糖浆10 mL, 置125 mL分液漏斗中, 加入氨水3 mL, 振摇1 min后加乙酸乙酯振摇提取3次, 每次15 mL, 合并上层溶液, 水浴挥干, 残渣加0.1%磷酸水溶液定容至10 mL量瓶中, 摇匀, 过0.45 μm滤膜, 即得。
2.1.4 阴性样品溶液分别准确量取缺麻黄药材、缺罂粟壳药材的阴性样品各10 mL, 按“2.1.3”项下方法制备阴性样品溶液。
2.2 色谱条件采用Welch Ultimate®AQ-C18色谱柱(4.6 mm×250 mm, 5 μm), 以乙腈为流动相A, 0.1%磷酸水溶液为流动相B, 梯度洗脱(0~15 min, 4%A;15~30 min, 4%A→10%A;30~60 min, 10%A→40%A), 流速1.0 mL·min-1, 柱温35 ℃, 吗啡、麻黄碱、伪麻黄碱、可待因检测波长为210 nm, 罂粟碱检测波长为250 nm, 进样量10 μL。
2.3 系统适用性试验取供试品溶液、混合对照品溶液及阴性样品溶液分别按“2.2”项下色谱条件进样测定, 结果在供试品溶液和混合对照品溶液的色谱图中吗啡、麻黄碱、伪麻黄碱、可待因、罂粟碱的色谱峰均在60 min内即可达到基线分离, 且所对应的分离度分别为1.600、3.665、1.707、2.777、2.559, 理论塔板数均大于7 500, 且各色谱峰峰形较好, 阴性样品溶液色谱图中未出现待测成分峰, 见图 1。
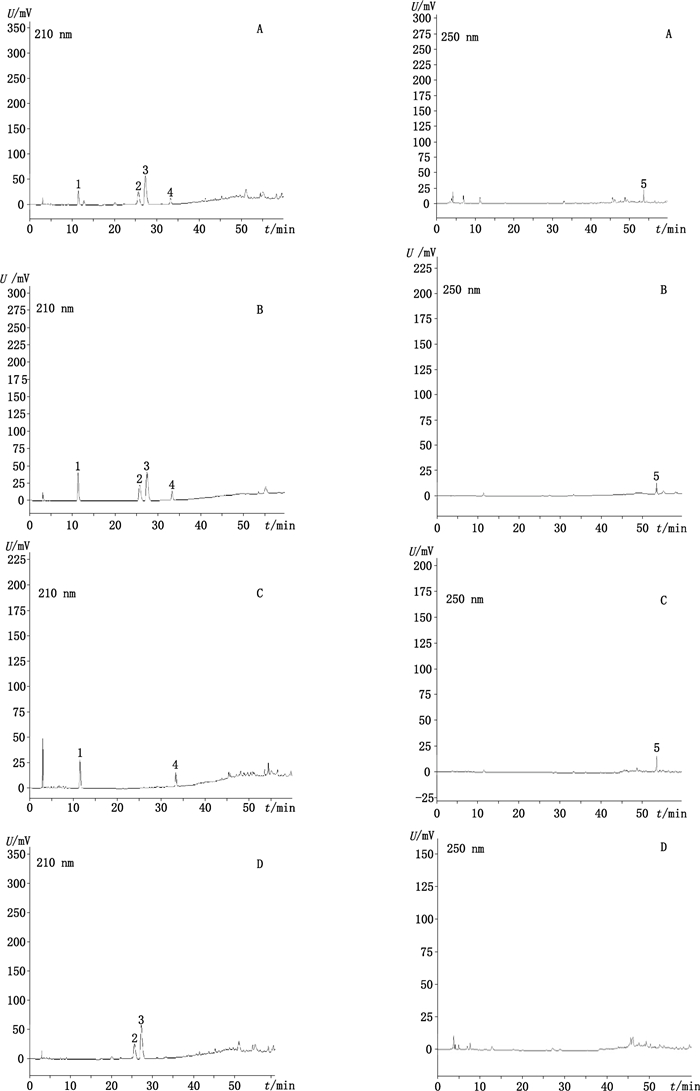
|
1.吗啡(morphine) 2.麻黄碱(ehpedrine) 3.伪麻黄碱(pseudophedrine) 4.可待因(codeine) 5.罂粟碱(papaverine) A.样品(sample) B.混合对照品(mixed reference substances) C.缺麻黄阴性样品(negative sample without Ephedrae Herba) D.缺罂粟壳阴性样品(negative sample without Papaveris Pericarpium) 图 1 HPLC色谱图 Figure 1 HPLC chromatograms |
分别精密吸取“2.1.2”项下混合对照品储备液0.3、0.7、1、1.5、2.0、2.5 mL, 分别置于5 mL量瓶中, 加入0.1%磷酸水溶液定容至刻度, 即得系列浓度的混合对照品溶液, 按“2.2”项下色谱条件进行测定, 记录各色谱峰峰面积。以质量浓度(µg·mL-1)为横坐标, 峰面积为纵坐标, 绘制标准曲线, 分别得吗啡、盐酸麻黄碱、盐酸伪麻黄碱、磷酸可待因、盐酸罂粟碱的回归方程及线性范围, 见表 1。
|
|
表 1 5个生物碱的回归方程及线性范围 Table 1 The regression equations and linear ranges of five alkaloids |
取混合对照品溶液, 按“2.2”项下色谱条件连续进样6次, 记录各色谱峰峰面积。分别计算吗啡、麻黄碱、伪麻黄碱、可待因、罂粟碱峰面积的RSD分别为0.84%、0.41%、0.90%、0.32%、0.31%, 表明仪器的精密度良好。
2.6 重复性试验分别准确量取咳速停糖浆(批号20150610)10 mL, 6份, 按“2.1.3”项下方法平行制备6份供试品溶液, 按“2.2”项下色谱条件分别进行测定, 记录各色谱峰的峰面积。分别计算吗啡、麻黄碱、伪麻黄碱、可待因、罂粟碱含量的RSD分别为2.0%、1.6%、2.9%、1.9%、3.0%, 表明该方法的重复性良好。
2.7 稳定性试验准确量取咳速停糖浆(批号20150610)10 mL, 按“2.1.3”项下方法制备供试品溶液, 按“2.2”项下色谱条件分别在0、3、5、9、15、24 h内测定同一供试品溶液, 记录各色谱峰面积。分别计算吗啡、麻黄碱、伪麻黄碱、可待因、罂粟碱峰面积的RSD分别为1.2%、0.92%、1.2%、1.1%、0.44%, 表明供试品溶液在24 h内稳定。
2.8 加样回收率试验分别准确量取咳速停糖浆(批号20150610)适量, 9份, 分为3组, 每组3份, 每组分别精密加入相当于样品含量50%、100%、150%的混合对照品溶液, 按“2.1.3”项下方法分别制备低、中、高不同浓度的供试溶液, 按“2.2”项下色谱条件分别进行测定, 记录各色谱峰面积。分别计算不同浓度的加样回收率及RSD, 结果见表 2。
|
|
表 2 加样回收率试验 Table 2 Results of recovery test |
分别准确量取同一厂家10个不同批号的咳速停糖浆10 mL, 每批样品取3份, 按“2.1.3”项下方法分别制备供试品溶液, 按“2.2”项下色谱条件分别进行测定, 记录各色谱峰峰面积。按“2.4”项下线性回归方程分别计算5个生物碱的含量, 见表 3。
|
|
表 3 咳速停糖浆中5种生物碱的含量(µg·mL-1, n=3) Table 3 Results of content determination of five alkaloids |
通过查阅相关文献资料[6, 18, 21], 本实验主要考察了乙腈-0.1%磷酸水、乙腈-0.01 mol·L-1磷酸二氢钾缓冲液(含0.1%磷酸)、甲醇-0.1%磷酸水3种流动相。实验结果表明, 甲醇-0.1%磷酸水不能洗脱出5个生物碱。乙腈-0.01 mol·L-1磷酸二氢钾缓冲液(含0.1%磷酸)不利于罂粟碱的分离。乙腈-0.1%磷酸水各色谱峰的分离度均大于1.5, 且各色谱峰的峰形好;在考察磷酸溶液浓度的过程中发现, 酸度对麻黄碱和伪麻黄碱的峰形影响较大, 2个有效成分在0.05%磷酸水条件下色谱峰形差, 0.2%磷酸水与0.1%磷酸水无明显差别, 由于考虑到色谱柱的耐酸程度, 故选择乙腈-0.1%磷酸水作为流动相。
3.2 检测波长的考察通过DAD检测器进行全波长扫描, 发现吗啡、麻黄碱、伪麻黄碱、可待因、罂粟碱分别在209、207、206、211、251 nm波长处具有最大吸收, 考虑末端吸收因素, 选择对比220 nm与210 nm吸收波长处前4个生物碱的峰面积, 结果表明前4个成分在210 nm处响应值大于220 nm处, 且灵敏度高, 通过参考相关文献及资料[6], 最终确定210 nm作为检测波长;罂粟碱虽在251 nm下有最大吸收, 但其在250 nm下响应值最大, 在这2个波长下, 罂粟碱的分离度及灵敏度无明显区别, 考虑准确定量罂粟碱在本品中的含量, 最终确定250 nm作为罂粟碱的检测波长。
3.3 供试品溶液萃取溶剂的优化本实验考察了三氯甲烷、乙酸乙酯、三氯甲烷-氨水、乙酸乙酯-氨水作为萃取溶剂的萃取效果, 结果发现, 不加氨水不利于5个生物碱的萃取, 三氯甲烷-氨水的萃取率并无明显高于乙酸乙酯-氨水, 鉴于减轻试剂对试验人员的危害程度, 确定乙酸乙酯-氨水作为萃取溶剂;氨水用量增加, 对5个生物碱的萃取效果有所增益, 但氨水用量增加到一定程度后, 萃取率无明显变化。试验过程中, 考察了1、2、3、5 mL氨水用量, 最终确定供试品萃取溶剂—氨水的用量为3 mL。
| [1] |
王瑞明, 张玲, 倪艳, 等. HPLC测定苏杏胶囊中盐酸麻黄碱和盐酸伪麻黄碱的含量[J]. 中成药, 2005, 27(6): 651. WANG RM, ZHANG L, NI Y, et al. Determination of ephedrine hydrochloride and pseudoephedrine hydrochloride in Suxing capsules by HPLC[J]. Chin Tradit Pat Med, 2005, 27(6): 651. |
| [2] |
李翔, 刘昄阳, 马建丽, 等. HPLC法测定麻杏口服液中盐酸麻黄碱和盐酸伪麻黄碱的含量[J]. 药物分析杂志, 2014, 34(1): 190. LI X, LIU BY, MA JL, et al. Determination of ephedrine hydrochloride and pseudoephedrine hydrochloride in Maxing oral liquid by HPLC[J]. Chin J Pharm Anal, 2014, 34(1): 190. |
| [3] |
庞晓星, 麻风华, 王清华, 等. UPLC法测定强力枇杷露中吗啡、可待因和罂粟碱的含量[J]. 中医药信息, 2011, 28(1): 35. PANG XX, MA FH, WANG QH, et al. Determination of morphine, codeine and papaverine in strong loquat dew by UPLC[J]. Inf Tradit Chin Med, 2011, 28(1): 35. |
| [4] |
刘敏敏, 刘利颜, 刘丛丛. 液质联用法测定止咳类中成药中5种罂粟壳生物碱[J]. 中国卫生检验杂志, 2016, 26(23): 3353. LIU MM, LIU LY, LIU CC. Detection of 5 papaveris alkaloids in antitussive traditional Chinese medicine with liquid chromatography mass spectrometry[J]. Chin J Health Lab Technol, 2016, 26(23): 3353. |
| [5] |
刘文炜, 高玉琼, 刘建华, 等. RP-HPLC法同时测定哮喘片中吗啡、盐酸麻黄碱、磷酸可待因的含量[J]. 药物分析杂志, 2009, 29(5): 731. LIU WW, GAO YQ, LIU JH, et al. Simultaneous determination of morphine, ephedrine hydrochloride and codeine phosphate in asthma tablets by RP-HPLC[J]. Chin J Pharm Anal, 2009, 29(5): 731. |
| [6] |
刘永利, 李冬梅, 冯丽, 等. "一测多评"法测定咳喘宁片中5种生物碱类成分的含量[J]. 中药新药与临床药理, 2012, 23(4): 464. LIU YL, LI DM, FENG L, et al. Determination of 5 kinds of alkaloids in Kechuanning tablets by quantitative analysis of multi-components by single marker[J]. Tradit Chin Drug Res Clin Pharmacol, 2012, 23(4): 464. |
| [7] |
宋玉国, 张新茹, 李秀芬, 等. HPLC测定清咳平喘颗粒中盐酸麻黄碱和盐酸伪麻黄碱的含量[J]. 中国现代中药, 2014, 16(4): 319. SONG YG, ZHANG XR, LI XF, et al. Determination of ephedrine hydrochloride and pseudoephedrine hydrochloride in Qingke Pingchuan granules by HPLC[J]. Mod Chin Med, 2014, 16(4): 319. |
| [8] |
毕福钧, 林彤. HPLC法测定小儿咳喘宁口服液中盐酸麻黄碱和盐酸伪麻黄碱含量[J]. 中药新药与临床药理, 2014, 25(4): 490. BI FJ, LIN T. Determination of ephedrine hydrochloride and pseudoephedrine hydrochloride in Xiaoer Kechuanning oral liquid by HPLC[J]. Tradit Chin Drug Res Clin Pharmacol, 2014, 25(4): 490. |
| [9] |
覃晓媚, 韦薇, 黄妹春, 等. HPLC法测定小儿清热止咳口服液中盐酸麻黄碱和盐酸伪麻黄碱的含量[J]. 广西科学, 2012, 19(3): 244. QIN XM, WEI W, HUANG MC, et al. Determination of ephedrine hydrochloride and pseudoephedrine hydrochloride in Xiaoer Qingre Zhike oral liquid by HPLC[J]. Guangxi Sci, 2012, 19(3): 244. |
| [10] |
黎春彤, 李翔, 马建丽, 等. HPLC同时测定防风通圣丸中盐酸麻黄碱和盐酸伪麻黄碱的含量[J]. 药物分析杂志, 2016, 36(1): 176. LI CT, LI X, MA JL, et al. Simultaneous determination of ephedrine hydrochloride and pseudoephedrine hydrochloride in Fangfeng Tongsheng pills by HPLC[J]. Chin J Pharm Anal, 2016, 36(1): 176. |
| [11] |
祝婧, 钟凌云, 龚千锋, 等. RP-HPLC法测定麻黄及其炮制品中盐酸麻黄碱和盐酸伪麻黄碱的含量[J]. 江西中医药, 2014, 45(5): 63. ZHU J, ZHONG LY, GONG QF, et al. Determination of ephedrine hydrochloride and pseudoephedrine hydrochloride in Ephedra and its processed products by RP-HPLC[J]. Jiangxi J Tradit Chin Med, 2014, 45(5): 63. |
| [12] |
刘睿, 王宁, 刘志辉. RP-HPLC同时测定宣肺止咳口服液中盐酸麻黄碱、盐酸伪麻黄碱及苦杏仁苷含量[J]. 中国实验方剂学杂志, 2011, 17(16): 91. LIU R, WANG N, LIU ZH. Simultaneous determination of ephedrine hydrochloride, pseudoephedrine hydrochloride and amygdalin hydrochloride in Xuanfei Zhike oral liquid[J]. Chin J Exp Tradit Med Form, 2011, 17(16): 91. DOI:10.3969/j.issn.1005-9903.2011.16.026 |
| [13] |
郝红艳, 郭济贤, 顺庆生, 等. HPLC和HPCE法测定罂粟壳中3种生物活性生物碱[J]. 药学学报, 2000, 13(4): 289. HAO HY, GUO JX, SHUN QS, et al. Determination of 3 kinds of bioactive alkaloids in the opium poppy by HPLC and HPCE[J]. Acta Pharm Sin, 2000, 13(4): 289. |
| [14] |
席晓岚, 李明炬, 李宇飞. 用高效液相色谱法测定咳清胶囊中磷酸可待因的含量[J]. 贵阳医学院学报, 2004, 29(1): 42. XI XL, LI MJ, LI YF. Determination of codeine phosphate in Keqing capsules by HPLC[J]. J Guiyang Med Coll, 2004, 29(1): 42. |
| [15] |
符映均, 张莉, 胡浩彬, 等. 气相色谱法测定强力枇杷露中薄荷脑、磷酸可待因、吗啡、盐酸罂粟碱的含量[J]. 药学与临床研究, 2014, 22(5): 416. FU YJ, ZHANG L, HU HB, et al. Determination of menthol, codeine phosphate, morphine and papaverine hydrochloride in Qiangli Pipa syrup by GC[J]. Pharm Clin Res, 2014, 22(5): 416. |
| [16] |
太成梅, 金圣龙, 笔雪艳, 等. UPLC法测定止嗽胶囊中吗啡、可待因和罂粟碱的含量[J]. 中国药品标准, 2015, 16(3): 187. TAI CM, JIN SL, BI XY, et al. Determination of morphine, codeine and papaverine in Zhisou Huatan capsules by UPLC[J]. Pharm Stand China, 2015, 16(3): 187. |
| [17] |
罗奕, 姚文丽, 吴琳琳, 等. HPLC法同时测定咳速停胶囊中4种成分[J]. 中成药, 2017, 39(1): 102. LUO Y, YAO WL, WU LL, et al. Simultaneous determination of 4 kinds of components in Kesuting capsules[J]. Chin Tradit Pat Med, 2017, 39(1): 102. |
| [18] |
刘绪林, 付蕾, 刘磊, 等. 离子对色谱法测定咳速停颗粒中吗啡的含量[J]. 中国医院药学杂志, 2008, 28(6): 421. LIU XL, FU L, LIU L, et al. Determination of morphine in Kesuting granules by LPC[J]. Chin J Hosp Pharm, 2008, 28(6): 421. |
| [19] |
朱平川, 岑卫健, 范晓苏. UPLC-MS/MS法测定咳速停糖浆中3种兴奋剂类生物碱[J]. 中成药, 2014, 36(5): 970. ZHU PC, CEN WJ, FAN XS. Determination of 3 kinds of agonist alkaloids in Kesuting syrup by UPLC-MS/MS[J]. Chin Tradit Pat Med, 2014, 36(5): 970. |
| [20] |
左琳, 孟凤梅. HPLC法测定咳速停糖浆中盐酸麻黄碱的含量方法研究[J]. 黑龙江科技信息, 2015(26): 2. ZUO L, MENG FM. Determination of ephedrine hydrochloride in Kesuting syrup by HPLC[J]. Heilongjiang Sci Technol Inf, 2015(26): 2. DOI:10.3969/j.issn.1673-1328.2015.26.002 |
| [22] |
WS-10215(ZD-0215)-2002-2011Z中成药地方标准上升国家标准部分(内科肺系分册)[S]. 2011 WS-10215(ZD-0215)-2002-2011Z The Upgrade of Local Standards of Chinese Patent Medicine: the part of National Standards (Internal Medicine Branch of Lung)[S]. 2011 |
 2018, Vol. 38
2018, Vol. 38 
