2. 北京市药品检验所, 北京 102206
2. Beijing Institute for Drug Control, Beijing 102206, China
牛黄为牛科动物牛Bos taurus domesticus Gmelin的干燥胆结石,是一种常用的名贵中药,具有清心、开窍、凉肝、豁痰的功效[1]。由于牛黄功效显著,在中药成方制剂中被广泛应用,有650多种制剂含有牛黄,其中临床急重症病用药品种就有43种,包括安宫牛黄丸、牛黄清心丸,大活络丸等[2]。由于牛黄的需求量较大且资源紧缺,为了缓解临床用药需求,解决人民用药问题,出现了人工牛黄、体外培育牛黄和培植牛黄3种代用品。由于培植牛黄制备困难,目前几乎已无企业生产。
牛黄、体外培育牛黄和人工牛黄的质量标准均收载于《中华人民共和国药典》2015年版一部。牛黄及体外培育牛黄功能主治一致,但人工牛黄与之区别明显,且牛黄价格较高,不同牛黄间价格差距也较大,使得市场上出现以次充好甚至造假情况[3],给临床使用带来风险和隐患。鉴于市场上牛黄的使用问题,2004年国家食品药品监督管理总局“关于牛黄及其代用品使用问题的通知”(国食药监注[2004]21号)中对牛黄的使用进行严格规定, “对于国家药品标准处方中含牛黄的临床急重症用药品和国家药品监督管理部门批准的含牛黄的新药,可以将处方中的牛黄以培植牛黄、体外培育牛黄代替牛黄等量投料使用,但不得以人工牛黄代替。”
为解决目前牛黄及其代用品的质量问题,学者们进行了大量研究,主要有薄层色谱、高效液相色谱、近红外漫反射光谱技术和液质联用等[4-7], 但由于牛黄及代用品成分相似,研究难度较大。目前关于牛黄及代用品研究主要集中在牛黄、人工牛黄、体外培育牛黄中胆汁酸类成分及胆红素的含量测定研究[8-12],未能进行更深一步研究。本文通过高效液相色谱-蒸发光散射(HPLC-ELSD)联用技术,对牛黄及代用品中胆汁酸类成分进行分析,研究建立了牛黄及代用品的特征图谱,结合多元统计分析和相似度评价的方法对所得到的特征图谱进行分析;采用液质(LC-MS)联用的技术对特征图谱主要的特征峰进行指认,结合液质指认的结果,对牛黄及代用品中共有的主要胆汁酸类成分进行含量测定,包括牛磺胆酸、甘氨胆酸2个结合类胆汁酸成分及胆酸和去氧胆酸2个游离类胆汁酸成分,从主要共有成分的含量和含量比例上对牛黄及代用品进行对比,从而揭示牛黄及代用品成分比例上的差异。所建立的方法为牛黄及代用品的质量控制提供了有效的技术支持,可用于牛黄及代用品质量控制。
1 仪器、试药及样品Waters 2695高效液相色谱仪(Waters公司,包括四元低压梯度泵、在线脱气机、柱温箱和自动进样器、Empower 2色谱工作站),Alltech 2000ES型蒸发光检测器(奥泰公司),Agilent 6320 Ion Trap LC/MS(Agilent公司,包括二元高压梯度泵、在线脱气机、柱温箱和自动进样器),Mettler XS105DU电子天平(梅特勒公司),Millipore纯水机(密理博公司)。
乙腈和醋酸铵均为色谱纯(Fisher公司),甲酸为质谱级(Fisher公司),水为超纯水(Millipore超纯水系统制备)。
对照物质:牛黄对照药材(中国食品药品检定研究院,批号121328-201302),体外培育牛黄(武汉健民大鹏药业有限公司,批号120702),人工牛黄(中国食品药品检定研究院,批号121197-201204);对照品:甘氨胆酸钠(Sigma G7132,含量以97%计),牛磺胆酸钠(中国食品药品检定研究院,批号110815-201308,含量以88.9%计),胆酸(批号100078-200414,含量以100%计),去氧胆酸(批号0724-200207,含量以100%计)。
样品:牛黄及其代用品体外培育牛黄及人工牛黄均为市售,其中牛黄12批,编号为CB13~CB23,CB38;体外培育牛黄13批,CB1~CB11,CB30,CB32;人工牛黄11批,编号为CB25~CB29,CB33~CB37,CB31。
2 溶液的制备 2.1 混合对照品溶液取甘氨胆酸钠、牛磺胆酸钠、胆酸和去氧胆酸的对照品适量,加甲醇制成每1 mL含0.4 mg的混合溶液,即得。
2.2 供试品溶液取牛黄、体外培育牛黄及人工牛黄各约0.1 g,分别加甲醇10 mL,超声处理(功率300 W,频率40 kHz)30 min,放冷,滤过,取续滤液,作为供试品溶液Ⅰ。取牛黄对照药材、体外培育牛黄(批号120702)及人工牛黄对照药材各约0.05 g,分别加甲醇25 mL,超声处理(功率300 W,频率40 kHz)30 min,放冷,滤过,取续滤液,作为供试品溶液Ⅱ。
3 试验条件 3.1 HPLC-ELSD条件采用Waters SymmetryshieldTM C18色谱柱(4.6 mm×250 mm,5 μm),以乙腈为流动相A,0.2%甲酸溶液(含10 mmol·L-1醋酸铵)为流动相B,梯度洗脱(0~5 min,2%A→35%A;5~12 min,35%A→37%A;12~23 min,37%A;23~45 min,37%A→50%A),流速1.0 mL·min-1,柱温为35 ℃;蒸发光检测器检测,漂移管温度102 ℃,氮气1.9 mL·min-1。分别精密吸取混合对照品溶液、供试品溶液Ⅰ和甲醇(作为空白)各10 μL,注入液相色谱中进行测定,色谱图见图 1。

|
1.甘氨胆酸(glycocholic acid)2.牛磺胆酸(taurocholic acid)3.胆酸(cholic acid)4.去氧胆酸(deoxycholic acid) 图 1 对照品(A)、CB13号牛黄(B)、人工牛黄对照药材(C)、120702号体外培育牛黄(D)和空白(E)的HPLC色谱图 Figure 1 HPLC chromatograms of mixed reference standards(A), Calculus Bovis No.CB13(B), reference material of artificial Calculus Bovis(C), in vitro cultivated Calculus Bovis No.120702(D)and blank(E) |
LC条件:色谱柱、流动相组成及流动相梯度洗脱程序、流速、柱温同“3.1”项;MS条件:采用电喷雾离子源正离子模式(ESI+),全扫描模式,扫描范围m/z 50~1 000,雾化器压力0.17 MPa,脱溶剂气流速9.0 mL·min-1(氮气);脱溶剂气温度325 ℃(氮气),裂解电压0.8 V,分流比1:6。精密吸取10 μL的供试品溶液Ⅱ注入液质联用仪器进行测定,牛黄、体培牛黄和人工牛黄特征图谱一级质谱总离子流图见图 2。
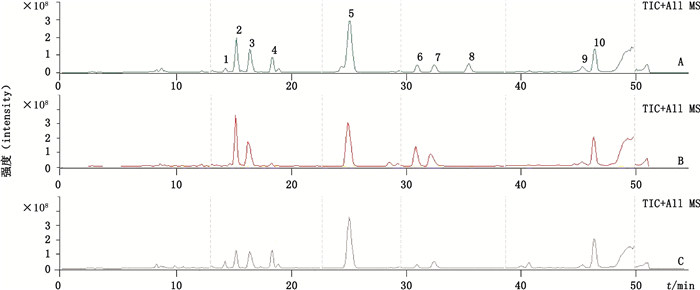
|
图 2 人工牛黄(A)、牛黄(B)和体外培育牛黄(C)一级质谱总离子流图 Figure 2 Total ion chromatograms(TICs)of artificial Calculus Bovis(A), Calculus Bovis(B)and in vitro cultivated Calculus Bovis(C) |
精密吸取供试品溶液Ⅰ 10 μL,按HPLC-ELSD条件连续进样6次,记录色谱图。采用国家药典委员会的中药色谱指纹图谱相似度评价系统2008版(以下简称相似度评价系统)对所得的色谱图进行数据分析处理。结果显示,所得色谱图的相似度不低于0.99,表明仪器精密度良好。
4.1.2 重复性试验取牛黄(CB13号样品),按“2.2”项下方法制备供试品溶液Ⅰ共5份,按HPLC-ELSD条件进样10 μL进行检测,记录色谱图。采用相似度评价系统对所得的色谱图进行数据分析处理,结果显示,所得色谱图的相似度不低于0.99,表明该方法重复性良好。
4.1.3 稳定性试验精密吸取按“2.2”项下方法制得的同一供试品溶液Ⅰ 10 μL,按HPLC-ELSD条件分别于0、2、4、6、8、12 h依次进样,记录色谱图。采用相似度评价系统对所得的色谱图进行数据分析处理,结果显示,所得色谱图的相似度不低于0.98,表明供试品溶液至少在12 h内稳定。
4.2 指纹图谱建立取收集到的36个批次牛黄及代用品,按“2.2”项下方法制备供试品溶液Ⅰ,按HPLC-ELSD条件进样10 μL进行指纹图谱测定,采用相似度评价系统生成牛黄、体外培育牛黄和人工牛黄对照指纹图谱,如图 3所示。采用相似度评价系统,分别对不同牛黄采用不同的对照谱图计算相似度,相似度结果主要分布在0.85以上,见表 1。相似度结果表明,所建立的指纹图谱可用于对牛黄、体外培育牛黄和人工牛黄进行质量控制和鉴别,可采用相似度进行评价。

|
图 3 牛黄(A)、体外培育牛黄(B)和人工牛黄(C)对照指纹图谱 Figure 3 Reference fingerprints of Calculus Bovis(A), in vitro cultured Calculus Bovis(B)and artificial Calculus Bovis(C) |
|
|
表 1 相似度计算结果 Table 1 The similarity result |
精密吸取供试品溶液Ⅱ 10 μL,按LC-MS条件进样,对上述指纹图谱中特征峰进行指认。通过与对照品保留时间、准分子离子峰和质谱裂解碎片比较,确定峰2、3、5、8、9和10分别为甘氨胆酸、牛磺胆酸、胆酸、猪去氧胆酸、鹅去氧胆酸和去氧胆酸;结合胆酸类成分质谱裂解过程具有连续脱水分子,且17位侧链丢失的规律,通过准分子离子峰和质谱裂解碎片,推断峰6和7分别为甘氨鹅去氧胆酸和牛磺去氧胆酸。结果见表 2,结构式见图 4。
|
|
表 2 牛黄及代用品指纹图谱色谱峰指认 Table 2 Identified compounds in HPLC fingerprints |

|
A.峰2(peak 2),甘氨胆酸(glycocholic acid)B.峰3(peak 3),牛磺胆酸(taurocholate acid)C.峰5(peak 5),胆酸(cholic acid)D.峰6(peak 6),甘氨鹅去氧胆酸(glycochenodeoxycholic acid)E.峰7(peak 7),牛磺去氧胆酸(taurodeoxycholic acid)F.峰8(peak 8),猪去氧胆酸(hyodeoxycholic acid)G.峰9(peak 9),鹅去氧胆酸(chenodeoxycholic acid)H.峰10(peak 10),去氧胆酸(deoxycholic acid) 图 4 牛黄及代用品指纹图谱中胆汁酸类成分的结构式 Figure 4 Structures of bile acids in fingerprint chromatography of Calculus Bovis and its substitutes |
分别精密吸取混合对照品溶液1、2、5、10、15、20 μL,按HPLC-ELSD条件进样测定。分别以进样量(μg)的常用对数值(X)为横坐标,峰面积的常用对数值(Y)为纵坐标,绘制标准曲线,进行线性回归,结果甘氨胆酸、牛磺胆酸、胆酸和去氧胆酸回归方程分别为:
Y=1.588 6X+5.744 8 r=0.999 6
Y=1.530 3X+5.782 8 r=0.999 3
Y=1.576 9X+5.721 1 r=0.999 4
Y=1.520 4X+5.873 0 r=0.999 8
线性范围分别为0.420~8.392、0.477~9.544、0.442~8.840和0.447~8.952 μg。
5.1.2 精密度试验精密吸取同一混合对照品溶液10 μL,按照HPLC-ELSD条件连续进样6次,计算甘氨胆酸、牛磺胆酸、胆酸和去氧胆酸峰面积的RSD分别为1.8%、1.3%、1.2%和2.3%,表明仪器精密度良好。
5.1.3 重复性试验取同一批次牛黄(CB13号样品),按照“2.2”项下方法制备供试品溶液Ⅰ 6份,按照HPLC-ELSD条件进样10 μL进行分析,计算含量及其RSD。结果甘氨胆酸、牛磺胆酸、胆酸和去氧胆酸平均含量分别为37.5 mg·g-1(RSD=2.3%),26.1 mg·g-1(RSD=1.1%),20.6 mg·g-1(RSD=2.1%)和10.2 mg·g-1(RSD=1.9%),表明该方法重复性良好。
5.1.4 稳定性试验精密吸取同一供试品溶液Ⅰ 10 μL,按HPLC-ELSD条件,分别于0、4、8、12、24 h进样,计算峰面积,结果甘氨胆酸、牛磺胆酸、胆酸和去氧胆酸峰面积的RSD分别为1.8%、1.9%,1.5%和2.0%。结果表明,供试品溶液Ⅰ在24 h内稳定性良好。
5.1.5 回收率试验取牛黄(CB13号样品)粉末6份,每份约0.05 g,精密称定,按样品含量的100%加入对照品,按照“2.2”项下供试品溶液Ⅰ的制备方法制备供试溶液,按HPLC-ELSD条件进样10 μL,计算回收率,结果表明方法回收率良好,见表 3。
|
|
表 3 回收率结果 Table 3 Recoveries |
取牛黄及其代用品,按“2.2”项下方法制备供试品溶液Ⅰ,按HPLC-ELSD条件进样10 μL进行测定,以外标法计算含量,牛黄及其代用品含量的测定结果见图 5。

|
图 5 牛黄及代用品含量测定结果柱状图 Figure 5 The bar graph of Calculus Bovis and its substitutes assay results |
本文采用HPLC-ELSD指纹图谱对收集到的36个批次牛黄、体培牛黄和人工牛黄中主要的胆酸类成分进行了研究。结果表明牛黄、体外培育牛黄和人工牛黄胆汁酸类成分类型基本一致,但色谱峰比例上存在较大差异。采用Champattern软件进行主成分分析,结果表明人工牛黄、牛黄和体外培育牛黄分别分布在3个较为独立的空间,反映出同种类型牛黄成分较为一致,但3种牛黄之间化学成分的含量差异较大。同时在甘氨胆酸、牛磺胆酸的维度上牛黄所占比例较大,在鹅去氧胆酸和胆酸的维度上体外培育牛黄和人工牛黄所占比例较大,见图 6。上述分析显示,牛黄与体外培育牛黄、人工牛黄在胆汁酸类成分上存在较大差异,主要表现在结合胆酸和游离胆酸的比例上。

|
图 6 牛黄及代用品指纹图谱主成分分析结果 Figure 6 Principal component analysis results of Calculus Bovis and its substitutes |
通过LC-MS技术,对牛黄及代用品的特征图谱进行指认,结果表明牛黄、体外培育牛黄、人工牛黄所含的胆汁酸类成分类型基本一致,均含有甘氨胆酸、牛磺胆酸、甘氨鹅去氧胆酸、牛磺去氧胆酸、鹅去氧胆酸和去氧胆酸;但人工牛黄中含有猪去氧胆酸,牛黄和体外培育牛黄中不含猪去氧胆酸。由于甘氨胆酸、牛磺胆酸、胆酸和去氧胆酸为牛黄、人工牛黄和体外培育牛黄共有成分,且成分含量较高,故选择此4个成分作为含量测定指标。从整体上讲,人工牛黄中4个胆酸成分的总量最高,牛黄与体外培育牛黄总量几乎相当。从单个胆酸成分的含量上分析,甘氨胆酸、牛磺胆酸在体外培育牛黄中含量较低,但在牛黄和人工牛黄中含量较高;胆酸在体外培育牛黄和人工牛黄中含量较高,在牛黄中含量较低;去氧胆酸在体外培育牛黄中含量较高,而在牛黄中含量低,人工牛黄中去氧胆酸含量规律性不强。这个结果与文献报道[13]的结果存在较大差异,这也可能是由于样本的问题,所以目前仍要增大样品的收集,从而对结果进行确证。从同类型不同批次的胆汁酸类成分看,体外培育牛黄在批间一致性方面明显优于牛黄,其作为牛黄的代用品使用具有质量更易控制的优势。而牛黄与人工牛黄批间差异较大,牛黄可能是由于牛黄来源地域不同而存在差异,而人工牛黄可能是由于企业使用牛胆粉质量参差不齐而存在差异[14]。
本次研究结果表明,牛黄与体外培育牛黄在胆汁酸类成分总量大体相当,与文献报道[15]一致。但牛黄中甘氨胆酸与牛磺胆酸含量明显高于体外培育牛黄,牛黄中胆酸和去氧胆酸含量明显低于体外培育牛黄。文献报道甘氨胆酸具有明显的抗氧化、抗炎、免疫调节等作用,牛磺胆酸具有显著的解热镇痛作用。尤其值得探讨的是在心肌细胞保护作用方面,牛磺胆酸具有心肌细胞保护作用,而胆酸、去氧胆酸具有损伤心肌细胞的作用[16]。这些成分含量的差异是否会造成牛黄与体外培育牛黄在某些方面药理药效作用的差异,甚至导致相关制剂药理药效的差异,需要进一步研究。根据2004年国家食品药品监督管理局“关于牛黄及其代用品使用问题的通知”(国食药监注[2004]21号)中的规定,在中药成方制剂中牛黄可以与体外培育牛黄等同使用。初步推测可能是牛黄与体外培育牛黄中所含除结合胆酸之外的成分,如牛磺酸、胆固醇、胆红素等,成分之间存在协同作用,促使两者药理药效作用相当。鉴于本次研究发现的问题,建议体外培育牛黄生产企业能够更进一步提高产品的质量,开展相应的药理药效比较研究,以保证牛黄制剂的质量,降低人民用药的风险。
| [1] |
中华人民共和国药典2015年版. 一部[S]. 2015: 70 ChP2015. Vol I[S]. 2015: 70 |
| [2] |
胳小梅, 杜伟, 张火春, 等. 含牛黄品种质量标准及监管的分析和探讨[J]. 中成药, 2009, 31(3): 444. LUO XM, DU W, ZHANG HC, et al. Analysis and discussion on standards and supervision of preparations containing Calculus Bovis[J]. ChinTradit Pat Med, 2009, 31(3): 444. |
| [3] |
王慧春. 名贵药材天然牛黄及其伪品的鉴别[J]. 青海医药杂志, 2005, 35(6): 52. WANG HC. Identification of Calculus Bovis and its adulterant[J]. Qinghai Med J, 2005, 35(6): 52. |
| [4] |
KONG WJ, XING XY, XIAO XH, et al. Multi-component analysis of bile acids in natural Calculus Bovis and its substitutes by ultrasound-assisted solid-liquid extraction and UPLC-ELSD[J]. Analyst, 2012, 137(24): 5845. |
| [5] |
PENG C, TIAN JX, LV MY, et al. Development and validation of a sensitive LC-MS-MS method for the simultaneous determination of multicomponent contents in artificial Calculus Bovis[J]. J Chromatogr Sci, 2014, 52(2): 128. DOI:10.1093/chromsci/bms256 |
| [6] |
林培英, 王洪, 董昕, 等. 近红外漫反射光谱法测定天然牛黄粉中人工牛黄粉的掺人量[J]. 中药材, 2005, 28(3): 177. LIN PY, WANG H, DONG X, et al. Determination of the artificial bezoar powder in the bezoar powder by near-infrared diffuse reflectance spectrometry[J]. J Chin Med Mater, 2005, 28(3): 177. |
| [7] |
常增荣, 邸峰, 周富荣. 薄层扫描法测定天然牛黄中胆酸含量的研究[J]. 中国中药杂志, 1999, 24(11): 684. CHANG ZR, D IF, ZHOU FR. Quantitative determination of cholic acid in Calulus Bovis[J]. China J Chin Mater Med, 1999, 24(11): 684. DOI:10.3321/j.issn:1001-5302.1999.11.017 |
| [8] |
KONG WJ, WANG JB, ZENG QC. Fingerprint-efficacy study of artificial Calculus Bovis in quality control of Chinese material medica[J]. Food Chera, 2011, 127(3): 1342. DOI:10.1016/j.foodchem.2011.01.095 |
| [9] |
ZANG QC, WANG JB, KONG WJ, et al. Searching for the main anti-bacterial components in artificial Calculus Bovis using UPLG and microcalorimetry coupled with multi-linear regression analysis[J]. J Sep Sci, 2011, 34(23): 3330. DOI:10.1002/jssc.v34.23 |
| [10] |
KONG WJ, JIN Gh, LIU W, et al. Development and validation of a UPCL-ELSD method for fast simultaneous determination of five bile derivatives in Calculus Bovis and its medicinal preparations[J]. Food Chem, 2010, 120(4): 1193. DOI:10.1016/j.foodchem.2009.11.064 |
| [11] |
李珂, 高允生, 李炳龙, 等. 天然牛黄与酶促牛黄HPLC-ELSD特征图谱比较[J]. 药物分析杂志, 2012, 32(4): 616. LI K, GAO YS, LI BL, et al. HPLC-ELSD comparison of specific chromatogram of natural Calculus Bovis and Calculus Bovis cultivated by glucuronidase[J]. Chin J Phaim Anal, 2012, 32(4): 616. |
| [12] |
李河, 王唯红, 齐永秀, 等. 6种胆酸类成分的HPLC-EI5D测定法及在两种牛黄中的含量比较[J]. 中国药学杂志, 2010, 45(8): 626. LI K, WANG WH, QI YX, et al. Deteimination and comparison of six cholic acid derivatives in two kinds of Calculus Bovis by HPLC-ELSD assay[J]. Chin Pharm J, 2010, 45(8): 626. |
| [13] |
FENG CY, LI XP, ZHANG CL. Development of a rapid and simple LC-MS/MS method for identification and quality control of natural Calculus Bovis and Calculus Bovis Sativus[J]. Anal Methods, 2015, 7(18): 7606. DOI:10.1039/C5AY01288K |
| [14] |
石岩, 郑天骄, 魏锋, 等. 牛胆粉指纹图谱模式识别及多组分测定研究[J]. 中国中药杂志, 2016, 41(13): 2487. SHI Y, ZHENG TJ, WEI F, et al. Studies of pattern recognition of fingerprint profile of cattle bile powder and the determination of multi-component in it[J]. China J Chin Mater Med, 2016, 41(13): 2487. |
| [15] |
蔡红娇, 裘法祖, 刘仁则. 体外培育牛黄的药学研究[J]. 中国天然药物, 2004, 2(6): 335. GAl HJ, QIU FZ, LIU RZ. Studies on the pharmacy of in-vitro cultivated Calculus Bovis[J]. Chin J Nat Med, 2004, 2(6): 335. |
| [16] |
TAKAHASHI K, AZUMA Y, SHIMADA K, et al. Quality and safety issues related to traditional animal medicine:role of taurine[J]. J Biomed Sci, 2010, 17(Suppl 1): S44. DOI:10.1186/1423-0127-17-S1-S44 |
 2018, Vol. 38
2018, Vol. 38 
