某些具有潜在治疗作用的细胞因子与人IgG Fc融合后,可提高其在血液中的半衰期,增强其治疗效果。目前临床上用于治疗类风湿关节炎(RA)的Enbrel(药品通用名依那西普,etanercept)以及治疗老年性黄斑变性(AMD)的VEGF-Trap(药品通用名阿柏西普,Aflibercept)等,均为相应细胞因子与人IgG Fc的融合蛋白[1]。Fc-融合蛋白多是一种高度糖基化的糖蛋白,糖基化的不均一性,往往导致其体内活性及体内半衰期的差异[2]。糖基化的不均一性直接体现在其电荷异质性的差异。因此,应用快速、稳定、准确、灵敏的电荷异质性分析方法控制Fc-融合蛋白的电荷不均一性,是一项关键质量控制指标。
新一代全柱成像毛细管等电聚焦电泳技术[capillary isoelectric focusing-whole column imaging detection,CIEF-WCID(iCE)][3]是一种将毛细管等电聚焦电泳与全柱成像技术相结合的新型电泳系统,它结合了毛细管电泳自动分离检测、可定量分析和成像技术的双重优势。当样品进行等电聚焦时,互补性金属氧化物半导体(complementary metal-oxide-semiconductor translator,CMOS)作为成像检测技术,可以对整个聚焦分离通道聚焦过程进行实时监控和记录,这一过程中无须移动样品,直接进行检测。该方法使得分析结果不受干扰,提高了电荷异质性分析的准确性和重复性,通常能在几分钟内完成测定,所需时间大大缩短,可实现高通量检测[4-5]。全柱成像毛细管等电聚焦(iCIEF)在重组生物技术产品,尤其在高度糖基化等复杂样品电荷异质性分析的准确性、重复性和分辨率较平板胶等电聚焦(IEF)及毛细管等点聚焦(cIEF)具有明显的优势,更有利于重组生物技术药物的质量控制和稳定性研究[6-7]。
本研究采用全柱成像毛细管电泳技术及带涂层的毛细管柱对VEGFR:Fc-融合蛋白药物的电荷异质性进行分析。通过对样品分析浓度、聚焦时间、两性电解质种类及比例多个参数进行优化,并对助溶剂(不同浓度尿素)对分离效果的影响进行了研究,使iCIEF分离效果达到最佳,准确性、重复性可满足质量控制的要求。
1 实验材料 1.1 试剂载体两性电解质AESlyte HR3-10、HR5-8,阳极电解液(80 mmol·L-1 H3 PO4+0.1% MC)、阴极电解液(100 mmol·L-1 NaOH+0.1% MC)和pI Marker(pI 6.14、pI 8.79)均由Advanced Electrophoresis Solutions(AES)公司提供;尿素、羟丙基甲基纤维素(HPMC)均购自Sigma公司。
1.2 仪器CE Infinite全柱成像毛细管等电聚焦电泳仪及氟碳(FC)涂层毛细管购自AES公司;Centrifuge 5415R离心机Eppendorf公司;实验用水均为Milli-Q(Millipore公司)超纯水。
1.3 样品重组人VEGFR:Fc-融合蛋白:齐鲁制药有限公司药物研究院生物技术研究所制备。
2 实验方法 2.1 全柱成像毛细管等电聚焦电泳(iCIEF)在CE Infinite自动进样器位置1放入装有0.3% HPMC的清洗瓶。设置方法参数,每次进样前吸取0.3% HPMC 50 μL冲洗毛细管,依次在各样品位置吸取50 μL样品进样,聚焦时间6 min(1 kV-1 min,2 kV-1 min,3 kV-4 min)。
2.2 毛细管等电聚焦电泳(cIEF)按照BECKMAN COULTER公司PA 800 plus毛细管电泳仪使用说明进行。
2.3 平板胶等电聚焦电泳(IEF)使用Phast Gel IEF预制胶,按照Phast System电泳仪(均为GE公司产品)使用说明进行平板胶IEF实验。
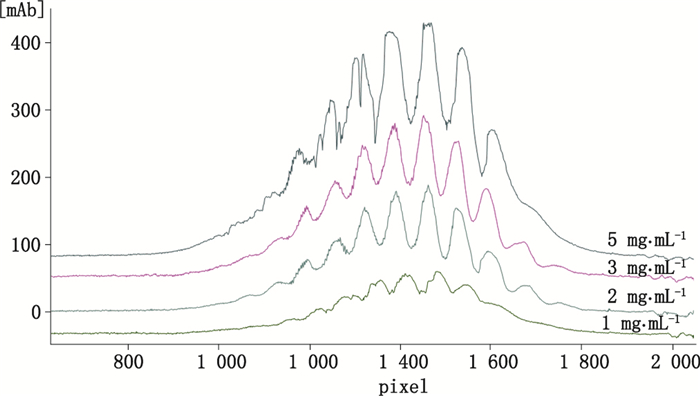
3 条件优化及结果 3.1 全柱成像毛细管等电聚焦电泳(iCIEF)条件优化 3.1.1 蛋白浓度的选择合适的样品工作蛋白浓度(简称蛋白浓度)可使iCIEF分析具有较好的灵敏度和可重复性。一般较高的蛋白浓度会使分析结果具有较好的灵敏度和低丰度电荷异质体的精确定量,但过高的蛋白浓度往往导致iCE毛细管中蛋白质聚集而析出,电泳图谱上出现尖峰信号,导致其重复性变差[8]。
本研究在初步采用尿素4 mol·L-1(终浓度)、两性电解质AESlyte HR3-10-AESlyteHR5-8(1:3)、聚焦时间7 min的条件下,选择了几种不同的蛋白浓度进行分析对比,结果表明2 mg·mL-1和3 mg·mL-1的VEGFR:Fc-融合蛋白iCIEF分析均具有较高的分离度、灵敏度和重复性。为降低高浓度蛋白易发生聚集和吸附毛细管的风险,选择样品终浓度为2 mg·mL-1。
|
图 1 不同工作浓度的VEGFR:Fc-融合蛋白全柱成像毛细管等电聚焦电泳图谱 Figure 1 iCE electropherograms of VEGFR:Fc-fusion protein with various concentrations in the prepared samples |
CE及iCE分析中,通常需要向运行缓冲液中加入适量的助溶剂来改善电泳分离的选择性,抑制蛋白沉淀、管壁吸附,提高分离效率。常用助溶剂种类有表面活性剂、有机溶剂、两性离子等,如尿素、蔗糖、甘油、聚乙二醇等,以阻止等电聚焦中样品沉淀及分子间的相互作用[8-9]。尿素作为一种使用较为普遍的助溶剂,目前在CE分析中应用较多。尿素添加到缓冲液中可以增加蛋白质溶解度,避免蛋白沉淀,其不同浓度对缓冲液的助溶能力有不同影响。当尿素浓度过低时,起不到增溶作用,蛋白容易沉淀;浓度过高会增加缓冲液中离子强度,进而产生大量的焦耳热,使柱效降低,峰展宽,分离度下降,甚至引起蛋白质变性[10-11]。
本研究在初步采用样品蛋白终浓度2 mg·mL-1、两性电解质AESlyte HR3-10-AESlyteHR5-8(1:3)、聚焦时间7 min的条件下,对0、2、4、6 mol·L-1尿素浓度进行考察,不同尿素浓度对样品分离效果的影响见图 2。如图所示,不加尿素,分离过程中会发生蛋白沉淀(出现锯齿状尖峰信号)。当尿素浓度为4 mol·L-1时,VEGFR:Fc-融合蛋白各电荷异质峰分离效果较好,因此实验中选择尿素的终浓度为4 mol·L-1。

|
图 2 不同浓度尿素VEGFR:Fc-融合蛋白全柱成像毛细管等电聚焦电泳图谱 Figure 2 The effects of urea concentration on the separation of VEGFR:Fc-fusion protein in iCIEF |
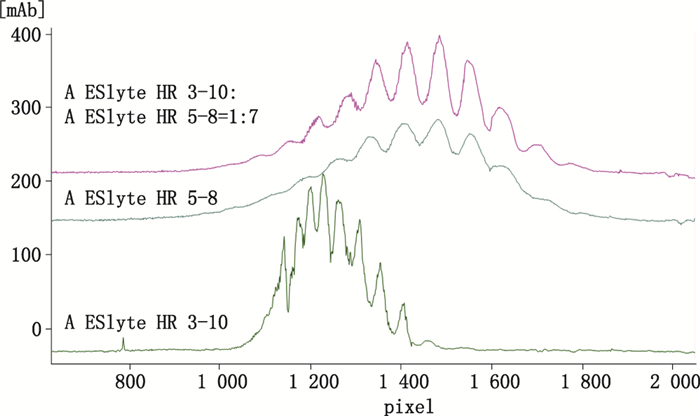
在初步确定样品蛋白终浓度2 mg·mL-1、尿素终浓度4 mol·L-1、聚焦时间7 min的条件下,选择不同范围及配比的两性电解质,AESlyte HR3-10、AESlyte HR5-8,进行优化,确定最佳的分离条件。
仅用AESlyte HR3-10的两性电解质中VEGFR:Fc-融合蛋白电荷异构体未完全分离;仅用HR5-8两性电解质中VEGFR:Fc-融合蛋白电荷异质峰较宽、峰高偏低。在AESlyte HR3-10-AESlyte HR5-8(1:7)的条件下获得了较好的VEGFR:Fc-融合蛋白等电聚焦分离效果,图谱见图 3。因此,确定VEGFR:Fc-融合蛋白iCIEF分析所用两性电解质为AESlyte HR3-10-AESlyte HR5-8(1:7)。
|
图 3 不同pH范围两性电解质的VEGFR:Fc-融合蛋白全柱成像毛细管等电聚焦电泳图谱 Figure 3 The effects of pH range of ampholytes on the separation of VEGFR:Fc-fusion protein in iCIEF |
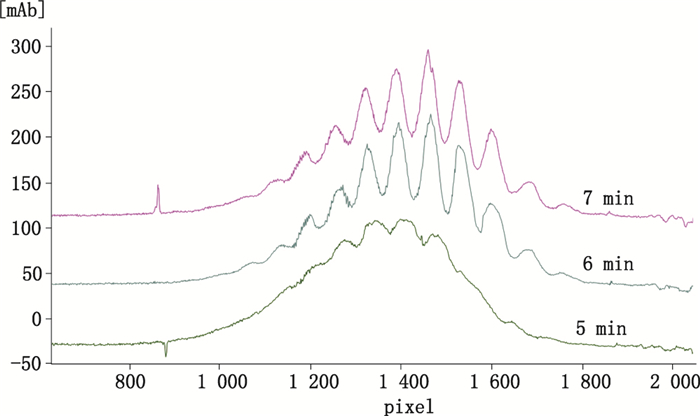
在“3.1.1”、“3.1.2”和“3.1.3”优化条件的基础上,进行聚焦时间的选择,以期得到较好的VEGFR:Fc-融合蛋白分离聚焦时间。聚焦电压为第1 min-1 kV、第2 min-2 kV、第3 min-及以上3 kV,聚焦时间为3个阶段的时间之和。结果如图 4所示,5 min时各峰尚未聚焦完成,聚焦6 min和7 min各峰峰形均无明显变化,说明6 min已聚焦完成。因此选择聚焦时间为6 min。
|
图 4 不同聚焦时间的VEGFR:Fc-融合蛋白全柱成像毛细管等电聚焦电泳图谱 Figure 4 The effects of focusing time on the separation of VEGFR:Fc-fusion protein in iCIEF |
通过不同蛋白浓度、尿素浓度、两性电解质、聚焦时间的优化,最终确定VEGFR:Fc-融合蛋白全柱成像毛细管等电聚焦电泳的实验条件(见表 1)。
|
|
表 1 VEGFR:Fc-融合蛋白全柱成像毛细管等电聚焦电泳实验条件 Table 1 Experiment condition of VEGFR:Fc-fusion protein in iCIEF |
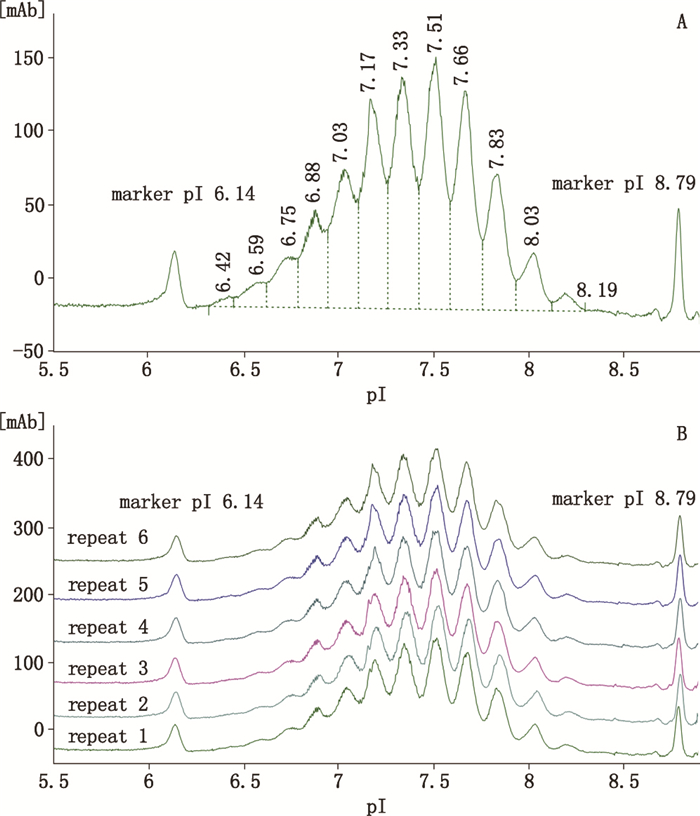
应用“3.1”优化了的方法对VEGFR:Fc-融合蛋白iCIEF检测的重复性进行考察。图 5为pI Marker(pI 6.14、pI 8.79)与样品的混合溶液单针检测及连续进样6次的等电聚焦电泳图谱,在重复实验中pI Marker及样品峰形和峰位置均无明显变化,主要峰pI相对标准偏差均小于0.5%。重复性良好,该方法能够满足该类产品质量控制的要求。
|
图 5 pI Marker(pI 6.14、pI 8.79)和样品单针检测(A)及连续进样6次(B)iCIEF电泳图谱 Figure 5 iCIEF electropherograms of pI marker and sample single run(A) and repeat six times(B) |
采用全柱成像毛细管等电聚焦(iCIEF)、毛细管等电聚焦(cIEF,PA800 plus)及凝胶(平板预制胶)等电聚焦(IEF)3种方法,分别检测VEGFR:Fc-融合蛋白的电荷异质性,并进行对比。结果如图 6,iCIEF分离效果显著好于cIEF和IEF,且分析时间仅需几分钟,远小于cIEF和IEF(约为cIEF的1/10,IEF的1/20),大大缩短检测时间,可实现高通量。
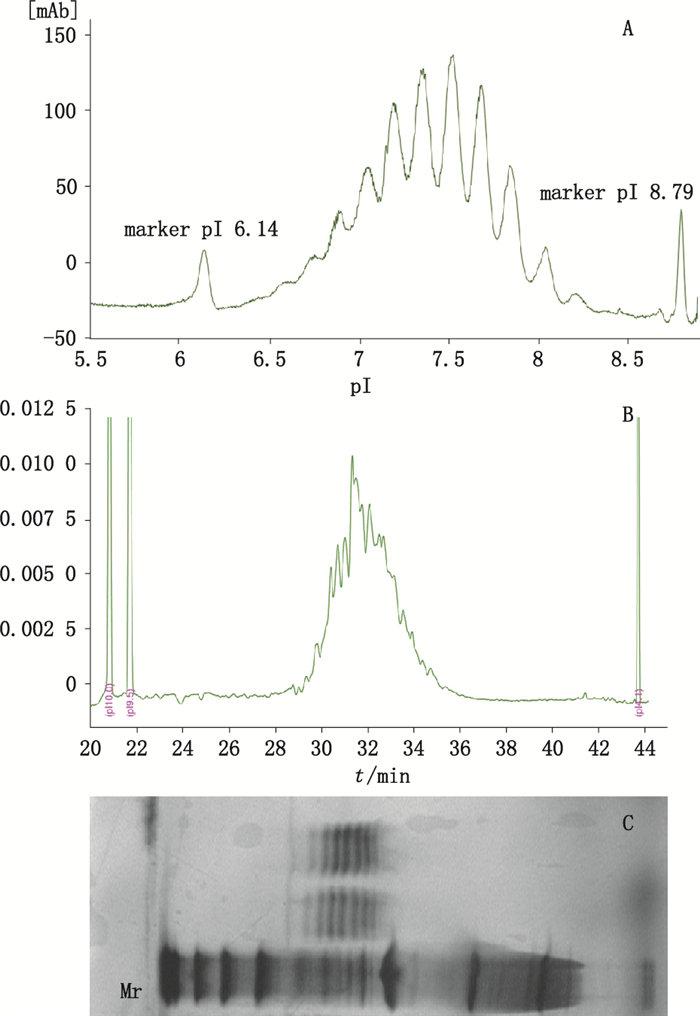
|
A.iCIEF AESlyte HR 3-10-AESlyte HR 5-8(1:7)(iCIEF ran with mixture of broad and narrow pH range AESlyte)B.cIEF Pharmalyte(cIEF ran with pharmalyte(by PA800 plus))C.平板预制胶IEF(slab gel IEF) 图 6 VEGFR:Fc-融合蛋白经iCIEF、cIEF(PA800 plus)及IEF分析结果对比 Figure 6 Profile comparison of iCIEF, cIEF and slab gel IEF |
重组人Fc-融合蛋白多为唾液酸化的糖蛋白,唾液酸化的不均一性导致Fc-融合蛋白类药物多呈现复杂的电荷异质性。唾液酸化水平为该类药物的关键质量属性(CQA),iCIEF出色的重复性和准确性可用于控制该类药物的唾液酸化水平相关产品质量和批间一致性。
本研究针对重组人VEGFR:Fc-融合蛋白电荷异质性及iCIEF图谱特征,并依据多批次及多次检测结果的一致性,可参考图 7,将峰1~6作为目标峰控制产品质量,并制定合适的质控标准。参考以上研究结果针对该产品iCIEF质控标准可设定为:本品应有6个主峰,pI在7.2-8.0之间(峰1~6),且iCIEF图谱应与典型图谱基本一致。
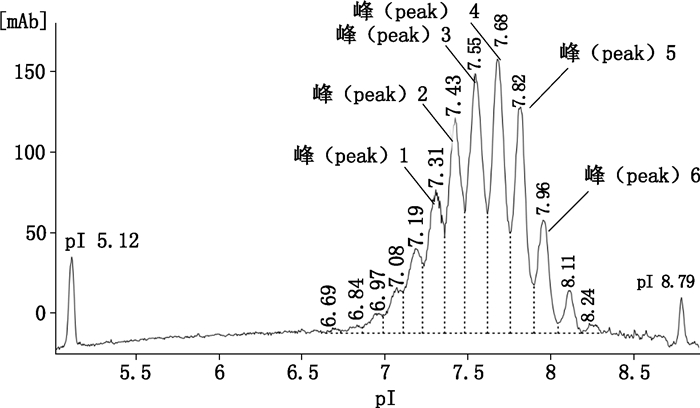
|
图 7 重组人VEGFR:Fc-融合蛋白iCIEF图谱 Figure 7 iCIEF electropherogram of rhIgG VEGFR:Fc-fusion protein |
常规的平板预制胶IEF较毛细管等电聚焦电泳(cIEF)稳定性差,特别是在融合蛋白等高度糖基化的重组生物制品检测中表现更为突出[12]。虽然cIEF可获得较稳定结果,但由于检测器为单点检测器,样品聚焦后需采用物理或化学迁移的方法,使各聚焦条带顺序通过检测窗口进行检测。在迁移过程中可能会造成pH梯度改变、蛋白质沉淀等[13],从而使已完成聚焦的条带发生重叠和扭曲,导致分辨率下降、结果偏离;iCIEF则是蛋白质样品在两性电解质聚焦后,应用全柱实时成像系统,无须移动样品,充分保持毛细管等电聚焦的高重复性、高柱效和高分辨率,后者的准确性和稳定性明显高于前者[14-16]。
尽管应用iCIEF技术进行重组蛋白药物电荷异质性的研究有文献报道,但针对上述高度糖基化的Fc-融合蛋白,应用iCIEF技术进行电荷异质性分析以及条件优化的研究报道甚少。本研究应用iCIEF技术开展VEGFR:Fc-融合蛋白类药物的电荷异质性分析,并进行了全面的方法优化,得到了分离效果较好的实验条件,能够较好地控制该类产品的质量。相比于其他等电聚焦电泳方法,该技术快速、准确、重复性好,且具有高通量的优势,这将为重组Fc-融合蛋白类药物电荷异质性研究及质量控制提供一种更为准确、稳定、高效的分析方法。
本研究对Fc-融合蛋白类药物及其他重组类生物制品的电荷异质性分析及质量控制,特别是对提高生物类似药的表征分析技术水平,保障重组蛋白类生物技术药物质量标准的高要求,具有重要的实际指导意义和应用价值。
| [1] |
MORELAND LW. Soluble tumor necrosis factor receptor (p75) fusion protein (Enbrel) as a therapy for rheumatoid arthritis[J]. Rheum Dis Clin North America, 1998, 24(3): 579. DOI:10.1016/S0889-857X(05)70027-2 |
| [2] |
何椿鹏. 不同TNFR-Fc融合蛋白N-糖基化结构分析及其对蛋白功能影响的初步研究[D]. 南宁: 广西医科大学, 2013 HE CP. N-glycan Structural Analysis of Different TNFR-FcFusion Proteins and the Influence on Protein Functions[D]. Nanning: Guangxi Medical University, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10598-1013248605.htm |
| [3] |
WU J, TRAGAS C, WATSON A, et al. Capillary isoelectric focusing with whole column detection and a membrane sample preparation system[J]. Anal Chim Acta, 1999, 383: 67. DOI:10.1016/S0003-2670(98)00489-9 |
| [4] |
刘洁欣, 方均建, 王心正, 等. 全柱成像毛细管等电聚焦电泳测定艾塞那肽等电点[J]. 生物技术通讯, 2014, 25(3): 381. LIU JX, FANG JJ, WANG XZ, et al. Determination of isoelectric point of exenatide by capillary isoelectric focusing-whole column imaging detection[J]. Lett Biotechnol, 2014, 25(3): 381. |
| [5] |
LI N, KESSLER K, BASS L, et al. Evaluation of the iCE280 analyzer as a potential high-throughput tool for formulation development[J]. J Pharm Biomed Anal, 2007, 43(3): 963. DOI:10.1016/j.jpba.2006.09.024 |
| [6] |
THOMASSEN YE, VAN EIKENHORST G, VAN DER POL LA, et al. Isoelectric point determination of live polioviruses by capillary isoelectric focusing with whole column imaging detection[J]. Anal Chem, 2013, 85(12): 6089. DOI:10.1021/ac400968q |
| [7] |
BO T, PAWLISZYN J. Protein thermal stability and phospholipid protein interaction investigated by capillary isoelectric focusing with whole column imaging detection[J]. J Sep Sc, 2006, 29(7): 1018. DOI:10.1002/(ISSN)1615-9314 |
| [8] |
HE XZ, QUE AH, MO JJ. Analysis of charge heterogeneities in mAbs using imaged CE[J]. Electrophoresis, 2009, 30(5): 714. DOI:10.1002/elps.v30:5 |
| [9] |
王丽, 周勇, 王军志. 成像毛细管等电聚焦技术分析重组人促红素异质性[J]. 药物分析杂志, 2014, 34(6): 1049. WANG L, ZHOU Y, WANG JZ. Study on heterogeneity of recombinant human erythropoietin by imaged cIEF[J]. Chin J Pharm Anal, 2014, 34(6): 1049. |
| [10] |
HE Y, LACHER NA, HOU W, et al. Analysis of identity, charge variants, and disulfide isomers of monoclonal antibodies with capillary zone electrophoresis in an uncoated capillary column[J]. Anal Chem, 2010, 82(8): 3222. DOI:10.1021/ac9028856 |
| [11] |
HEMPE JM, CRAVER RD. Separation of hemoglobin variants with similar charge by capillary isoelectric focusing:Value of isoelectric point for identification of common and uncommon hemoglobin variants[J]. Electrophoresis, 2000, 21(4): 743. DOI:10.1002/(ISSN)1522-2683 |
| [12] |
JOCHHEIM C, NOVICK S, BALLAND A, et al. Separation of Enbrel (rhuTN-FR:Fc) isoforms by capillary isoelectric focusing[J]. Chromatographia, 2011, 53(S): 59. |
| [13] |
于建钊. 基于cIEF的全柱成像检测在生命分析中的应用[J]. 哈尔滨商业大学学报(自然科学版), 2012, 28(1): 54. YU JZ. Application of capillary isoelectric focusing with whole column imaging detection in bio-analytical chemistry[J]. J Harbin Univ Comm (Nat Sci Ed), 2012, 28(1): 54. |
| [14] |
MAO Q, PAWLISZYN J. Capillary isoelectric focusing with whole column imaging detection for analysis of proteins and peptides[J]. J Biochem Biophys Methods, 1999, 39(1-2): 93. DOI:10.1016/S0165-022X(99)00006-8 |
| [15] |
LUBINIECKI A, VOLKIN DB, FEDERICI M, et al. Comparability assessments of process and product changes made during development of two different monoclonal antibodies[J]. Biologicals, 2011, 39(1): 9. DOI:10.1016/j.biologicals.2010.08.004 |
| [16] |
RUSTANDI RR, PEKLANSKY B, ANDERSON CL. Application of imaged capillary isoelectric focusing technique in development of biopharmaceutical glycoprotein-based products[J]. Electrophoresis, 2012, 33: 1538. DOI:10.1002/elps.201100611 |
 2018, Vol. 38
2018, Vol. 38 
