多索茶碱(doxofylline)为甲基黄嘌呤衍生物,是一类新型抗支气管痉挛药,用于治疗支气管哮喘、喘息型慢性支气管炎及其他支气管痉挛引起的呼吸困难[1],疗效和安全性明显优于传统茶碱类药物[2-3]。多索茶碱注射液已收载于中国药典2015年版[4],USP、EP、BP均未收载。药典标准有关物质检查项下仅对单个杂质含量和杂质总量规定限度,文献对多索茶碱有关物质测定方法和限度的研究[5-9]较多,也有文献[10-12]对多索茶碱注射液中4个杂质分别有过报道,但对本品全面系统的杂质谱研究阐述未见报道。本文通过对4家企业48批次样品的杂质谱研究,发现共有5个杂质,其中2个为工艺杂质,3个为降解杂质,并采用UPLC-MS/MS技术确证杂质结构,结合强制破坏试验和工艺分析归属杂质结构,旨在为多索茶碱注射液的工艺优化和质量控制提供依据。
1 仪器与试药Agilent 1260高效液相色谱仪(美国安捷伦公司)、LCMS-8040液相色谱三重四极杆质谱联用仪(岛津企业管理(中国)有限公司)、CPA225D电子天平(赛多利斯科学仪器(北京)股份公司),Inertsil ODS-3色谱柱(十八烷基硅烷键合硅胶;规格:2.1 mm×75 mm,2 μm;日本岛津公司)。
多索茶碱对照品(批号100625-201202,纯度99.9%)、茶碱对照品(杂质2,批号100121-201104,纯度100%)均购自中国食品药品检定研究院;7-(2′,2′-二羟基)-1,3-二甲基-1H-嘌呤-2,6(3H,7H)-二酮(杂质1,批号141215,纯度:99.2%)、1-((1,3-二氧戊环-2-基)甲基)-N-甲基-4-(甲基氨基)-1H-咪唑-5-甲酰胺(简称杂质3,批号141217,纯度:99.8%)、7-(2-羟乙基)-1,3-二甲基-1H-嘌呤-2,6(3H,7H)-二酮(简称杂质4,批号141221,纯度:99.2%)均由黑龙江福和华星制药集团股份有限公司提供;1,3-二甲基-9-(1,3-二氧环戊基-2-基)甲基-3,9-二氢-1H-嘌呤-2,6-二酮(简称杂质5,批号160323,纯度:99.9%)由福安药业集团宁波天衡制药有限公司提供。48批次多索茶碱注射液样品均为省级药品质量风险考核抽验样品,分别由黑龙江福和华星制药集团股份有限公司、安徽恒星制药有限公司、福安药业集团宁波天衡制药有限公司、浙江北生药业汉生制药有限公司4家企业(简称A~D)生产,6批原料药分别由企业A和C生产。乙腈为色谱纯,水为超纯水,其余试剂均为分析纯。
2 实验方法 2.1 高效液相色谱条件色谱柱:Waters XBridge C18柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶;Waters公司);流动相:乙腈-磷酸盐缓冲液(pH 5.8)(12:88);流速:1.0 mL·min-1;柱温:25 ℃;检测波长:273 nm;进样体积:10 μL。
2.2 超高效液相色谱条件色谱柱:Inertsil ODS-3柱(2.1 mm×75 mm,2 μm);流动相:乙腈-0.1%甲酸水溶液(50 :50);流速:0.3 mL·min-1;柱温:35 ℃;检测波长:273 nm;进样体积:5μL。
2.3 质谱条件离子化模式:ESI+;扫描模式:MRM;扫描范围:m/z 50~300,离子喷雾电压:4.5 kV;雾化气流速:3.0 L·min-1;干燥气流速:15.0 L·min-1;DL温度:250 ℃;加热模块温度:400 ℃。
2.4 溶液的制备 2.4.1 供试品溶液量取供试品1 mL,加水稀释制成含多索茶碱1 mg·mL-1的溶液,即得。
2.4.2 对照溶液精密量取供试品溶液1 mL,置200 mL量瓶中,用水稀释至刻度,即得。
2.4.3 杂质对照品溶液取杂质1、2、3、4、5对照品适量,精密称定,分别加水溶解并定量制成5 μg· mL-1的杂质对照品储备液。各精密量取上述储备液适量,加水稀释制成0.5 μg·mL-1的混合溶液,摇匀,用于有关物质HPLC外标法测定。精密吸取上述储备液适量,分别加水制成100 ng·mL-1的溶液,摇匀,用于UPLC-MS/MS结构确证。
2.4.4 系统适用性试验溶液取5种杂质和多索茶碱对照品适量,精密称定,加水稀释制成约10 μg·mL-1的混合溶液,摇匀,即得。
2.5 强制降解试验选择企业A样品进行强制降解试验。精密量取供试品2 mL,置20 mL量瓶中,分别进行酸破坏(加1 mol·L-1盐酸溶液2 mL,摇匀,60 ℃水浴加热30 min,放冷,中和)、碱破坏(加0.2 mol·L-1氢氧化钠溶液2 mL,摇匀,60 ℃水浴加热30 min,放冷,中和)、氧化破坏(加30%过氧化氢溶液2 mL,振摇,室温放置1 h)、高温破坏(水浴加热1 h)、光照破坏(4 500 lx照射12 h),上述破坏后溶液分别加水定容,摇匀。
3 实验结果 3.1 系统适用性试验溶液按“2.1”项下色谱条件进样,多索茶碱和各杂质HPLC典型色谱图见图 1。按组分流出顺序分别对主成分和各杂质进行编号,多索茶碱和各杂质HPLC图见图 1,各杂质间、杂质和主成分间的分离度良好,分离度均大于1.5,5种杂质均在主成分前出峰。多索茶碱和各杂质的结构式见图 2。
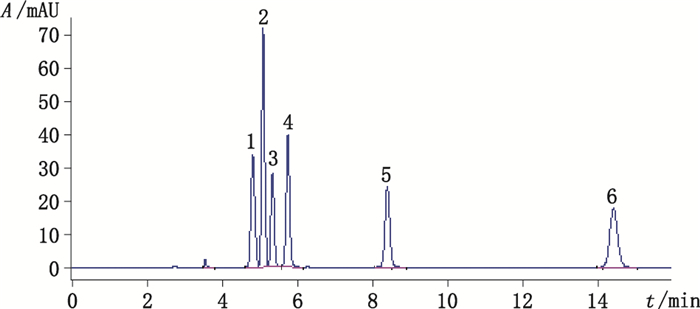
|
1.杂质1(impurity 1)2.杂质2(impurity 2)3.杂质3(impurity 3)4.杂质4(impurity 4)5.杂质5(impurity 5)6.多索茶碱(doxofylline) 图 1 杂质谱研究系统适用性试验HPLC色谱图 Figure 1 HPLC chromatogram of system suitability test |

|
图 2 多索茶碱和各杂质结构式 Figure 2 Structurs of doxofylline and impurity |
按“2.1”项下色谱条件进样,典型色谱图见图 3。试验结果表明,多索茶碱注射液对光、热稳定,杂质数量与含量基本未变,对酸、碱、氧化不稳定,均有不同程度的降解。酸破坏的主要降解产物是4.8 min处的杂质1(3.2%),碱破坏的主要降解产物是5.3 min处的杂质3(2.1%),上述2个降解产物峰与杂质对照品峰经DAD扫描,光谱图完全一致。氧化破坏显示在2.6 min处有一较大色谱峰(7.2%),在5.3 min和5.8 min处出现2个杂质峰,含量均为0.1%,同时杂质1峰消失,主成分峰面积无明显变化。经对空白溶剂进样分析,显示2.6 min处峰为溶剂峰,2个新增杂质峰保留时间分别与图 1中的杂质3和杂质4一致,通过对杂质1、3、4的结构进行分析,推测最大可能是杂质1在氧化条件下,进一步降解变成杂质3,而少量的杂质4由多索茶碱氧化降解而成。综上所述,杂质1、3、4均为降解杂质,而杂质2、5在降解产物中均未发现。
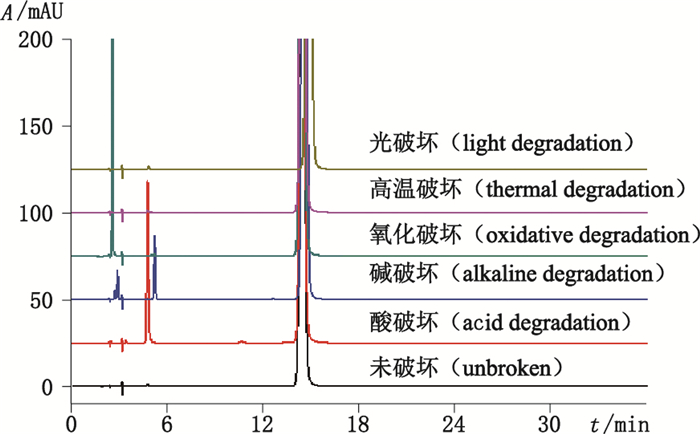
|
图 3 多索茶碱注射液强制降解试验HPLC色谱图 Figure 3 HPLC chromatography of degradation test solution |
对4个厂家48批次样品按“2.1”项下色谱条件,采用外标法测定有关物质,样品中各杂质测定结果见表 1。由表可见,48批次样品中均检出杂质1;杂质2和杂质4只在企业B部分样品中检出;杂质5在企业C样品中均有检出;所有样品中均未检出杂质3。
|
|
表 1 各厂家样品有关物质测定结果(%) Table 1 The determination resultsof related substances in samples from manufacturers |
取企业A样品适量,加水制成约含多索茶碱10 μg·mL-1的溶液,按“2.2”、“2.3”项下条件进样,得多索茶碱注射液杂质的总离子流色谱图见图 4。
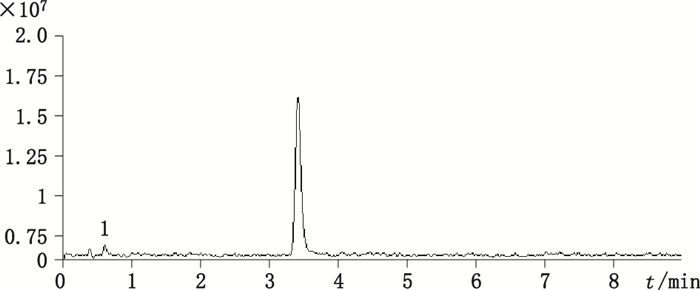
|
图 4 杂质总离子流色谱图 Figure 4 TIC of the impurity |
采用UPLC-MS/MS技术对杂质1、3、4和5进行扫描,得到杂质的一、二级质谱信息,结果见表 2。
|
|
表 2 多索茶碱及杂质UPLC-MS/MS测定数据 Table 2 UPLC-MS/MS data of doxofylline and impurities |
杂质1在48批次样品中均有检出,含量均值0.04%,其中企业A样品中含量最高,最大值接近药典规定的单个杂质限度值(0.1%),该杂质在6批原料中均未检出。杂质1为酸破坏降解产物,药典标准中多索茶碱注射液的pH范围为4.5~6.5,48批次样品pH测定结果为5.5~5.9,药液呈弱酸性,表明多索茶碱在该酸性条件下会发生不同程度的降解。考察杂质1含量与储存时间的相关性,发现同一厂家样品杂质1含量随出厂日期先后呈下降趋势,同一批次样品随着储存时间延长,杂质1含量均略有增加,表明杂质1含量与储存时间呈正相关。
4.2 杂质5杂质5只在企业C的12批样品中检出,为企业C样品中特有的杂质,通过对企业C生产的多索茶碱原料有关物质进行测定,发现3批原料中也均含有该杂质,推测杂质5为原料合成产生的副产物,对比杂质1和杂质5的一级质谱图,发现[M+H]+均出现m/z 267,二级质谱图中均出现m/z 181、m/z 124、m/z 87和m/z 69碎片离子,由此推断杂质5为多索茶碱的同分异构体。经过分析企业C的原料合成工艺,发现杂质5的产生与茶碱和侧链(溴代乙醛乙二醇缩醛)反应所使用的溶媒有关,企业C采用的溶媒是N,N-二甲基乙酰胺,而其他企业采用的溶媒是N,N-二甲基甲酰胺,表明使用N,N-二甲基乙酰胺做溶媒易引发茶碱结构中咪唑部分的三原子体系的互变异构现象。杂质5作为多索茶碱的同分异构体,很难在纯化过程除去,作为工艺杂质带入制剂中。杂质5的生理活性作用尚未见研究报道,出于安全考虑,建议企业C改进原料合成工艺,提高产品质量。
4.3 杂质3杂质3在48批次样品中均未检出,经对强制降解试验结果分析,杂质3主要为碱破坏降解产物,因多索茶碱注射液的pH控制在弱酸性,故在生产和贮存中不易产生碱降解产物。
4.4 杂质2杂质2(茶碱)作为多索茶碱合成的起始原料[13-14],已在药典中作为已知工艺杂质按外标法进行控制。国家药典委员会于2016年8月22日发布了关于多索茶碱国家标准的公示,对有关物质中茶碱的限度进行了修订,从原标准的0.2%修改为0.1%。从统计数据看各厂家对茶碱的控制情况,结果表明很有效。
4.5 杂质相对相应因子测定及控制对5种杂质的相对相应因子进行测定,结果杂质1、杂质5的相对相应因子均为1.0,杂质2为1.6,杂质3为0.7,杂质4为1.2,结合48批次多索茶碱注射液的有关物质测定结果,认为药典标准基本合理。鉴于杂质1作为最大单个杂质在该制剂中普遍存在,且含量与储存时间存在正相关,建议作为特定杂质进行控制;杂质2相对相应因子值虽远超出主成分自身对照法适用范围(0.9~1.1)[15],但其在原料中已作为特定杂质按外标法进行控制,且各企业对其控制良好,含量远低于0.1%,故制剂中杂质2(茶碱)控制未参照原料有关物质检测要求是合理的。
| [1] |
李丽, 詹丽芬, 梁再赋. 多索茶碱的药理学研究概述[J]. 世界临床药物, 2001, 2(2): 100. LI L, ZHAN LF, LIANG ZF. Overview of pharmacological study of doxofylline[J]. World Clin Drug, 2001, 2(2): 100. |
| [2] |
俞峰, 周林福. 氨茶碱和多索茶碱治疗支气管哮喘的临床疗效比较[J]. 中国生化药物杂志, 2014, 34(6): 98. YU F, ZHOU LF. Clinical observation of aminophylline and doxofylline in the treatment of bronchial asthma[J]. Chin J Biochem Pharm, 2014, 34(6): 98. |
| [3] |
郑雨霖. 多索茶碱与氨茶碱治疗支气管哮喘的临床疗效对比[J]. 海峡药学, 2016, 28(3): 166. ZHENG YL. Comparison of the clinical efficacy between doxofylline and aminophylline in the treatment of Bronchial[J]. Strait Pharm J, 2016, 28(3): 166. |
| [4] |
中国药典2015年版. 二部[S]. 2015: 383 ChP 2015.Vol Ⅱ[S].2015:383 |
| [5] |
杜加秋, 李娟, 郑国钢. 多索茶碱注射液中有关物质的HPLC法测定[J]. 中国医药工业杂志, 2014, 45(8): 773. DU JQ, LI J, ZHENG GG. Determination of related substances in doxofylline injection[J]. Chin J Pharm, 2014, 45(8): 773. |
| [6] |
李萌, 刘斐, 孙松, 等. 高效液相色谱法测定多索茶碱注射液有关物质与含量[J]. 安徽医药, 2013, 17(12): 2046. LI M, LIU F, SUN S, et al. HPLC analysis of doxofylline for injection and its related substances[J]. Anhui Med Pharm J, 2013, 17(12): 2046. DOI:10.3969/j.issn.1009-6469.2013.12.011 |
| [7] |
梁军. 多索茶碱注射液的质量控制[J]. 齐齐哈尔大学学报, 2012, 28(4): 9. LIANG J. Quality evaluation of doxofylline for injection[J]. J Qiqihar Univ, 2012, 28(4): 9. |
| [8] |
邢海燕, 刘建军, 杨永. 反相高效液相色谱法测定多索茶碱注射液的有关物质[J]. 海峡药学, 2014, 26(10): 61. XING HY, LIU JJ, YANG Y. Determination of related substances in doxofylline injection by HPLC[J]. Strait Pharm J, 2014, 26(10): 61. DOI:10.3969/j.issn.1006-3765.2014.10.026 |
| [9] |
沙吉达, 施友玲, 余丽娘. 注射用多索茶碱有关物质和含量的HPLC测定法[J]. 中国药事, 2006, 20(10): 616. SHA JD, SHI YL, YU LN. HPLC analysis of doxofylline for injection and its related substances[J]. Chin Pharm Aff, 2006, 20(10): 616. DOI:10.3969/j.issn.1002-7777.2006.10.018 |
| [10] |
李娟, 何佳佳, 朱培曦. 多索茶碱注射液有关物质的结构分析[J]. 中国药学杂志, 2014, 49(4): 334. LI J, HE JJ, ZHU PX, et al. Identification of major impurities in doxofylline injection[J]. Chin Pharm J, 2014, 49(4): 334. |
| [11] |
孙煌, 娄志红, 付璀莹, 等. 核磁共振和液相色谱-质谱法对多索茶碱未知杂质的结构分析[J]. 药物分析杂志, 2013, 33(3): 443. SUN W, LOU ZH, FU CY, et al. Structural analysis of an unknown impurity in doxofylline injection by NMR spectroscopy and liquid chromatography-mass spectrometry[J]. Chin J Pharm Anal, 2013, 33(3): 443. |
| [12] |
刘绪贵, 郝彦齐, 丁珊珊. HPLC法测定多索茶碱注射液中的工艺杂质及降解产物[J]. 药学研究, 2016, 35(11): 646. LIU XG, HAO YQ, DING SS. Determination of process impurities and degradation products in doxofylline injection by HPLC[J]. Pharm Res, 2016, 35(11): 646. |
| [13] |
李芳. 多索茶碱注射液制备工艺与质量研究[D]. 武汉: 湖北中医药大学, 2014 LI F.Studies on the Preparation and Quality Standards of Doxofylline Injection[D].Wuhan:Hubei University of Traditional Chinese Medicine, 2014 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2569695 |
| [14] |
刘红霞, 梁军. 多索茶碱的合成工艺[J]. 齐齐哈尔大学学报, 2002, 18(4): 23. LIU HX, LIANG J. Research on synthesis and technology of doxofylline[J]. J Qiqihar Univ, 2002, 18(4): 23. |
| [15] |
中国药典2010年版. 二部[S]. 2010: 附录204 ChP 2010.Vol Ⅱ[S].2010:Appendix 204 |
 2018, Vol. 38
2018, Vol. 38 