小大黄系民族地区常用药材,藏药名为曲玛孜,为蓼科植物小大黄Rheum pumilum Maxim.的干燥根和根茎,生长在海拔3 600~4 300 m的林下,稀疏灌木丛林地、林缘、湿润草滩,产于青藏高原,具有清胃肠积热,泻下的作用,藏医常用于便秘、腹水、黄水病、腹痛、瘀血等症。
藏医文献所记载的大黄种类远比中药大黄的原植物多,藏医根据大黄药材药性的强烈、温和、逊次将其分为上、中、下三品,下品即曲玛孜[1-3]。文献研究表明曲玛孜藏药品种来源应该为蓼科大黄属的一类植物,它们是塔黄、小大黄、水黄、头序大黄、白小黄等植物[4],西藏部分地区用的是塔黄,青海部分地区用的是小大黄[5]。目前对小大黄生药研究比较少,缺乏有效质量控制方法。本文在参考大黄属植物成分研究和含量测定[6-14]的基础上,研究建立了小大黄药材的显微鉴别和薄层色谱鉴别;采用高效液相色谱法测定了大黄素、大黄酚的含量,增订了其检查和浸出物项。研究所建立的定性定量方法提取方便,处理简单,可为小大黄的质量控制提供参考。
1 材料与试药LC-20A高效液相色谱仪,配有二极管阵列检测器(岛津公司);Milli-Q advantage A10超纯水仪(密理博公司)AuW220D型万分之一电子天平(岛津公司);CP225D型十万分之一电子天平(赛多利斯公司);BX51型照相显微镜(奥林巴斯公司);KQ5200B超声波清洗器(昆山市超声仪器有限公司)。硅胶G薄层板(青岛海洋化工厂)。
小大黄药材从青海海东、互助各地采集,共计6批,经青海省药品检验检测院主任药师骆桂法鉴定为小大黄Rheum pumilum Maxim.的根;对照品大黄素(批号10756-200110)、大黄酚(批号110796-201017,纯度99.6%)、大黄素甲醚(批号110758-200509,纯度95.6%)及对照药材唐古特大黄(批号120911-201110)购自中国食品药品检定研究院;甲醇为色谱纯,其余试剂为分析纯,水为超纯水。
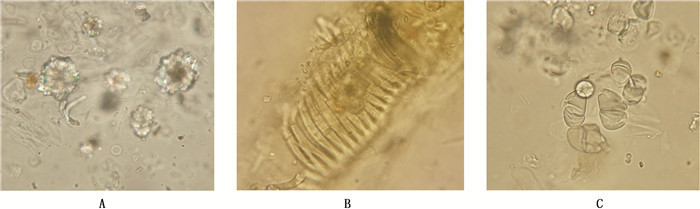
2 方法与结果 2.1 显微鉴别小大黄粉末为黄色至黄棕色。草酸钙簇晶众多,直径约17~60 μm,顶端较钝(图 1-A);导管多为网纹导管、螺纹导管(图 1-B);淀粉粒多为单粒,类球形,半圆形,类三角形,脐点点状或短缝状,不甚明显(图 1-C)。
|
A.草酸钙簇晶(clusters of calcium oxalate)B.导管(vessels)C.淀粉粒(starch granules) 图 1 小大黄粉末药材的显微鉴别图(×200) Figure 1 Microscopic characteristics of powdered Rheum pumilum roots |
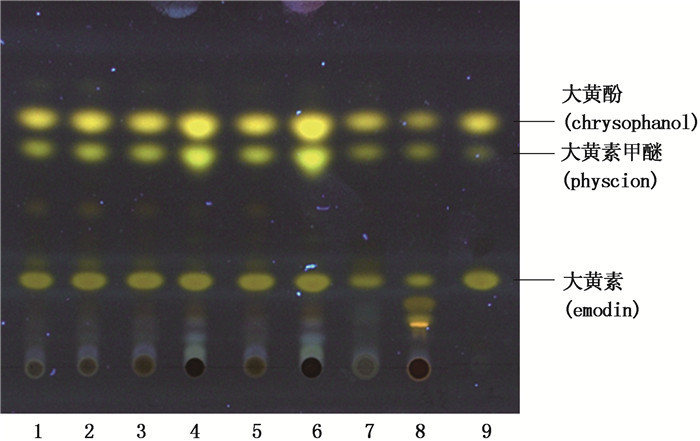
分别取小大黄、唐古特大黄药材粉末约0.2 g,加甲醇20 mL,浸泡h,滤过,取滤液5 mL,蒸干,残渣加水10 mL使溶解,再加36%盐酸1 mL,加热回流30 min,立即冷却,用乙醚分2次振摇提取,每次20 mL,合并乙醚液,蒸干,残渣加三氯甲烷1 mL使溶解,作为供试品溶液。另取小大黄对照药材,同法制成对照药材溶液。再分别取大黄素、大黄素甲醚、大黄酚的对照品,加甲醇制成每1 mL含1 mg的混合溶液,作为对照品溶液。吸取上述溶液各3 μL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以石油醚(30~60℃)-甲酸乙酯-甲酸(15:5:1)的上层溶液为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。供试品色谱中,小大黄样品在与小大黄对照药材色谱相应的位置上,显相同的3个橙黄色荧光主斑点;在与对照品色谱相应的位置上,显相同的橙黄色荧光斑点。而唐古特大黄药材在该薄层色谱中显5个橙黄色荧光斑点,TLC图见图 2。
|
1.小大黄对照药材(Rheum pumilum roots reference drug)2~7.小大黄样品(samples)8.唐古特大黄(Rheum tanguticum Maxim. ex Balf.)9.大黄素、大黄素甲醚、大黄酚混合对照品(mixed reference substances of emodin,physcion and chrysophanol) 图 2 小大黄薄层色谱图 Figure 2 TLC chromatogram of Rheum pumilum roots |
为全面控制小大黄药材质量,依据中国药典2015年版四部各项测定法对其水分、总灰分、酸不溶性灰分、浸出物检查项进行了考察,结果见表 1;并根据6批样品的测定结果制定了限度。暂定水分不得过12.0%,总灰分不得过15.0%,酸不溶性灰分不得过2.0%。醇溶性浸出物(95%乙醇作溶剂)不得少于13.0%。
|
|
表 1 样品中水分、灰分、浸出物测定结果(%) Table 1 Contents of water, ash and extraction |
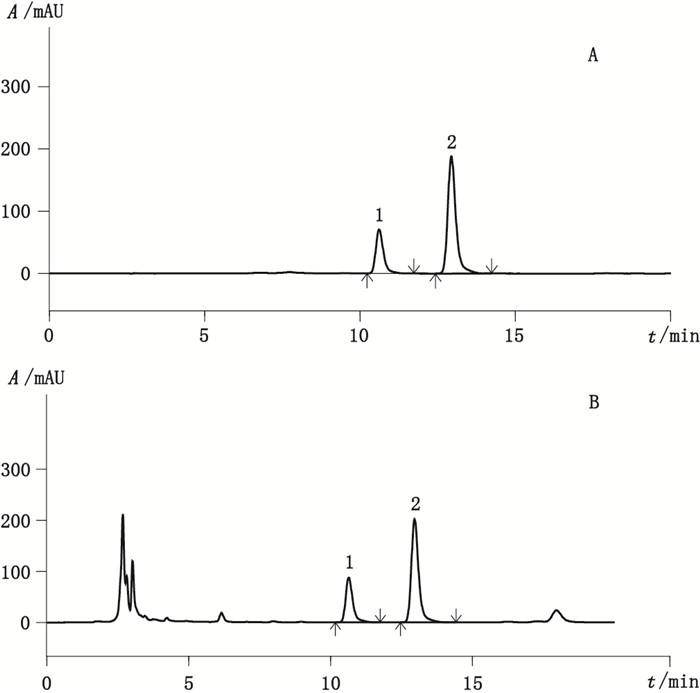
色谱柱:SunFire-C18色谱柱(十八烷基硅烷键合硅胶,250 mm×4.6 mm,5 μm);流动相:甲醇-0.1%磷酸水溶液(85:15);流速:1.0 mL·min-1;检测波长:254 nm;柱温:25 ℃。理论板数按大黄素峰计算不低于3 000。色谱图见图 3。
|
1.大黄素对照品(emodin)2.大黄酚对照品(chrysophanol) 图 3 对照品(A)及样品(B)的HPLC色谱图 Figure 3 HPLC chromatograms of reference substances (A)and sample(B) |
精密称取大黄素对照品适量,置50 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,得质量浓度为0.144 0 mg·mL-1的大黄素储备液;精密称取大黄酚对照品适量,置50 mL量瓶中,加甲醇溶解,稀释至刻度,摇匀,得质量浓度为0.154 8 mg·mL-1的大黄酚储备液。精密量取上述大黄素储备液5.0 mL及大黄酚储备液10.0 mL,置同一25 mL量瓶中,加甲醇至刻度,摇匀,即得混合对照品溶液(大黄素质量浓度为0.028 8 mg·mL-1,大黄酚质量浓度为0.061 9 mg·mL-1)。
2.4.3 供试品溶液的制备取小大黄粉末(过2号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称量,超声处理(功率200 W,频率40 kHz)30 min,放冷,再称量,用甲醇补足减失的量,摇匀,滤过,精密量取续滤液25 mL,加36%盐酸3 mL,摇匀,置水浴上加热回流1 h,放冷,转移至50 mL量瓶中,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
2.4.4 线性关系考察精密吸取混合对照品溶液2、4、8、12、16、20 µL,分别在“2.4.1”项色谱条件下测定,以峰面积积分值Y对对照品进样量X(μg)进行线性回归,大黄素和大黄酚回归方程:
Y=4.104 9×106X-4.082×103 r=1.000 0
Y=5.392 7×106X-4.894×103 r=1.000 0
结果表明:大黄素和大黄酚进样量分别在0.058~0.576 µg、0.124~1.238 µg的范围内,与相应峰面积线性关系良好。
2.4.5 精密度试验精密吸取“2.4.1”项下混合对照品溶液10 µL,连续进样6次,结果大黄素和大黄酚峰面积的RSD均为0.1%,表明仪器精密度良好。
2.4.6 稳定性试验精密吸取同一份供试品溶液10 µL,于0、2、4、8、10、12 h分别进样分析,结果大黄素和大黄酚峰面积的RSD分别为0.8%、0.2%,表明供试品溶液中大黄素、大黄酚在12 h内稳定性良好。
2.4.7 重复性试验取同一批次样品6份,分别按“2.4.3”项下方法制成供试品溶液,进样分析。结果大黄素和大黄酚含量的平均值分别为7.02、13.01 mg·g-1,RSD分别为0.6%、1.6%,表明方法重复性良好。
2.4.8 加样回收率试验取已知含量(大黄素含量为3.19 mg·g-1,大黄酚含量6.43 mg·g-1)的小大黄样品粉末6份,每份约0.25 g,精密称定。精密加入混合对照品的甲醇溶液(大黄素和大黄酚质量浓度分别为0.017 42、0.330 6 mg·mL-1)50 mL,按“2.4.3”项下方法制备供试溶液,进样10 µL进行测定,结果大黄素和大黄酚的平均回收率分别为102.8%、102.6%,RSD分别为0.9%、2.0%,表明回收率良好。
2.4.9 样品含量测定取6批小大黄样品(每批取2份),按“2.4.3”项方法制成供试品溶液,进样10 µL进行测定,用外标法计算样品中大黄素和大黄酚的含量。测定结果见表 2。
|
|
表 2 不同来源样品中2个指标成分的含量测定结果(mg·g-1,n=2) Table 2 Determination results of 2 components in Rheum pumilum root samples from different sources |
根据大黄素和大黄酚的紫外光谱图,大黄素在在(252±2 nm)波长处有最大吸收峰,大黄酚在(256±2)nm波长处有最大吸收峰,因此综合考虑选择254 nm为检测波长。
3.2 含量测定提取方法的考察试验中考察了中国药典2015年版一部中大黄药材项下含量测定方法和文中“2.4.3”项先超声后酸水解2种方法,经比较发现,先超声后酸水解的提取效果更好,方法更简便。
3.3 含量测定提取溶剂用量和时间的考察试验中比较了加入36%盐酸2、3、4 mL的提取率。结果表明,加入36%盐酸3 mL和4 mL的结果一致,故选择3 mL为36%盐酸加入量。考察加热回流时间60 min和90 min,结果60 min和90 min的结果一致,故选择60 min为提取时间。
3.4 结果分析由于本次研究仅收集到青海地区常用的小大黄药材6批,故未对同属其他植物进行试验研究。通过查阅相关文献可知,大黄(掌叶大黄、唐古特大黄、药用大黄)的草酸钙簇晶直径为20~160 µm,有的至190 µm;亚大黄(穗序大黄、疏枝大黄)的草酸钙簇晶直径为20~130 µm[15];而本次研究中6批小大黄药材的草酸钙簇晶直径为17~60 µm。小大黄与其他两类大黄的草酸钙簇晶直径差异明显,故草酸钙簇晶的大小可作为小大黄与同属其他植物的一个区别点。另TLC色谱图中,大黄对照药材(唐古特大黄)有5个橙黄色荧光主斑点,小大黄仅有3个,薄层色谱图差异明显。本文中又将小大黄标准药材和大黄素、大黄素甲醚、大黄酚混合对照品为对照进行薄层色谱鉴别,增强其专属性。因此,通过本文建立的显微鉴别和薄层色谱鉴别方法配合性状观察,可以有效地将小大黄与同属其他植物进行区分。
检查项测定结果表明,总灰分结果偏高,6批次样品的总灰分平均值为17.4%。作为总灰分的限量检查,主要是防止人为掺入加重物质,保证药用的安全性和有效性。故本文又对小大黄的酸不溶性灰分进行了测定,发现其酸不溶性灰分较低,平均值约为0.8%。说明小大黄的总灰分主要是生理灰分。
因小大黄药材中大黄素和大黄酚含量较高,故选取二者作为含量测定指标。经测定,6批小大黄药材中大黄酚的含量约为大黄素的2倍,而大黄素和大黄酚的总量差异很大,最高的为22.11 mg·g-1,最少的为10.24 mg·g-1,差异显著的原因可能是小大黄生长环境的不同造成的。因此,综合考虑暂定其限度为:本品按干燥品计算,含大黄素和大黄酚的总量不得少于8.0 mg·g-1。
| [1] |
青海省药品检验所. 中国藏药[M]. 第一卷. 上海: 上海科学技术出版社, 1996, 139. Qinghai Institute for Drug Control. Chinese Tibetan Medicine[M]. Shanghai: Shanghai Scientific and Technical Publishers, 1996, 139. |
| [2] |
卫生部药品标准藏药. 第一册[S]. 1995: 340 Drug Specification Promulgated by the Ministry of Public Health, Tibetan Medicine. Vol Ⅰ[S]. 1995: 340 |
| [3] |
罗达尚. 中华藏本草[M]. 北京: 民族出版社, 1997, 50. LUO DS. Chinese Tibetanmateria Medica[M]. Beijing: Ethnic Publishing House, 1997, 50. |
| [4] |
罗武政, 李啟恩, 陈静, 等. 藏药曲玛孜的文献查考[J]. 中国中药杂志, 2015, 40(10): 2047. LUO WZ, LI QE, CHEN J, et al. Textual research for Tibetan medicine Qumazi[J]. China J Chin Mater Med, 2015, 40(10): 2047. |
| [5] |
杨永昌. 藏药志[M]. 西宁: 青海人民出版社, 1991, 85. YANG YC. Tibetan Medicine[M]. Xining: Qinghai People's Publishing House, 1991, 85. |
| [6] |
中国药典2015年版. 一部[S]. 2015: 23 ChP 2015. Vol Ⅰ[S]. 2015: 23 |
| [7] |
张文根, 杨赛钢, 李波, 等. 中国蓼科植物化学成分研究进展[J]. 现代生物医学进展, 2008, 8(2): 393. ZHANG WG, YANG SG, LI B, et al. Advance on chemical ingredients of Polygonaceae in China[J]. Prog Mod Biomed, 2008, 8(2): 393. |
| [8] |
耿家玲, 沈勇, 康绍建. HPLC法测定栽培亚大黄中3种成分的含量[J]. 中国药师, 2011, 14(5): 666. GENG JL, SHEN Y, KANG SJ. Determination of three compositions in cultivated Rheum ihasaense by HPLC[J]. China Pharm, 2011, 14(5): 666. |
| [9] |
施天一, 廖志新, 叶润, 等. 塔黄的化学成分研究[J]. 西北药学杂志, 2014, 29(6): 571. SHI TY, LIAO ZX, YE R, et al. Study on chemical constituents of Rheum nobile Hook.f.et Thoms[J]. Northwest Pharml J, 2014, 29(6): 571. |
| [10] |
杨凤梅. 青鹏膏剂中多组药效成分的含量测定[J]. 中华中医药杂志, 2011, 26(7): 1633. YANG FM. Determination of active components in Qingpeng Unguentum by HPLC[J]. China J Tradit Chin Med Pharm, 2011, 26(7): 1633. |
| [11] |
高晓燕, 卢建秋. HPLC-DAD法同时测定大黄中7个蒽醌类化合物的含量[J]. 药物分析杂志, 2010, 30(9): 1636. GAO XY, LU JQ. HPLC-DAD simultaneous determination of 7 anthraquinone derivatives in rhubarb[J]. Chin J Pharm Anal, 2010, 30(9): 1636. |
| [12] |
杨月娥, 胡文帅, 庞婕, 等. 道地产区大黄中5种蒽醌类化合物含量测定[J]. 安徽农业科学, 2011, 39(11): 6378. YANG YE, HU WS, PANG J, et al. Determination of five anthraquinones in Radix et Rhizoma Rhei from its genuine producing areas[J]. J Anhui Agric Sci, 2011, 39(11): 6378. DOI:10.3969/j.issn.0517-6611.2011.11.030 |
| [13] |
韩桂茹, 赵志军, 许红辉, 等. 多种药材与制剂中大黄酚与大黄素含量测定改进方法[J]. 药物分析杂志, 2008, 28(3): 461. HAN GR, ZHAO ZJ, XU HH, et al. Improved determination method of chrysophanol and emodin in several herbals and preparations[J]. Chin J Pharm Anal, 2008, 28(3): 461. |
| [14] |
王哲, 许利嘉, 何春年, 等. HPLC测定不同来源大黄中蒽醌和二蒽酮类成分[J]. 中草药, 2011, 42(6): 1114. WANG Z, XU LJ, HE CN, et al. Determination of anthraquinones and bianthrones in rhubarb from different sources by HPLC[J]. Chin Tradit Herb Drugs, 2011, 42(6): 1114. |
| [15] |
四川省藏药材标准[S]. 2014: 75 Standard of Tibetan Medicinal Materials of Sichuan Province[S]. 2014: 75 |
 2018, Vol. 38
2018, Vol. 38 