2. 中药品质评价北京市重点实验室, 北京 100102
2. Beijing Key Laboratory for Quality Evaluation of Traditional Chinese Medicine, Beijing 100102, China
中药鸡骨草为豆科植物广州相思子Abrus cantoniensis Hance的干燥全株,其性凉,味甘、微苦,归肝、胃经,有利湿退黄,清热解毒,疏肝止痛的功效[1]。鸡骨草最早出自《岭南采药录》,1977年被收入中国药典,在我国主要分布在广东、广西等地,并为两广的道地药材[2]。现代药理研究表明,鸡骨草具有保肝护肝、抗氧化、抗炎、抗菌、抗病毒、免疫调节、降脂等药理作用[3-9],临床应用广泛。
鸡骨草所含化学成分复杂,其中黄酮、生物碱、三萜等类物质是鸡骨草的主要有效活性成分[10]。2015年版中国药典中,鸡骨草的鉴别是以相思子碱为指标的薄层色谱鉴别,并没有含量测定项,目前已有研究对其中生物碱类或黄酮类的个别成分进行含量测定[11-13],希望以此进行质量控制,但中药成分复杂,仅以几个化合物的含量作为质量的评价指标是不全面的。中药指纹图谱是一种综合的、可量化的色谱鉴定手段,该技术已被广泛用于中药的质量控制领域,因其可较全面地反映中药材及植物药产品的药效学物质特征,评价其稳定性及一致性而受到国际的认可[14-15]。故本实验建立鸡骨草的UPLC指纹图谱,并用相似度分析、聚类分析和主成分分析3种方法对不同产地鸡骨草药材的质量进行评价。
1 仪器与试药 1.1 仪器Waters Acquity UPLC H-Class超高效液相色谱仪,Waters Empower 3色谱工作站,含四元梯度泵、自动进样器、紫外检测器(Waters公司);Waters ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm;填料:高强度硅胶键合十八烷基硅烷;Waters公司);MS105DU分析天平(Mettler Toledo公司);DK-98-1型电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.2 试药对照品相思子碱(批号PS160511-01)、下箴刺桐碱(批号PS13101403)、新西兰牡荆苷2(批号PS13071901)、夏佛塔苷(批号PS13031802)、原儿茶酸(批号PS09160025)、木犀草素(批号PS10320025)、大黄酚(批号12031501)购自成都普思生物科技有限公司,供含量测定用;乙腈、甲醇均为色谱纯(Fisher公司),甲酸为色谱纯(北京化工厂),水为屈臣氏纯净水。16批不同产地的鸡骨草信息见表 1,由广西药用植物园提供,并由北京中医药大学中药学院杨遥君副教授鉴定为广州相思子Abrus cantoniensis Hance的干燥全株。
|
|
表 1 16批鸡骨草信息 Table 1 Sample information |
采用Waters ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),ACQUITY UPLC柱在线过滤器,以乙腈(A)-0.1%甲酸水溶液(B)为流动相,梯度洗脱,洗脱程序见表 2,流速0.3 mL·min-1,检测波长254 nm,柱温35 ℃,进样量2 μL,理论塔板数均大于10 000。
|
|
表 2 梯度洗脱程序 Table 2 Gradient elution program |
鸡骨草干燥全草粉碎过40目筛,取约1 g,精密称定,置索氏提取器内,加甲醇100 mL,水浴80 ℃加热2 h,提取液回收甲醇并浓缩至干,用80%的甲醇水溶解并转移至10 mL量瓶中,加80%的甲醇水定容至刻度,摇匀,过0.22 μm滤膜,取续滤液,即得。
2.3 混合对照品溶液的制备精密称取相思子碱、下箴刺桐碱、新西兰牡荆苷2、夏佛塔苷、原儿茶素、木犀草素、大黄酚的对照品适量,用70%甲醇水超声溶解并定容,制得相思子碱、下箴刺桐碱、新西兰牡荆苷2、夏佛塔苷、原儿茶素、木犀草素、大黄酚质量浓度分别为102.0、68.80、54.0、109.2、70.5、98.4、108.0 μg·mL-1的对照品储备液;分别取各对照品储备溶液5 mL至20 mL量瓶中,加甲醇稀释至刻度,摇匀,即得混合对照品溶液。
2.4 方法学考察 2.4.1 精密度试验取鸡骨草药材,按供试品溶液制备方法制备溶液,依法连续进样6次,测得各共有峰相对保留时间及相对峰面积的RSD均<2%,采用国家药典委员会“中药色谱指纹图谱相似度评价系统(2012.1版本)”软件进行相似度评价,相似度均 > 0.996。表明仪器精密度良好。
2.4.2 稳定性试验取S7号样品制备供试品溶液1份,在“2.1”项色谱条件下进样分析,48 h内每间隔6 h测定1次,记录峰面积,考察色谱峰相似度的一致性,结果各共有峰相对保留时间及相对峰面积RSD均<1%,采用国家药典委员会“中药色谱指纹图谱相似度评价系统(2012.1版本)”软件进行相似度评价,相似度均 > 0.997,表明48 h内供试品溶液的成分是稳定的。
2.4.3 重复性试验取S7号样品制备供试品溶液6份,在“2.1”项色谱条件下进样分析,采用国家药典委员会“中药色谱指纹图谱相似度评价系统(2012.1版本)”软件进行相似度评价,相似度均 > 0.995。结果各共有峰相对保留时间及相对峰面积的RSD均 < 2%,表明重复性良好。
2.5 鸡骨草药材测定指纹图谱的建立取16批鸡骨草药材按“2.2”项下方法制备供试品溶液,在“2.1”项色谱条件下检测,记录色谱图。将所有数据导入国家药典委员会“中药色谱指纹图谱相似度评价系统(2012.1版本)”软件进行处理。S7号样品色谱图中色谱峰峰形、分离度良好,基线平整,故选择其为参照指纹图谱。为减小极端数据的影响,选择中位数法作为对照指纹图谱的生成方法,时间窗宽度设为0.1,运用手动多点校正方法对色谱峰进行全谱峰匹配,见图 1,并生成对照指纹图谱。从16批鸡骨草药材的指纹图谱中共得到52个共有峰,见图 2。通过与对照品色谱图中的保留时间比对,初步可指认7个共有峰。
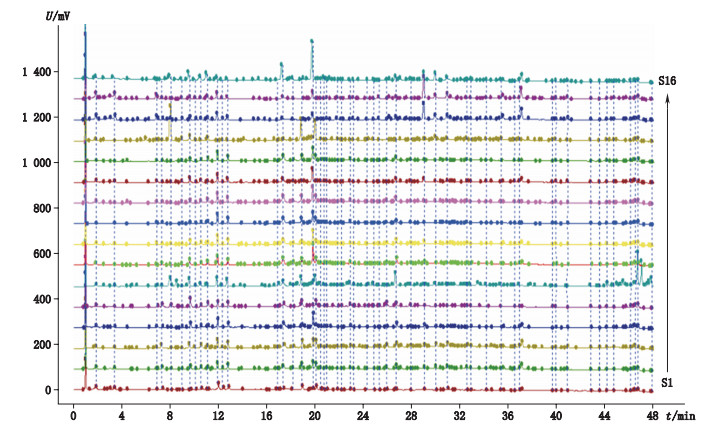
|
图 1 16批鸡骨草药材色谱峰匹配图 Figure 1 Match chromatogram of 16 samples |
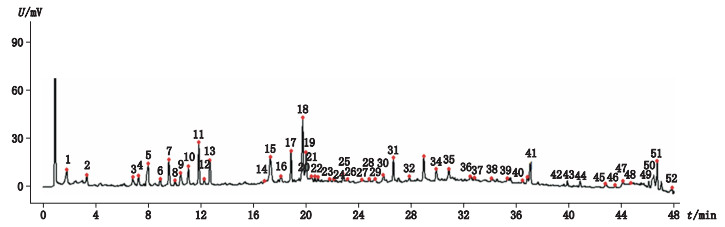
|
3.原儿茶酸(protocatechuic acid) 7.相思子碱(abrine) 10.下箴刺桐碱(hypaphorine) 15.新西兰牡荆苷2(vicenin 2) 18.夏佛塔苷(schaftoside) 35.木犀草素(luteolin) 49.大黄酚(chrysophanol) 图 2 鸡骨草药材的共有模式图谱 Figure 2 Common pattern of 16 samples |
在上述数据处理的基础上,利用国家药典委员会“中药色谱指纹图谱相似度评价系统(2012.1版本)”软件对16批不同产地的鸡骨草药材进行相似度评价,结果见表 3。
|
|
表 3 鸡骨草指纹图谱相似度评价 Table 3 Similarity of fingerprints of Abri Herba |
16批次鸡骨草药材图谱与对照指纹图谱的相似度范围为0.625~0.984,说明鸡骨草药材的质量存在一定差异。除了S6号样品(广西上思)和S13号样品(广西钦州)图谱与对照图谱的相似度小于0.80以外,其他各批次药材图谱与对照图谱的相似度均大于0.85,可见大部分药材质量比较接近;其中广西玉林的3个批次样品相似度较接近,质量稳定;而广西钦州的5个批次样品相似度有差异,质量各异;广东的2批栽培样品的相似度均小于0.9,明显低于大部分广西的栽培品。
2.6.2 聚类分析选择鸡骨草指纹图谱中52个共有峰,将其峰面积相对于称样量量化,将16份样品UPLC图谱中52个共有峰的峰面积值标准化,组成16×52阶原始数据矩阵,运用SPSS 20.0数据统计软件,选用平均组间连接聚类方法,利用平均欧式距离法作为样品间距离计算方法进行系统聚类分析,聚类结果见图 3。
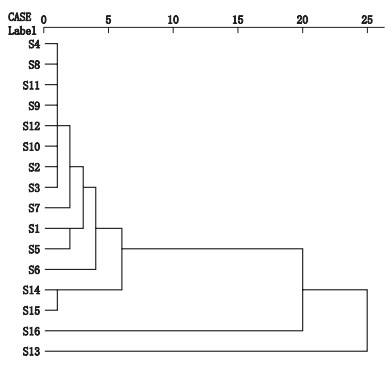
|
图 3 聚类分析结果 Figure 3 Results of hierarchical cluster analysis |
当判别距离为15和10时,16批鸡骨草药材被分为3类,S1~S12及S14、S15号样品为一类,S13号样品为一类,S16号样品为一类,即广东肇庆和广西钦州样品各为一类,其他产地样品分为一类;当判别距离为5时,S1~S12号样品为一类,即大部分广西产鸡骨草样品和越南产鸡骨草样品被聚为一类;S14、S15号样品为一类,2批广东的样品被聚为一类;S13和S16号样品即广东肇庆和广西钦州样品各聚为一类。总体看来,广西和广东的药材质量还是有差异的,可以各分一类。广西的药材质量大体相近,仅钦州的1个批次样品差别较大,表明即使是同一产地所产鸡骨草药材,质量也不尽相同,与相似度分析的评价结果相一致。
2.6.3 主成分分析用SPSS 20.0软件对量化的各共有峰峰面积进行标准化处理后,对16批鸡骨草药材指纹图谱所得的52个共有峰进行主成分分析,求出相关矩阵的特征值及其方差,见表 4。共提取出8个主成分,前3个因子的累积方差贡献率达到66.5%,前5个因子的累计方差贡献率达到85.6%,由于变量诸多,因此第1、2、3个因子分别作为主成分1、2和3,可代表鸡骨草指纹图谱共有峰的大部分信息。
|
|
表 4 主成分特征值及方差 Table 4 Eigen value and total variance of principal components |
主成分载荷矩阵反映了各变量对主成分的贡献大小和作用方向。由于变量诸多,因此用52个共有峰3个主成分的排序坐标图来表示;由图 4可见,52个变量对主成分1多成正相关,其中共有峰22、34、38、40对其的贡献最大;共有峰3、15、25和49对主成分2贡献最大,其中共有峰3与主成分3呈负相关;共有峰5、11、14、17、19、28对主成分3的贡献最大,且共有峰11与主成分3呈负相关。
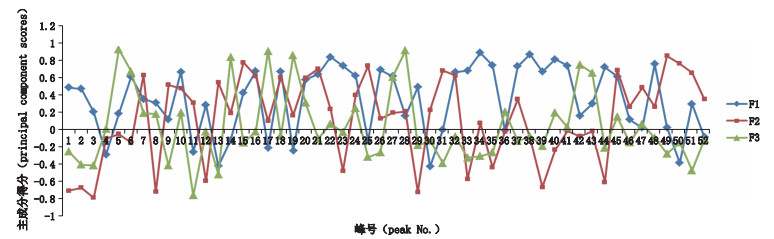
|
图 4 52个共有峰3个主成分的排序坐标图 Figure 4 Coordinate diagram of three principal components in 52 common peaks |
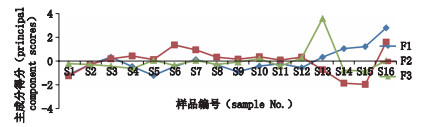
进一步通过将各特征向量中心化和标准化后,16份样品主成分得分如图 5所示,并以样品的第1、2、3主成分得分做三维散点图,见图 6。第1主成分得分最高的为S16号样品,第2主成分得分最高的为S6、S16号样品,第3主成分得分最高为S13号样品。因此,通过以上分析结果可以得出2个产地的S6、S16号样品在第1、第2主成分中得分较高,而这2份样品均为野生的新采收药材,这就说明虽然不同产地鸡骨草的化学成分相似度较高,但从综合药用质量评价,还是野生的鸡骨草药材品质最佳。图 6中S1~S12号样品聚为一类,S14和S15号样品为一类,S13和S16号样品各为一类,这与相似度分析结果完全一致,而S6号样品在一类中比较靠边缘的地方,也与主成分分析的结果较一致。
|
图 5 16批鸡骨草药材3个主成分的排序坐标图 Figure 5 Coordinate diagram of three principal components in 16 samples |

|
图 6 主成分得分图 Figure 6 PCA score figure |
本实验对不同提取溶剂(纯甲醇、80%甲醇、50%甲醇)及不同提取方法(热回流提取、索氏提取、超声提取)进行考察,以色谱峰的信息最大化,提取效率最高,提取方法稳定可行为指标,最终选择纯甲醇为鸡骨草的提取溶剂,索氏提取法为实验提取方法。
本实验对色谱条件中的色谱柱、流动相体系和检测波长进行考察。考察了Waters的ACQUITY UPLC HSS T3 C18 (2.1 mm×100 mm,1.8 μm)和ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)以及Agilent UPLC SB C18 (2.1 mm×100 mm,1.8 μm) 3款色谱柱,经比较发现,在相同色谱条件下,采用ACQUITY UPLC HSS T3柱能够得到最多的色谱峰,并且大部分达到基线分离,峰形更好,柱效更高。考察了甲醇-水、乙腈-水、乙腈-0.1%甲酸水和乙腈-0.2%甲酸水4种流动相体系,发现以甲醇-水为流动相,分离效果较差,改善色谱条件效果也不明显;以乙腈-水为流动相,分离效果较好,但峰形有拖尾,换用乙腈-0.1%甲酸水为流动相,峰形拖尾大有改善,换用0.2%甲酸水后峰形与0.1%甲酸水的峰形没有区别,因此以乙腈-0.1%甲酸水为流动相效果最佳。采用PDA检测器进行全波长扫描,比较各波长下指纹图谱的峰数、基线及响应值,最终选择254 nm为检测波长,此条件下,鸡骨草指纹图谱的峰数较多,响应均较高,且基线较平稳。
本实验依次运用相似度分析、聚类分析和主成分分析3种方法对不同产地的鸡骨草药材UPLC指纹图谱进行分析。16批次鸡骨草药材中有14批的指纹图谱相似度在0.85以上,只有2批药材的相似度小于0.80,说明不同产地的鸡骨草药材质量比较一致。从16批鸡骨草药材的指纹图谱中得到了52个共有色谱峰,共有峰个数较多,在已知的7个共有峰中包括了2个生物碱类成分、3个黄酮类成分、1个有机酸类成分和1个蒽醌类成分,说明通过本方法可较全面地反映鸡骨草药材的质量。从聚类分析结果可知,广东肇庆的S16号样品为野生药材单独聚为一类,S14、S15号2批广东栽培样品聚为一类,与广西的样品均不为一类,可见广西和广东药材质量还是有区别的;而S13号广西钦州样品单独聚为一类,可见即便是同一产地,也有个别批次药材质量有较大差异;16批样品中的4批野生药材,质量各异,只有广东肇庆的药材与栽培品有明显区别,2批越南的野生鸡骨草放置时间较长,可能影响了其质量。利用主成分分析将鸡骨草药材指纹图谱中的52个特征变量降维至8个主成分,选择前3个主成分来代表鸡骨草指纹图谱共有峰的大部分信息,由16份样品主成分得分图可知,S6和S16号2批样品为野生药材,质量较好,与栽培品有明显差别;三维散点图所得到的结果与聚类分析及相似度分析结果一致。本研究运用3种分析方法较全面地评价了不同产地鸡骨草的质量,为鸡骨草的质量控制研究奠定基础。此外,该指纹图谱中共有色谱峰众多,指认出的峰较少,对色谱峰的定性,还需要借助液质联用进行进一步确认和完善。
| [1] |
中国药典2015年版. 一部[S]. 2015: 194 ChP 2015.Vol Ⅰ[S].2015:194 |
| [2] |
白隆华, 董青松, 蒲瑞翎. 中药鸡骨草研究概况[J]. 广西农业科学, 2005, 36(5): 476. BAI LH, DONG QS, PU RL. Study on Chinese medicine Abrus cantoniensis[J]. Guangxi Agric Sci, 2005, 36(5): 476. |
| [3] |
LI H, SONG ZJ, DAI YP, et al. Antioxidative activity of flavonoids from Abrus cantoniensis against ethanol-induced gastric ulcer in mice[J]. Planta Med, 2015, 81(10): 784. DOI:10.1055/s-00000058 |
| [4] |
MIYAO H, ARAO T, UDAYAMA M, et al. Kaikasaponin Ⅲ and soyasaponin Ⅰ, major triterpene saponins of Abrus cantoniensis, act on GOT and GPT:influence on transaminase elevation of rat liver cells concomitantly exposed to CCl4 for one hour[J]. Planta Med, 1998, 64(1): 5. DOI:10.1055/s-2006-957355 |
| [5] |
王晓波, 黄叠玲, 刘冬英, 等. 鸡骨草总黄酮清除自由基及抑制亚硝化作用研究[J]. 时珍国医国药, 2012, 23(4): 942. WANG XB, HUANG DL, LIU DY, et al. Free radicals scavenging and nitrosation inhibition activities of total flavonoids from Abrus cantoniensis[J]. Lishizhen Med Mater Med Res, 2012, 23(4): 942. |
| [6] |
王昀, 陈蜜, 江振洲, 等. 鸡骨草总黄酮碳苷对乙硫氨酸导致的小鼠脂肪肝的影响[J]. 中国临床药理学与治疗学, 2014, 19(1): 1. WANG Y, CHEN M, JIANG ZZ, et al. Effects of total flavone C-glycosides of Abrus cantoniensis on ethionine-induced fatty liver in mice[J]. Chin J Clin Pharmacol Ther, 2014, 19(1): 1. |
| [7] |
江生周, 江辉. 鸡骨草总黄酮对小鼠实验性肝损伤的保护作用[J]. 安徽医药, 2009, 13(10): 1174. JIANG SZ, JIANG H. Protective effects of total flavones of Abrus cantoniensis Hance (TFA) on acute hepatic injury by carbon tetrachloride[J]. Anhui Med Pharm J, 2009, 13(10): 1174. DOI:10.3969/j.issn.1009-6469.2009.10.007 |
| [8] |
张丽丹, 罗建华, 蒙春越, 等. 鸡骨草总黄酮提取及对羟自由基清除作用[J]. 微量元素与健康研究, 2007, 24(2): 44. ZHANG LD, LUO JH, MENG CY, et al. Extraction of total flavonoids from Abrus cantoniensis and its scavenging effect on hydroxyl radical[J]. Stud Trace Elem Health, 2007, 24(2): 44. |
| [9] |
LI H, SONG ZJ, DAI YP, et al. Antioxidative activity of flavonoids from Abrus cantoniensis against ethanol-induced gastric ulcer in mice[J]. Planta Med, 2015, 81(10): 784. DOI:10.1055/s-00000058 |
| [10] |
程瑛琨, 陈勇, 王璐, 等. 正交设计优选鸡骨草总黄酮和总生物碱的提取工艺[J]. 西北药学杂志, 2007, 22(2): 61. CHENG YK, CHEN Y, WANG L, et al. Orthogonal design optimization of extraction process of total flavonoids and total alkaloids from Abrus cantoniensis[J]. Northwest Pharm J, 2007, 22(2): 61. |
| [11] |
袁旭江, 李春阳, 张平. 一测多评法测定鸡骨草叶中3种黄酮碳苷含量[J]. 中药新药与临床药理, 2014, 25(4): 493. YUAN XJ, LI CY, ZHANG P. Simultaneous determination of three flavones C-glycosides in leaves of Herba Abri by quantitative analysis of multi-components by single marker[J]. Tradit Chin Drug Res Clin Pharmacol, 2014, 25(4): 493. |
| [12] |
史海明, 黄志勤, 温晶, 等. HPLC法测定鸡骨草药材中相思子碱的含量[J]. 药物分析杂志, 2007, 27(11): 1716. SHI HM, HUANG ZQ, WEN J, et al. HPLC determination of abrine in Abrus cantoniensis Hance[J]. Chin J Pharm Anal, 2007, 27(11): 1716. |
| [13] |
黄平, 莫虎, 马雯芳, 等. RP-HPLC法同时测定鸡骨草药材中的相思子碱和下箴刺桐碱[J]. 药物分析杂志, 2009, 29(10): 1702. HUANG P, MO H, MA WF, et al. RP-HPLC simultaneous determination of abrine and hypaphorine in Abrus cantoniensis[J]. Chin J Pharm Anal, 2009, 29(10): 1702. |
| [14] |
刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker):中药产品质量控制的新概念[J]. 中草药, 2016, 47(9): 1443. LIU CX, CHEN SL, XIAO XH, et al. A new concept of quality marker of Chinese material medica:quality control for Chinese medicinal products[J]. Chin Tradit Herb Drugs, 2016, 47(9): 1443. DOI:10.7501/j.issn.0253-2670.2016.09.001 |
| [15] |
李强, 杜思邈, 张忠亮, 等. 中药指纹图谱技术进展及未来发展方向展望[J]. 中草药, 2013, 44(22): 3095. LI Q, DU SM, ZHANG LZ, et al. Progress in fingerprint technology on Chinese materia medica and prospect of its future development[J]. Chin Tradit Herb Drugs, 2013, 44(22): 3095. |
 2018, Vol. 38
2018, Vol. 38 
