2. 中国人民解放军陆军炮兵防空兵学院, 合肥 230031
2. PLA Artillery Air Defense Academy, PLA, Hefei 230031, China
复方阿达帕林盐酸克林霉素凝胶(复方凝胶)主要由阿达帕林、盐酸克林霉素和适宜辅料组成,阿达帕林是一种视黄醇类化合物,具有抑制人类多形核白细胞的化学趋化反应,并可通过抑制花生四烯酸化脂氧化反应转化为炎症媒介物来抑制多形白细胞的代谢,具有溶解粉刺,缓解痤疮的炎性反应;盐酸克林霉素抑制蛋白质合成过程中肽链的延长,从而影响了细菌细胞蛋白质的合成。根据目前已完成的临床试验研究,初步证明阿达帕林的抗皮脂分泌作用和盐酸克林霉素的抗痤疮丙酸杆菌作用[1],两者配合具有协同作用而达到良好治疗目的,用于治疗寻常性痤疮。
复方制剂中的盐酸克林霉素(clindamycin hydro-chloride)是抗生素类药物,为林可霉素的衍生物。克林霉素对革兰阳性菌和厌氧菌有良好的抗菌活性,临床供应剂型多样,无需进行皮肤过敏性试验,被广泛应用于临床各科敏感菌引起的各种感染,疗效确切[2]。
参阅文献,大多采用质谱和梯度洗脱方式对盐酸克林霉素的有关物质进行研究。孙秋实等[3]对盐酸克林霉素中的有关物质进行了分析研究,包括林可霉素异构体、林可霉素、克林霉素B、7-表克林霉素、克林霉素异构体及去氢克林霉素;梁键谋等[4]亦对克林霉素磷酸酯注射剂中林可霉素、克林霉素B等杂质进行了分析研究;黄明旺等[5]对克林霉素主要杂质在合成过程中的形成机理进行研究;王建等[6]建立全新的HPLC-UV梯度洗脱法测定克林霉素棕榈酸酯原料、分散片、颗粒及干混悬剂的有关物质;夏振华等[7]在流动相体系中不含反离子试剂条件下利用紫外检测器检测,克林霉素、克林霉素B及其他杂质得到很好的分离。根据以上调研和本品剂型特征,克林霉素杂质谱中可能含有林可霉素、克林霉素B、7-差向克林霉素、7-表林可霉素4种杂质,由于本品处方组成复杂,考虑采用梯度洗脱方式对杂质进行检测。
本研究在参照中国药典2015年版二部中盐酸克林霉素原料研究方法[8]973和欧洲药典8.0版中盐酸克林霉素原料药有关物质检查方法[9]的基础上,进行大量的实验摸索,重点关注复方制剂中相关的辅料对杂质检测的干扰以及强制降解试验中主药和各杂质的分离情况,最终用HPLC梯度洗脱的方法对本品中克林霉素的有关物质进行准确控制。
1 仪器与试药赛默飞公司戴安U3000高效液相色谱仪,PDA-3000检测器,变色龙工作站(Chromeleon 7.0);安捷伦公司1120高效液相色谱仪,可变波长扫描紫外检测器(VWD),EZChrom Compact 3.3.0工作站;Waters公司XBridge C18色谱柱(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶)。
复方阿达帕林盐酸克林霉素凝胶(兆科药业(合肥)有限公司提供,规格为5 g:5 mg阿达帕林与50 mg盐酸克林霉素,批号20140808、20140809、20140810)。克林霉素对照品(中国食品药品检定研究院提供,批号130422-200705,纯度86.0%);阿达帕林对照品(USP提供,批号20128,纯度99.7%);林可霉素对照品(EP提供,批号L0650000);克林霉素B对照品(中国食品药品检定研究院提供,批号130576-200901,纯度87.9%);7-差向克林霉素(Toronto Research Chemicals Inc提供,批号11-JQW-34-4)。乙腈(TEDIA公司)为色谱纯;磷酸二氢钾(国药集团化学试剂有限公司)、氢氧化钾(国药集团化学试剂有限公司)为分析纯;水为自制超纯水。
2 色谱条件采用Waters XBridge C18色谱柱(250 mm×4.6 mm,5 μm),以磷酸二氢钾溶液(每1 mL中含磷酸二氢钾6.8 mg,用5%的氢氧化钾溶液调节pH至7.5)为流动相A,乙腈为流动相B,梯度洗脱(0~35 min:B相21%;35~40 min:B相21%→35%;40~78 min:B相35%;78~79 min:B相35%→21%;79~90 min:B相21%),流速0.8 mL·min-1,检测波长210 nm,柱温30 ℃,进样量20 μL。
3 溶液配制 3.1 溶解溶剂磷酸二氢钾溶液-乙腈(55:45)。
3.2 空白基质溶液取空白基质4 g,置10 mL量瓶中,加15%氯化钠溶液0.5 mL,振摇至均匀,加溶解溶剂溶解并稀释至刻度,10 000 r·min-1离心5 min,取上清液过滤,取续滤液即得。
3.3 供试品溶液取本品4 g(约相当于克林霉素40 mg),置10 mL量瓶中,加15%氯化钠溶液0.5 mL,振摇至均匀,加溶解溶剂溶解并稀释至刻度,10 000 r·min-1离心5 min,取上清液过滤,取续滤液即得。
3.4 林可霉素对照品溶液取林可霉素对照品适量,精密称定,加溶解溶剂溶解并稀释成每1 mL中含50 μg的溶液,即得。
3.5 克林霉素B对照品溶液取克林霉素B对照品适量,精密称定,加溶解溶剂溶解并稀释成每1 mL中含80 μg的溶液,即得。
3.6 7-差向克林霉素对照品溶液取7-差向克林霉素对照品适量,精密称定,加溶解溶剂溶解并稀释成每1 mL中含50 μg的溶液,即得。
3.7 7-表林可霉素对照品溶液取7-表林可霉素对照品适量,精密称定,加溶解溶剂溶解并稀释成每1 mL中含50 μg的溶液,即得。
3.8 阿达帕林对照品溶液取阿达帕林对照品(105 ℃干燥2 h)适量,精密称定,用四氢呋喃溶解并稀释成每1 mL中含10 μg的溶液,即得。
4 方法学考察根据2015年版中国药典四部中关于药品质量标准分析方法验证指导原则[10]374的要求,进行了专属性、稳定性、耐用性等方法学验证,进一步确证新开发的复方凝胶中克林霉素有关物质方法的可靠性及准确性。
以中国药典2015年版二部中盐酸克林霉素原料有关物质研究方法[8]973,974在分析本品时,发现杂质林可霉素和7-表林可霉素出峰的时间附近有辅料出峰,因此辅料干扰了已知杂质的检测,所以根据复方制剂中每个原料、辅料的理化性质初步确定了克林霉素有关物质研究方法的优化思路:①通过HPLC分析确定在有关物质色谱分析条件下出峰的各个辅料;②根据处方中原料、辅料溶解性差异,通过改变供试品溶液的配制溶剂优化条件;③通过原料、辅料极性差异调整流动相的比例优化条件。通过上述途径,经大量试验摸索最终得出复方阿达帕林盐酸克林霉素凝胶中盐酸克林霉素有关物质检测方法。
4.1 专属性试验按照“2”项下的色谱条件,分别取流动相、空白基质、对照品(林可霉素、克林霉素B、7-表林可霉素、7-差向克林霉素、阿达帕林)和复方凝胶样品的溶液进样测定,以考察流动相、空白基质和阿达帕林等是否干扰复方凝胶中盐酸克林霉素有关物质的检查。研究结果表明,阿达帕林和空白基质均不干扰复方凝胶中盐酸克林霉素有关物质的检测;4种已知杂质林可霉素、克林霉素B、7-差向克林霉素、7-表林可霉素和其余的未知杂质以及克林霉素的分离度均大于1.5;因此,可以证明此方法专属性好。色谱图见图 1。
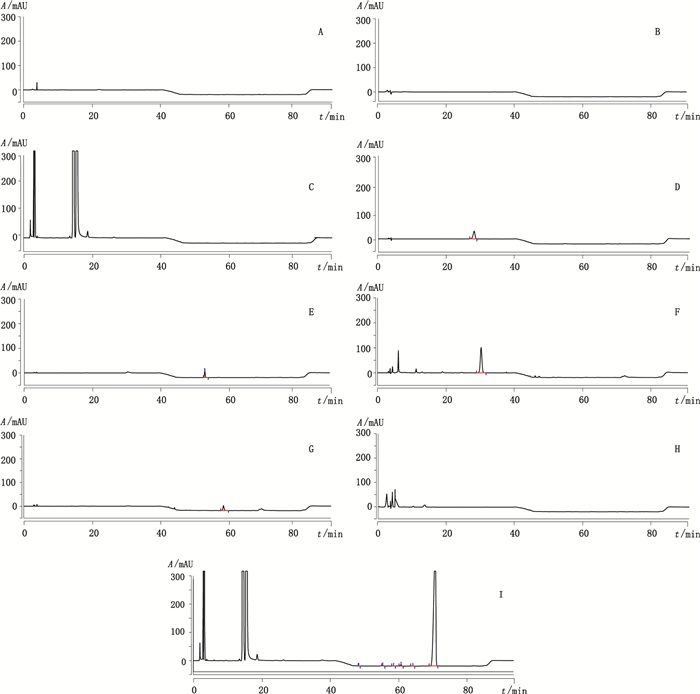
|
A.流动相A(mobile phase A) B.流动相B(mobile phase B) C.空白基质(blank matrix) D.林可霉素对照品(lincomycin reference substance) E.克林霉素B对照品(clindamycin B reference substance) F.7-表林可霉素对照品(7-epi-lincomycin reference substance) G.7-差向克林霉素对照品(7-epimeric clindamycin reference substance) H.阿达帕林对照品(adapalene reference substance) I.复方凝胶样品(compound gel sample) 图 1 专属性试验色谱图 Figure 1 Chromatograms of specificity test |
取本品4 g(约相当于克林霉素40 mg),分别置10 mL量瓶中,加15%氯化钠溶液0.5 mL,振摇至均匀后,进行如下处理:(1)加2 mol·L-1盐酸溶液0.5 mL,放置0.5 h,用2 mol·L-1氢氧化钠溶液0.5 mL中和,加溶解溶剂稀释至刻度,10 000 r·min-1离心5 min,取上清液过滤,取续滤液即得酸破坏溶液;(2)加2 mol·L-1氢氧化钠溶液0.5 mL,放置0.5 h,用2 mol·L-1盐酸溶液0.5 mL中和,加溶解溶剂稀释至刻度,10 000 r·min-1离心5 min,取上清液过滤,取续滤液即得碱破坏溶液;(3)置4 500 lx照度下0.5 h,加溶解溶剂稀释至刻度,10 000 r·min-1离心5 min,取上清液过滤,取续滤液即得光照破坏溶液;(4)置105 ℃烘箱2 h,加溶解溶剂稀释至刻度,10 000 r·min-1离心5 min,取上清液过滤,取续滤液即得高温破坏溶液;(5)加3%过氧化氢溶液0.5 mL,放置10 min,加溶解溶剂稀释至刻度,10 000 r·min-1离心5 min,取上清液过滤,取续滤液即得氧化破坏溶液。将上述5种破坏溶液及“3.3”项下未破坏的供试品溶液按“2”项下色谱条件进样测定,结果表明本品在上述条件下的降解产物与主峰完全分离,杂质间分离度良好。色谱图见图 2。
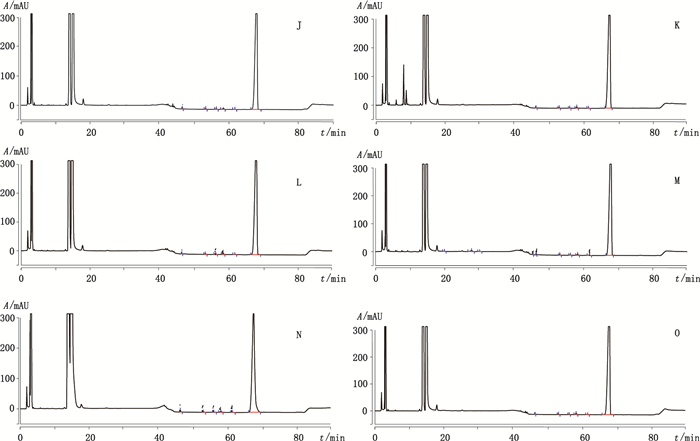
|
J.酸破坏样品(acid degradation sample) K.碱破坏样品(alkali degradation sample) L.光破坏样品(light degradation sample) M.热破坏样品(heat degradation sample) N.氧化破坏样品(oxidative degradation sample) O.未破坏样品[testing sample(not degraded)] 图 2 强制降解试验色谱图 Figure 2 Chromatograms of forced degradation test |
取林可霉素对照品约10 mg,置50 mL量瓶中,加溶解溶剂溶解并稀释至刻度,摇匀,精密量取该溶液适量,用溶解溶剂稀释成0.04、0.06、0.08、0.1、0.12 mg·mL-1的溶液;精密量取上述系列溶液各20 μL进样测定,记录峰面积,回归方程:
Y=1.338×108X+1.738×104 r=0.999 9
结果表明林可霉素质量浓度在0.04~0.12 mg·mL-1范围内呈良好线性。
取克林霉素B对照品约10 mg,置25 mL量瓶中,加溶解溶剂溶解并稀释至刻度,摇匀,精密量取该溶液适量,用溶解溶剂稀释成0.03、0.05、0.07、0.09、0.11、0.13 mg·mL-1的溶液;分别精密量取上述系列溶液各20 μL进样测定,记录峰面积,回归方程:
Y=8.917×107X-2.031×104 r=0.999 5
结果表明克林霉素B质量浓度在0.03~0.13 mg·mL-1范围内呈良好线性。
将包装规格为1 mg的7-差向克林霉素对照品,置5 mL量瓶中,加溶解溶剂溶解并稀释至刻度,摇匀,精密量取该溶液适量,用溶解溶剂稀释成0.04、0.06、0.08、0.1、0.12 mg·mL-1的溶液;分别精密量取上述系列溶液各20 μL进样测定,记录峰面积,回归方程:
Y=8.414×107X-2.932×104 r=0.999 9
结果表明7-差向克林霉素质量浓度在0.04~0.12 mg·mL-1范围内呈良好线性。
取林可霉素对照品约10 mg,置50 mL量瓶中,加溶解溶剂溶解并稀释至刻度,摇匀,精密量取该溶液适量,用溶解溶剂稀释成0.04、0.06、0.08、0.1、0.12 mg·mL-1的溶液;精密量取上述系列溶液各20 μL进样测定,记录峰面积,回归方程:
Y=1.338×108X+1.738×104 r=0.999 9
结果表明林可霉素质量浓度在0.04~0.12 mg·mL-1范围内呈良好线性。
4.4 检测限及定量限测定取线性关系考察项下0.03 mg·mL-1克林霉素B溶液,用溶解溶剂稀释成一系列浓度,照上述色谱条件进样测定,结果检测限按信噪比=3计算为0.04 μg,定量限按信噪比=10计算为0.12 μg。
取线性关系考察项下0.04 mg·mL-1 7-差向克林霉素溶液,用溶解溶剂稀释成一系列浓度,照上述色谱条件进样测定,结果检测限按信噪比=3计算为0.08 μg,定量限按信噪比=10计算为0.2 μg。
取线性关系考察项下0.04 mg·mL-1林可霉素溶液,用溶解溶剂稀释成一系列浓度,照上述色谱条件进样测定,结果检测限按信噪比=3计算为0.000 16 μg,定量限按信噪比=10计算为0.008 μg。
取克林霉素对照品约10 mg,精密称量,置10 mL量瓶中,加溶解溶剂溶解并稀释至刻度,得克林霉素对照品储备液;将克林霉素对照品储备液用溶解溶剂稀释成一系列浓度,照上述色谱条件进样测定,结果检测限按信噪比=3计算为0.02 μg,定量限按信噪比=10计算为0.1 μg。
4.5 精密度试验取线性关系考察项下0.08 mg·mL-1林可霉素溶液、0.09 mg·mL-1克林霉素B溶液、0.08 mg·mL-1 7-差向克林霉素溶液以及检测限及定量限测定项下0.1 mg·mL-1克林霉素溶液分别连续进样测定6次,记录峰面积。结果林可霉素、克林霉素B、7-差向克林霉及克林霉素峰面积的RSD分别为0.56%、0.51%、0.38%及0.47%,表明精密度良好。
4.6 加样回收率试验取林可霉素对照品11.33 mg,置25 mL量瓶中,加溶解溶剂溶解并定容,摇匀,即得林可霉素对照品储备液;精密量取林可霉素对照品储备液2.0 mL,置10 mL量瓶中,加溶解溶剂稀释至刻度,得林可霉素对照品溶液。精密称取本品适量(约相当于克林霉素40 mg),置10 mL量瓶中,加15%氯化钠溶液约0.5 mL,分别精密加入林可霉素对照品储备液1.0、2.0和3.0 mL,以溶解溶剂稀释至刻度,10 000 r·min-1离心5 min后取上清液,滤过,即得供试溶液。每个浓度梯度配制3份供试溶液,共9份溶液。取对照品溶液及供试溶液进样测定,按外标法以峰面积计算回收率。结果见表 1。
|
|
表 1 林可霉素回收率试验 Table 1 The recoveries of lincomycin |
按照“3.3”项下方法配制供试品溶液;精密量取供试品溶液1.0 mL,置50 mL量瓶中,加溶解溶剂稀释至刻度,摇匀,即得自身对照溶液。在柱温变化为±5 ℃,检测波长变化为±5 nm及流动相pH变化为±0.2的试验条件下进样,分别计算最大单杂(林可霉素)及总杂(林可霉素、克林霉素B、7-差向克林霉素及未知杂质)的量。结果柱温变化(25 ℃,30 ℃,35 ℃),总杂含量分别为1.45%、1.45%、1.41%,最大单杂含量分别为0.67%、0.66%、0.66%;检测波长变化(205 nm,210 nm,215 nm),总杂含量分别为1.46%、1.45%、1.46%,最大单杂含量分别为0.73%、0.66%、0.70%;流动相pH变化(7.30,7.50,7.70),总杂含量分别为1.37%、1.45%、1.36%,最大单杂含量分别为0.76%、0.66%、0.63%。结果表明,最大单杂和总杂含量变化均在±0.1%内,表明本法对柱温、检测波长、流动相pH变化的耐用性较好。
4.8 稳定性试验取供试品溶液、自身对照溶液分别在配制后0、3、6、9 h进样测定,记录峰面积,供试品溶液主峰面积的RSD为0.70%,自身对照溶液峰面积的RSD为0.22%。在0、3、6、9 h时总杂质含量分别为1.58%、1.56%、1.56%和1.48%,说明供试品溶液和自身对照溶液在0~9 h内,杂质无明显变化,因此供试品溶液和自身对照溶液可于室温稳定保存9 h。
5 样品测定采用本文方法对3批样品(20140808、20140809、20140810)进行有关物质检测,记录色谱图,按外标法计算已知杂质林可霉素,按照自身对照法计算其他已知杂质和未知单杂及总杂含量,3批样品的有关物质测定结果见表 2。
|
|
表 2 样品有关物质测定结果 Table 2 Results of relative substance test |
由于本品是卡波姆作为溶胀基质,采用15%氯化钠溶液预处理样品,对水凝胶中高分子链产生影响[11],再以流动相溶解和稀释样品,保证样品以溶液状态进样分析,且15%氯化钠溶液在本色谱条件下无明显信号,因此本系统中采用氯化钠溶液对本品进行前处理是该检测方法成功的前提。
6.2 辅料对杂质检测的影响复方阿达帕林盐酸克林霉素凝胶的辅料组成中包含凝胶基质、保湿剂、附加剂、pH调节剂和注射用水。通过各辅料HPLC检测图谱分析,对羟基苯甲酸甲酯、乙二醇苯醚、依地酸二钠、三乙醇胺卡波姆980等辅料均存在干扰盐酸克林霉素有关物质检查的可能,其中依地酸二钠、三乙醇胺和卡波姆980出峰时间相对靠前,约在2 min左右,但是对羟基苯甲酸甲酯和乙二醇苯醚均在5 min之后出峰(对羟基苯甲酸甲酯保留时间为5.8 min,乙二醇苯醚保留时间为5.7 min),因此对羟基苯甲酸甲酯和乙二醇苯醚干扰有关物质检查风险较大。
由于凝胶剂相对于一般固体制剂,其处方组成相对复杂,且本品为水性凝胶,加入防腐剂保证产品的质量和有效期,鉴于每类防腐剂都有对其不敏感的微生物存在,采用复合防腐剂无疑可以扩大抑菌谱[12],同时借鉴复方克林霉素磷酸酯维A酸凝胶(商品名:ZIANA®,MEDICIS公司)的说明书,综合考虑本品为水性凝胶更容易被微生物污染,因此本品在处方设计中采用2种防腐剂(对羟基苯甲酸甲酯和乙二醇苯醚)联合使用。通过对防腐剂等辅料和杂质的结构分析,并根据其极性差异优化检测方法,从而保证杂质的有效检出和分离。
6.3 样品溶解溶剂的选择由于辅料中对羟基苯甲酸甲酯在210 nm处有强吸收,但是此辅料是极微溶于水,而盐酸克林霉素易溶于水,因此初步尝试用纯水做溶解溶剂配制供试品溶液,并降低供试品浓度为1 mg·mL-1,结果是杂质林可霉素保留时间为4.6 min,7-表林可霉素保留时间为5.2 min,辅料峰明显减少,但是在5~7 min处仍然有干扰杂质林可霉素和7-表林可霉素检测的辅料峰。因此需要继续优化,参考中国药典2010年版二部盐酸克林霉素有关物质项下色谱条件,将溶解溶剂更换为磷酸二氢钾溶液-乙腈(55:45),并尝试对流动相的比例和洗脱时间进行优化。
6.4 流动相的选择和梯度优化在参照2015年版中国药典中盐酸克林霉素胶囊[8]974品种项下有关物质色谱条件,进行优化,并将等度洗脱改为梯度洗脱,再根据本品中所使用的辅料与盐酸克林霉素的相关工艺杂质的极性差别,在反相HPLC色谱系统中,化合物极性越大,就越容易被先洗脱出来,基于本品中辅料极性较大,盐酸克林霉素及其工艺杂质极性相对较小,因此调整流动相中水相和有机相的比例和洗脱时间,使有机相B相比例由原来的40%降低至20%,这样可以让辅料峰先洗脱出来,再将有机相B相比例升高,使盐酸克林霉素及其杂质后洗脱出来。本系统分析时间较长,但能够保证本品中辅料峰不干扰杂质峰检出,且各杂质组分完全分离。通过摸索,最终确定了其梯度洗脱方法。
6.5 盐酸克林霉素及其制剂杂质检测方法和标准制定概述经检索,现行版各国药典收录的盐酸克林霉素及其制剂标准中有关物质检查方法,均采用等度洗脱,针对本品制剂处方的实际情况,开发出适合本品制剂的杂质检测的新方法,该方法专属性好,能够有效检出和分离各已知杂质和未知杂质。
本品标准中杂质限度制定,参照了国家食品药品监督管理局颁布的盐酸克林霉素注射液标准(WS1-(X-029)-2003Z-2011)[13],具体为:林可霉素按外标法计算不得大于3.0%,克林霉素B(相对保留时间约为0.78)及7-差向克林霉素(相对保留时间约为0.86)不得大于对照溶液主峰面积0.5倍(1.0%),其他单个杂质不得大于对照溶液主峰面积0.5倍(1.0%),各杂质峰面积之和不得大于对照溶液主峰面积3倍(6.0%)。经检索,该标准其杂质限度要求比该品种其他制剂高。
| [1] |
陈兴平, 李慎秋, 李家文, 等. 盐酸克林霉素凝胶治疗寻常性痤疮的临床研究[J]. 医药导报, 2002, 21(6): 346. CHEN XP, LI SQ, LI JW, et al. Clinical study of clindamycin hydrochloride gel in the treatment of Acne Vulgaris[J]. Her Med, 2002, 21(6): 346. |
| [2] |
陶文筠, 郭代红, 谭次娥. 279例克林霉素临床用药分析[J]. 中国药师, 2005, 8(8): 658. TAO WJ, GUO DH, TAN CE. Elinical analysis of clindamycin in 279 cases[J]. China Pharm, 2005, 8(8): 658. |
| [3] |
孙秋实, 李悦, 王慧敏, 等. LC-MS法研究盐酸克林霉素中的有关物质[J]. 药物分析杂志, 2011, 31(6): 10593. SUN QS, LI Y, WANG HM, et al. LC-MS studies on related substances in clindamycin hydrochloride[J]. Chin J Pharm Anal, 2011, 31(6): 10593. |
| [4] |
梁键谋, 王知坚, 阮昊, 等. HPLC梯度洗脱法检测克林霉素磷酸酯及其注射剂的有关物质[J]. 中国现代应用药学, 2012, 29(8): 726. LIANG JM, WANG ZJ, RUAN H, et al. HPLC gradient elution determination of related substances of clindamycin phosphate and its injection[J]. Chin J Mod Appl Pharm, 2012, 29(8): 726. |
| [5] |
黄明旺, 杨伟强, 徐峰, 等. 克林霉素工艺的改进及其主要杂质形成机理的研究[J]. 广东化工, 2016, 43(1): 790. HUANG MW, YANG WQ, XU F, et al. Improved synthesis of clindamycin and study the formation mechanism of its main impurities[J]. Guangdong Chem Ind, 2016, 43(1): 790. |
| [6] |
王建, 王红波, 孟磊, 等. 梯度洗脱HPLC法测定盐酸克林霉素棕榈酸酯及制剂的有关物质[J]. 药物分析杂志, 2012, 32(2): 314. WANG J, WANG HB, MENG L, et al. Isocratic HPLC determination of related substances of clindamycin palmitate hydrochloride and its drug products[J]. Chin J Pharm Anal, 2012, 32(2): 314. |
| [7] |
夏振华, 张国峰, 缪刚. HPLC测定盐酸克林霉素的含量[J]. 药物分析杂志, 1994, 14(6): 33. XIA ZH, ZHANG GF, MIU G. Determination of clindamycin hydrochloride by HPLC[J]. Chin J Pharm Anal, 1994, 14(6): 33. |
| [8] |
中国药典2015年版. 二部[S]. 2015: 973, 974 ChP 2015.Vol Ⅱ[S].2015:973, 974 |
| [9] |
EP 8.0[S].2014:1912
|
| [10] |
中国药典2015年版. 四部[S]. 2015: 374, 375, 376 ChP 2015.Vol Ⅳ[S].2015:374, 375, 376 |
| [11] |
刘超英, 张慧慧. HPLC法测定复方苯妥英钠凝胶剂中苯妥英钠的含量[J]. 中国药师, 2015, 15(3): 345. LIU CY, ZHANG HH. Determination of phenytoin sodium in compoud phenytoin sodium gels by HPLC[J]. China Pharm, 2015, 15(3): 345. |
| [12] |
钱木水, 叶兴法, 倪赤杭, 等. 液体制剂中防腐剂选用的体会[J]. 海峡药学, 2009, 2(3): 32. QIAN MS, YE XF, NI CH, et al. The experience of preservatives in liquid preparations[J]. Strait Pharm, 2009, 2(3): 32. |
| [13] |
WS1-(X-029)-2003Z-2011盐酸克林霉素注射液标准[S]. 2011 WS1-(X-029)-2003Z-2011 Clindamycin Hydrochloride Injection Standards[S].2011 |
 2018, Vol. 38
2018, Vol. 38 
