2. 浙江省食品药品监督管理局, 杭州 310012
2. Zhejiang Food and Drug Administration, Hangzhou 310012, China
正天丸由钩藤、白芍、川芎、当归、地黄、白芷、防风、羌活、桃仁、红花、细辛、独活、麻黄、附片、鸡血藤共15味中药制成[1],由四大头痛古方(麻黄附子细辛汤、川芎茶调散、桃红四物汤、四藤消震饮)演变而成[2],具有疏风活血、养血平肝、通络止痛等功效,临床用于治疗外感风邪、瘀血阻络、血虚失养、肝阳上亢引起的偏头痛、紧张性头痛、神经性头痛、颈椎病型头痛、经前头痛。正天丸涉及15味中药,成分相当复杂,中国药典仅对芍药苷做了定量质控要求。黄澜等[3]利用HPLC同时测定正天丸中芍药苷、阿魏酸、升麻素苷、5-O-甲基维斯阿米醇苷的含量,汪建君等[4]采用HPLC法测定正天丸和正天胶囊中羟基红花黄色素A的含量,其他成分的研究尚未见报道。上述成分研究,涉及药材有限,作为质控方法较为片面,而指纹图谱法能尽可能多地反映药物内在质量信息,在中药质量控制领域应用广泛[5-10],能对成分复杂药物做出系统、客观及科学评价。一测多评法(quantitative analysis of multi-componentsby single-marker,QAMS)是借助相对校正因子,只需测定1个成分(内参物)即可实现对多个成分的含量测定[11]。鉴于大多中药对照品制备困难,价格昂贵,或易于分解等因素难以获得,一测多评法能有效解决以上难题,在中药成分分析中逐渐得以广泛应用[12-14]。
本研究采用指纹图谱和一测多评相结合的方法,在建立正天丸指纹图谱的基础上,建立QAMS法同时测定正天丸中升麻素苷、5-O-甲基维斯阿米醇苷、阿魏酸、欧前胡素、异欧前胡素5个化学成分含量的方法,为正天丸质量控制和评价提供更好的技术手段。
1 仪器和试药Waters 2695-2996型高效液相色谱仪(沃特世公司);XS-105电子分析天平(Mettler-Toledo公司);KQ5200超声波清洗仪(昆山市超声仪器有限公司;功率250 W,频率40 kHz);Milli-Q Integral 5超纯水机(默克密理博公司)。Dimonsil C18(2)色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶)。
正天丸12批,华润三九医药股份有限公司生产,批号分别为1503034H(编号S1)、1507001H(编号S2)、1507008H(编号S3)、1602028H(编号S4)、1508012H(编号S5)、1509011H(编号S6)、1511009H(编号S7)、1511030H(编号S8)、1512033H(编号S9)、1608007H(编号S10)、1609017H(编号S11)、1609024H(编号S12)。
对照品升麻素苷(批号111522-201310,含量95%)、5-O-甲基维斯阿米醇苷(批号111523-201208,含量96.4%)、阿魏酸(批号110773-201313,含量99.6%)、欧前胡素(批号110826-201214,含量99.5%)、异欧前胡素(批号110827-201109,含量99.6%)均来源于中国食品药品检定研究院;乙腈(默克公司)为色谱纯,甲醇(天津基准化学试剂有限公司)及磷酸(青岛宝泽化工有限公司)为分析纯,水为超纯水。
2 方法与结果 2.1 色谱条件色谱柱:Dimonsil C18(2)(4.6 mm×250 mm,5 μm);流动相:乙腈(A)-0.095%磷酸水溶液(B),梯度洗脱(0~5 min,10%A→20%A;5~40 min,20%A→40%A;40~50 min,40%A;50~65 min,40%A→70%A;65~70 min,70%A);流速:1.0 mL·min-1;检测波长:310 nm;柱温:30 ℃;进样量:10 μL。
2.2 溶液的制备 2.2.1 混合对照品溶液取升麻素苷、5-O-甲基维斯阿米醇苷、阿魏酸、欧前胡素、异欧前胡素的对照品各适量,精密称定,加甲醇制得含升麻素苷0.022 mg·mL-1,5-O-甲基维斯阿米醇苷0.016 mg·mL-1,阿魏酸0.013 mg·mL-1,欧前胡素0.024 mg·mL-1,异欧前胡素0.017 mg·mL-1的混合对照品溶液,滤过(0.22 μm微孔滤膜),取续滤液,即得。
2.2.2 供试品溶液取本品1袋,研细,精密称取细粉1.0 g,置具塞锥形瓶中,精密加入甲醇30 mL,称量,超声处理60 min(功率250 W,频率40 kHz),取出,放冷,再称量,用甲醇补足减失的量,摇匀,滤过(0.22 μm微孔滤膜),取续滤液,即得。
2.3 HPLC指纹图谱的建立 2.3.1 精密度试验取供试品溶液(样品批号1609024H),按“2.1”项色谱条件,连续进样5次,记录色谱图,以欧前胡素为参比峰,计算共有峰相对峰面积的RSD均小于0.56%,相对保留时间的RSD均小于0.05%,表明仪器精密度良好。
2.3.2 稳定性试验取供试品溶液(样品批号1609024H),按“2.1”项色谱条件,分别在0、3、6、9、12、24、36、48 h进样,记录色谱图,以欧前胡素为参比峰,计算各共有峰相对峰面积的RSD均小于0.89%,相对保留时间的RSD均小于0.06%,表明供试品溶液在48 h内稳定。
2.3.3 重复性试验取样品(批号1609024H)6份,按“2.2.2”项下方法制备供试品溶液,在“2.1”项色谱条件下分析,记录色谱图,以欧前胡素为参比峰,计算各共有峰相对峰面积的RSD均小于0.28%,相对保留时间的RSD均小于0.08%,表明方法重复性良好。
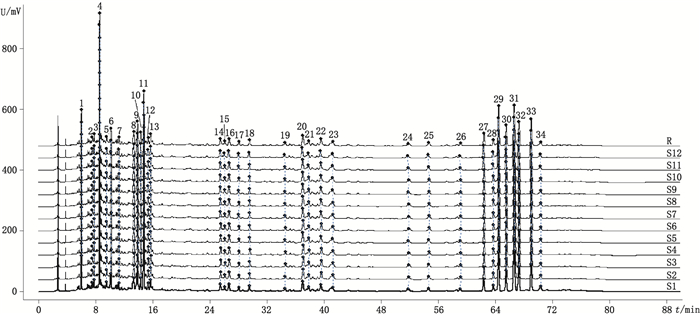
2.3.4 指纹图谱的建立及相似度评价取S1~S12号正天丸样品,分别按“2.2.2”项下方法制备供试品溶液,依“2.1”项色谱条件进行测定分析,记录色谱图。采用国家药典委员会推荐的《中药色谱指纹图谱相似度评价系统》(2012年版)对12张指纹图谱进行分析,设定S1号样品的图谱为参考图谱,时间窗宽度设为0.3 min,采用多点校正全谱峰匹配,共标定34个共有峰,生成指纹图谱共有模式(平均值法,R),见图 1。S1~S12号样品图谱与对照图谱的相似度分别为0.999、0.999、1.000、0.999、0.999、1.000、1.000、0.999、1.000、0.999、1.000、1.000,相似度均大于0.999,相似度高,符合指纹图谱相关要求。在34个共有峰中,以29号峰(欧前胡素)的面积适中,峰形较好,分离完全,设为参照峰(S),计算各共有峰的相对峰面积,相对峰面积见表 1。
|
图 1 12批正天丸HPLC指纹图谱和对照指纹图谱 Figure 1 Fingerprint of 12 batches of Zhengtian pills and the reference fingerprint |
|
|
表 1 12批样品(S1~S12号样品)共有峰相对峰面积 Table 1 The relative peak areas of 34 common peaks of 12 samples(sample No. S1-S12) |
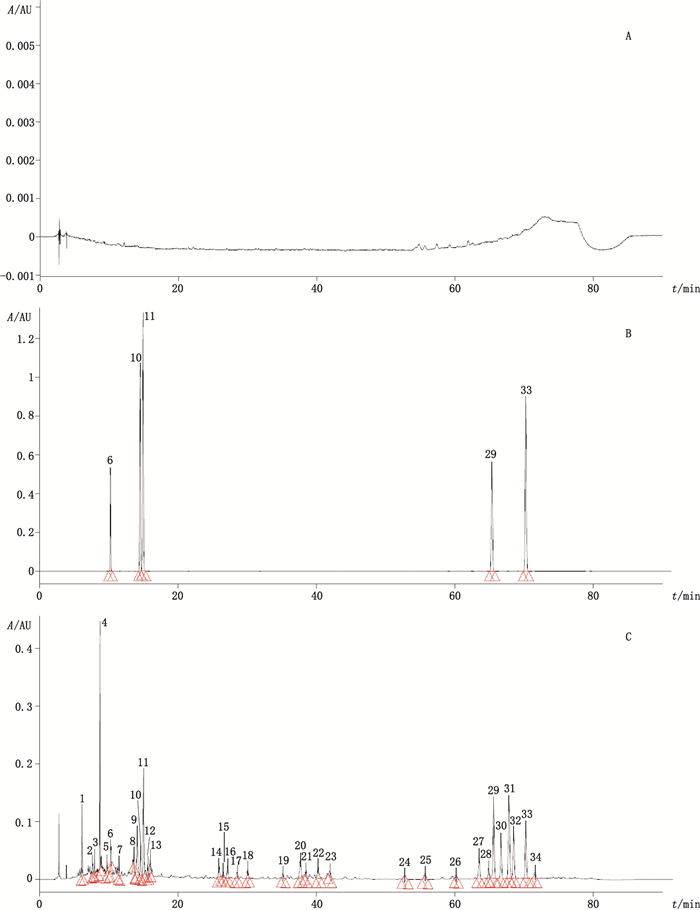
取空白溶剂、混合对照品溶液和供试品溶液,依“2.1”项色谱条件依次测定,色谱图见图 2。由色谱图可知,在各共有峰保留时间区域内,空白溶剂峰无任何峰信号,表明其对指纹图谱无干扰。通过比对混合对照品和样品指纹图谱共有峰保留时间及色谱峰紫外吸收光谱特征可知,6号峰为升麻素苷,10号峰为5-O-甲基维斯阿米醇苷,11号峰为阿魏酸,29号峰为欧前胡素,33号峰为异欧前胡素。
|
6.升麻素苷(prim-O-glucosylcimifugin)10.5-O-甲基维斯阿米醇苷(5-O-methylvisammioside)11.阿魏酸(ferulic acid)29.欧前胡素(imperatorin)33.异欧前胡素(isoimperatorin) 图 2 空白溶剂(A)、混合对照品(B)和样品(C)HPLC图 Figure 2 HPLC chromatograms of solvent blank(A), mixed reference substances(B) and sample(C) |
分别精密吸取混合对照品溶液2、4、8、12、24、40 μL,按“2.1”项色谱条件进样测定,记录色谱图,以各组分峰面积(Y)对进样量(X,μg)进行回归处理,得各组分回归方程及线性范围见表 2。
|
|
表 2 5个化合物的回归方程及线性关系 Table 2 Regression equation and linear relation of 5 components |
取已知含量正天丸(批号1609024H),研细,取细粉6份,每份约0.5 g,精密称定,置200 mL具塞锥形瓶中,分别精密加入升麻素苷0.028 mg·mL-1,5-O-甲基维斯阿米醇苷0.046 mg·mL-1,阿魏酸0.057 mg·mL-1,欧前胡素0.590 mg·mL-1,异欧前胡素0.070 mg·mL-1混合对照品溶液2 mL,按“2.2.2”项下方法制备供试溶液,按“2.1”项下色谱条件进样测定,记录色谱图,计算回收率;结果见表 3。
|
|
表 3 正天丸5个成分的加样回收率结果(n=6) Table 3 Recoveries of 5 marker components in Zhengtian pills |
一测多评法是利用在一定的线性范围成分的量(质量或浓度)与检测器响应成正比的原理,用公式f(s/i)=fs/fi=(Wi×As)/(Ws×Ai)(式中As为内参物s的峰面积,Ws为内参物对照s的质量,Ai为某待测成分i的峰面积,Wi为某待测成分i的质量)算得RCF;在运用过程中,再通过RCF求算待测组分的质量Wi=f(s/i)×Ws×Ai /As。
分别精密吸取混合对照品溶液1、4、8、12、24、36、48 μL,按“2.1”项下色谱条件进样测定。以欧前胡素(s)为内参物,根据公式分别计算待测组分升麻素苷(i1)、5-O-甲基维斯阿米醇苷(i2)、阿魏酸(i3)和异欧前胡素(i4)的相对校正因子,结果见表 4。
|
|
表 4 4种成分相对校正因子 Table 4 The relative correction factors of four components |
精密量取混合对照品溶液10 μL,按“2.1”项下色谱条件测定,分别考察Waters 2695、Agilent 1260、Ultimate 3000 3种高效液相色谱仪和Dimonsil C18(2)(250 mm×4.6 mm,5 μm)、Agilent ZORBAX SB-C18(250 mm×4.6 mm,5 μm)、Thermo ODS C18(250 mm×4.6 mm,5 μm)3种色谱柱对相对校正因子的影响,结果见表 5。RSD均小于5%,表明不同色谱仪及色谱柱对相对校正因子无显著影响。
|
|
表 5 不同高效液相色谱仪及色谱柱的相对校正因子 Table 5 Relative correction factors obtained from different HPLC instruments and columns |
色谱峰的准确定位是保证一测多评法应用的前提,定位方法主要有相对保留值和保留时间差2种。目前,相对保留值定位法在QAMS中应用较多[13-14],本研究考察各组分相对保留值在不同品牌色谱仪和不同规格色谱柱中的重现性,结果(表 6)表明相对保留时间的重复性较好,RSD均小于5%,升麻素苷、5-O-甲基维斯阿米醇苷、阿魏酸、异欧前胡素的相对保留时间分别为0.15、0.22、0.23和1.08。
|
|
表 6 不同仪器和色谱柱相对保留值比较 Table 6 Relative retention time obtained from different HPLC instruments and columns |
精密吸取供试品溶液,按“2.1”项下色谱条件,分别采用外标法(ESM)和一测多评法(QASM)对正天丸中升麻素苷、5-O-甲基维斯阿米醇苷、阿魏酸、欧前胡素和异欧前胡素含量进行测定,并利用SPSS Statistics 22统计软件对2组检测结果进行成组t检验,考察2种方法显著性差异,结果见表 7。由表 7可知,2种方法无显著性差异(P>0.05),表明一测多评法可用于正天丸中5个化学成分的含量测定。
|
|
表 7 一测多评法(QASM)与外标法(ESM)测得的正天丸中5种成分含有量(mg·g-1,n=2) Table 7 Contents of 5 components in Zhengtian pills by quantitative analysis of multi-components by single-marker(QAMS) method and external standard method(ESM) |
正天丸由15味中药制得,其化学物质种类极其丰富,本指纹图谱法只是尽可能多地反映该药品内部质量信息,以达到质控目的。在研究过程中,作者曾参考中国药典[1]正天丸质量标准,用乙醇水溶液作为溶剂,但指纹图谱包含的信息量太少,改作甲醇作为溶剂时,色谱峰数量增多,但芍药苷色谱峰无法获取。
对于提取方式,先后比较超声、浸渍过夜及加热回流等,结果以加热回流所得指纹图谱峰面积和最大,但共有峰数量未见增多,考虑到实验成本及效率,最终选择超声处理60 min(功率250 W,频率40 kHz)来制备供试品溶液。
3.2 色谱条件优化通过比较不同流动相系统,发现乙腈-磷酸盐水溶液系统对正天丸指纹图谱分离效果最好,色谱峰主要集中在6~16 min及60~75 min范围内,通过调整流动相梯度程序,最终以“2.1”项下色谱条件试验得到指纹图谱分离度最佳,用时最短。通过查阅文献[15-16],确立药材中5个化学成分作为研究对象,从方法学验证及样品测定结果看,方法简便、快捷,重现性好。
本研究建立的指纹图谱包含34个共有峰,能较多地反映出正天丸内在质量信息,正天丸的指纹图谱联合一测多评法研究,可以将模糊鉴别和精准定量分析有机结合,既可以对药品整体质量做出客观系统评价,又可以利用部分指标性成分对其做出动态监测,为有效控制正天丸质量提供了科学依据。
| [1] |
中国药典2015年版. 一部[S]. 2015: 747 ChP 2015. Vol Ⅰ[S]. 2015: 747 |
| [2] |
陈倢, 梁伟雄, 秦劭晨, 等. 正天丸治疗偏头痛的有效性与安全性的系统评价[J]. 中国实验方剂学杂志, 2015, 21(19): 194. CHEN J, LIANG WX, QIN SC, et al. Systematic evaluation of effectiveness and safety of Zhengtian pills for migraine[J]. Chin J Exp Tradit Med Form, 2015, 21(19): 194. |
| [3] |
黄澜, 陈惠玲, 李玲玲. HPLC同时测定正天丸中芍药苷、阿魏酸、升麻素苷、5-O-甲基维斯阿米醇苷的含量[J]. 中国中药杂志, 2013, 38(13): 2114. HUANG L, CHEN HL, LI LL. Simultaneous determination of paeoniflorin, ferulic acid, prim-O-glucosylcimifugin and 4'-O-beta-glucopyranosyl-5-O-methylvisamminol in Zhengtian pills by HPLC[J]. China J Chin Mater Med, 2013, 38(13): 2114. |
| [4] |
汪建君, 李玲玲, 陈惠玲, 等. HPLC法测定正天丸和正天胶囊中羟基红花黄色素A的含量[J]. 中国药品标准, 2013, 14(3): 197. WANG JJ, LI LL, CHEN HL, et al. HPLC determination of hydroxysafflor yellow A in Zhengtian pills and Zhengtian capsules[J]. Drug Stand China, 2013, 14(3): 197. |
| [5] |
程红, 姚志红, 戴毅, 等. 中药复方制剂仙灵骨葆胶囊HPLC指纹图谱研究[J]. 中国药学杂志, 2013, 48(10): 772. CHENG H, YAO ZH, DAI Y, et al. HPLC fingerprint of Xianling Gubao capsules, a TCM prescription[J]. Chin Pharm J, 2013, 48(10): 772. |
| [6] |
潘伟东, 杜义龙, 赵胜男, 等. 韩信草的高效液相色谱指纹图谱及化学模式识别[J]. 药物分析杂志, 2015, 35(2): 250. PAN WD, DU YL, ZHAO SN, et al. HPLC fingerprint and chemical pattern recognition of Scutellaria indica[J]. Chin J Pharm Anal, 2015, 35(2): 250. |
| [7] |
于桂芳, 闫显光, 殷洪梅, 等. 益心舒片的HPLC指纹图谱[J]. 中国实验方剂学杂志, 2017, 23(1): 69. YU GF, YAN XG, YIN HM, et al. Fingerprint analysis of Yixinshu tablet by HPLC[J]. Chin J Exp Tradit Med Form, 2017, 23(1): 69. |
| [8] |
张春泥, 王英姿, 孙欣光, 等. HPLC-CAD结合化学计量学的川楝子饮片指纹图谱研究[J]. 药学学报, 2017, 52(3): 456. ZHANG CN, WANG YZ, SUN XG, et al. Chromatographic fingerprint analysis of Toosendan Fructus by HPLC-CAD coupled with chemometrics methods[J]. Acta Pharm Sin, 2017, 52(3): 456. |
| [9] |
何轶, 张聿梅, 鲁静, 等. 西黄丸中指标成分含量测定及挥发性成分指纹图谱的建立[J]. 药物分析杂志, 2016, 36(3): 480. HE Y, ZHANG YM, LU J, et al. Index component determination and the fingerprint chromatography of volatile components in Xihuang pills[J]. Chin J Pharm Anal, 2016, 36(3): 480. |
| [10] |
杨宁, 刘艳妮, 康杰芳. 山茱萸药材HPLC指纹图谱的优化研究[J]. 药物分析杂志, 2014, 34(11): 1989. YANG N, LIU YN, KANG JF, et al. Optimization of the HPLC fingerprint for Cornus officinalis[J]. Chin J Pharm Anal, 2014, 34(11): 1989. |
| [11] |
王智民, 高慧敏, 付雪涛, 等. "一测多评"法中药质量评价模式方法学研究[J]. 中国中药杂志, 2006, 31(23): 1925. WANG ZM, GAO HM, FU XT, et al. Multi-components quantitation by one marker new method for quality evaluation of Chinese herbal medicine[J]. China J Chin Mater Med, 2006, 31(23): 1925. DOI:10.3321/j.issn:1001-5302.2006.23.001 |
| [12] |
马会利, 郭庆梅, 周凤琴. "一测多评法"在中药质量控制中应用研究进展[J]. 山东中医药大学学报, 2014, 38(3): 282. MA HL, GUO QM, ZHOU FQ. Multi-components quantitation by one maker new method applied research progress in quality control of traditional Chinese medicine[J]. J Shandong Univ Tradit Chin Med, 2014, 38(3): 282. |
| [13] |
万青, 涂楚月, 熊慧, 等. 一测多评法测定藏药金腰草中4种黄酮类化学成分的含量[J]. 药物分析杂志, 2016, 36(6): 1053. WAN Q, TU CY, XIONG H, et al. Determination of four flavones in Chrysosplenium nudicaule Bunge by QAMS method[J]. Chin J Pharm Anal, 2016, 36(6): 1053. |
| [14] |
王晓燕, 霍甜甜, 李振国. 一测多评法同时测定杞菊地黄口服液中4种有效成分的含量[J]. 药物分析杂志, 2017, 37(2): 290. WANG XY, HUO TT, LI ZG. Simultaneous determination of 4 active components in Qijudihuang oral liquid by QAMS method[J]. Chin J Pharm Anal, 2017, 37(2): 290. |
| [15] |
赵博, 杨鑫宝, 杨秀伟, 等. HPLC法同时测定防风中6个主要成分的含量[J]. 药物分析杂志, 2013, 33(3): 382. ZHAO B, YANG XB, YANG XW, et al. Simultaneous determination of 6 major constituents in the roots of Saposhnikovia divaricata by HPLC[J]. Chin J Pharm Anal, 2013, 33(3): 382. |
| [16] |
邓瑞, 张静, 罗维早, 等. RRLC-UV同时测定川白芷中六种香豆素类成分的含量[J]. 中国中药杂志, 2010, 35(23): 3187. DENG R, ZHANG J, LUO WZ, et al. Quantitative determination of six coumarins in Angelica dahurica var.formosana by RRLC-UV[J]. China J Chin Mater Med, 2010, 35(23): 3187. |
 2018, Vol. 38
2018, Vol. 38 